IgA肾病合并急性肾盂肾炎
徐 峰 曾彩虹
病例摘要
病史女性,46岁,因“发热、腰痛20d,发现血清肌酐(SCr)升高半月”于2019-11-01入院。2019-10-10患者无明显诱因出现发热(最高39℃)、寒战、腰痛,伴尿频尿急尿痛,解茶色小便,恶心呕吐、腹泻,眼睑轻度水肿,无咳嗽咳痰,无肉眼血尿、皮疹、关节疼痛。2019-10-14当地医院查尿常规:尿蛋白3+、隐血3+,白细胞3+,血常规:白细胞7.76×109/L,中性粒细胞比例85.2%。血生化:SCr 288 μmol/L,血白蛋白27.3g/L,诊断为“尿路感染,急性肾损伤”,给予抗感染治疗和补液处理,3d后体温正常。2019-10-25国家肾脏疾病临床医学研究中心就诊,查尿蛋白2.17 g/24h,尿红细胞21.5/μl非均一型,尿白细胞757.5/μl,SCr 169 μmol/L、白蛋白35.3 g/L,于当地医院行肾脏CT平扫:左肾上极可疑小结节,泌尿系彩超:左肾上极混合性包块,右肾、输尿管、膀胱未见明显异常,继续住院予头孢他啶抗感染、补液治疗,2019-10-29当地复查SCr 200 μmol/L。为进一步诊治入院。
既往史2019年6月曾发作尿路感染,查血肌酐102 μmol/L,头孢地尼片治疗后好转。
个人史及家族史无特殊。
体格检查体温36.6℃,脉搏112次/min,呼吸19次/min,血压146/96 mmHg。BMI 28.44 kg/m2。发育正常,营养中等。全身浅表淋巴结无肿大。甲状腺不肿大,未触及结节。双肺呼吸音清晰,未闻及干湿啰音和胸膜摩擦音。心律齐,各瓣膜区未闻及心脏杂音。腹部平软未见异常。双下肢无水肿。
实验室检查
尿液 尿常规:蛋白阳性(2+),红细胞阳性(2+),白细胞阳性(3+),亚硝酸盐阳性(2+),红细胞计数98.6/μl,红细胞(高倍视野)17.8/HPF,白细胞计数797.9/μl,白细胞143.6/HPF;尿蛋白定量2.17 g/24h。尿NAG 27.6 U/(g·Cr),RB蛋白6.55 mg/L。
血液
血常规Hb 102 g/L,WBC 7.18×109/L,中性粒细胞比例78.4%,淋巴细胞比例15%,PLT 394×109/L。
血生化Alb 36.8 g/L,Glb 33.8 g/L,尿素氮7.7 mmol/L,SCr 153.8 μmol/L,UA 356 μmol/L,谷丙转氨酶22 U/L,谷草转氨酶25 U/L,三酰甘油2.69 mmol/L,胆固醇4.46 mmol/L,钠136.1 mmol/L,钾4.64 mmol/L,氯98.2 mmol/L,钙2.38 mmol/L,磷1.07 mmol/L,总二氧化碳24.7 mmol/L,eGFR 35 ml/(min·1.73m2);C反应蛋白32.8 mg/L。空腹血糖4.52 mmol/L,HbA1c 5.2%。
免疫学检验 抗磷脂酶A2受体抗体1.73 RU/ml,类风湿因子(RF)<20.0 IU/ml,抗链球菌溶血素“O”(ASO)69.1 IU/ml,补体4(C4)0.490 g/L、补体3(C3)1.610 g/L,免疫球蛋白E(IgE)<18.5 IU/ml,免疫球蛋白A(IgA)6.51 g/L,免疫球蛋白G(IgG)18.60 g/L,免疫球蛋白M(IgM)0.719 g/L;抗GBM抗体(酶标法)和ANCA抗体谱阴性,出血热特异性抗体阴性,抗核抗体谱和抗心磷脂抗体谱阴性,免疫固定电泳未见异常单克隆免疫条带,免疫球蛋白亚类(IgG4)774.00 mg/L。
传染病四项 乙型肝炎表面抗原、丙型肝炎抗体、梅毒抗体、艾滋病抗体均为阴性。
辅助检查
双肾B超(外院2019-10-30) 左肾106 mm×44 mm×53 mm,右肾108 mm×47 mm×54 mm。(1)双肾皮质回声增强;(2)左肾囊肿;(3)左肾结石,位于囊周。
心电图 大致正常心电图。
颈胸部CT (1)右肺中叶内侧段及左肺上叶舌段少许机化性炎症;(2)主动脉管壁钙化;(3)双侧腋下多发稍大淋巴结。
中段尿细菌培养+药敏 大肠埃希菌>104cfu/ml。对以下药物敏感:复方磺胺甲噁唑、呋喃妥因、妥布霉素、庆大霉素、阿米卡星、美罗培南、亚胺培南、头孢吡肟、头孢他啶、头孢替坦、哌拉西林/他唑巴坦。
入院后继续予抗感染治疗,患者尿路感染症状明显缓解,SCr逐渐下降,复查中段尿培养阴性,尿蛋白定量1.6 g/24h,尿红细胞计数302.9/μl,行肾活检进一步明确诊断。
肾活检
光镜 皮质肾组织1条,14个肾小球中1个球性废弃,1个细胞性、3个纤维细胞性新月体。正切肾小球增大,系膜区轻~中度增宽,系膜细胞和基质增多(图1A),毛细血管袢开放好,袢内单个核细胞3~8个,囊壁节段增厚分层。PASM-Masson:肾小球系膜区较多嗜复红物沉积(图1B)。肾小管间质中度慢性病变,斑片状肾小管萎缩、基膜增厚,伴轻度急性病变,小灶性肾小管上皮细胞刷状缘脱落,少量蛋白管型和中性粒细胞管型(图1C),部分小管基膜断裂,见小管炎和小管周围中性粒细胞聚集(图1D),间质大量单个核细胞、中性粒细胞和浆细胞浸润,灶性纤维化。小动脉节段透明变性,小叶间动脉弹力层增厚分层。
免疫荧光 肾小球5个,冰冻切片荧光染色IgA++(图1E)、IgM trace、C3++,呈颗粒状弥漫分布于系膜区。IgG、 C1q阴性。κ轻链+、λ轻链+,呈颗粒状弥漫分布于系膜区。
电镜 1个节段硬化的肾小球,未硬化区域系膜区增宽,系膜细胞增生伴基质增多,系膜区见高电子密度的致密物沉积(图1F)。肾小球毛细血管袢开放欠佳,节段袢内皮细胞成对,基膜厚390~690 nm,节段基膜内皮下区域增宽、疏松,增宽的内皮下区域偶见中等电子密度的致密物分布,上皮侧未见电子致密物沉积。肾小球足细胞足突融合广泛,约60%~70%,胞质较多微绒毛化。较多肾小管炎,肾小管周围见中性粒细胞聚集分布,个别肾小管管腔内亦见中性粒细胞聚集,间质较多中性粒细胞、浆细胞、淋巴细胞和巨噬细胞浸润,管周毛细血管内亦见中性粒细胞分布。
最后诊断(1)IgA肾病(牛津分型M ̄0 ̄E ̄0 ̄S ̄1 ̄T ̄1 ̄C ̄2);(2)急性肾小管间质性肾炎合并慢性病变(考虑肾盂肾炎相关)。
出院后予头孢呋辛抗感染及百令胶囊保肾治疗,2019-11-27门诊复查尿蛋白定量1.38 g/24h,尿红细胞计数13.4/μl,尿白细胞计数400.30/μl。SCr 154.7 μmol/L,尿酸381 μmol/L,胱抑素C 2.03 mg/L,eGFR(CKD-EPI) 34 ml/(min·1.73m2)。予调整抗感染治疗方案,加用泼尼松及坎地沙坦。
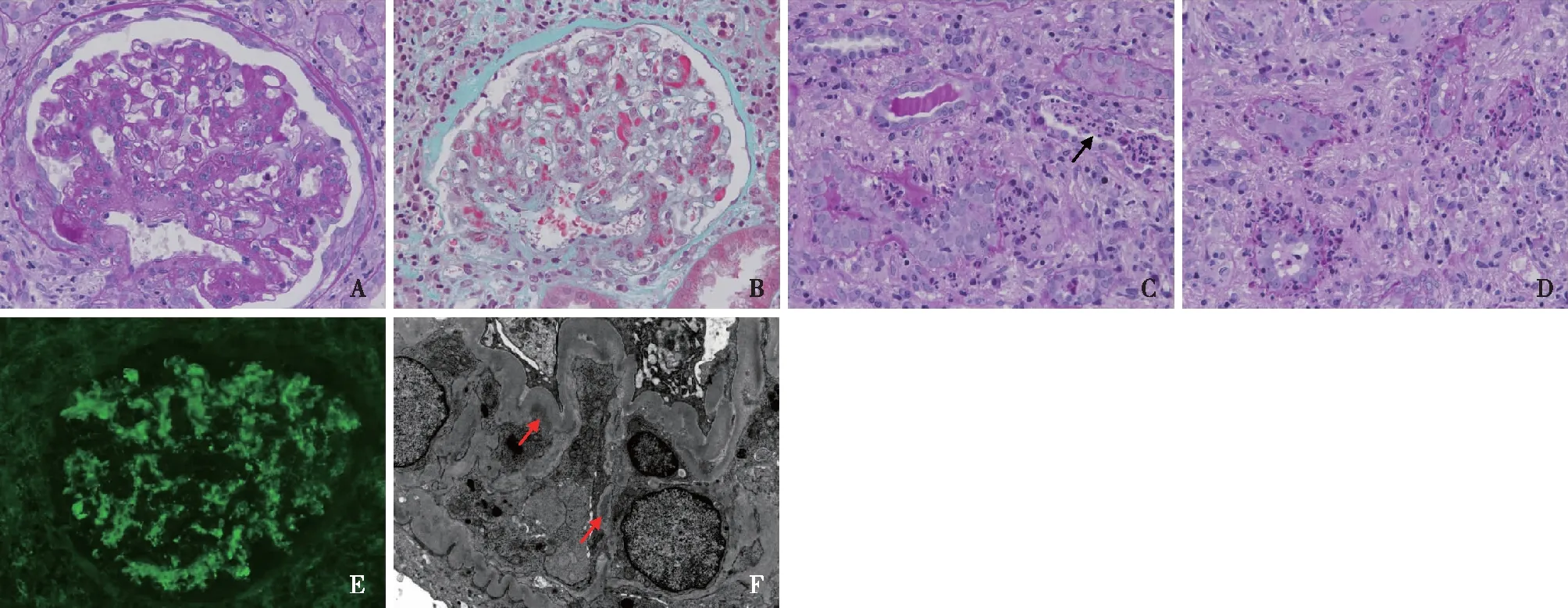
图1 A:肾小球系膜增生性病变,见新月体形成(PAS,×400);B:肾小球系膜区较多嗜复红物沉积(Masson三色染色,×400);C:肾小管内中性粒细胞管型(↑)(PAS,×400);D:见肾小管炎和小管周围中性粒细胞聚集(PAS,×400);E:IgA++,弥漫沉积于肾小球系膜区(IF,×400);F:肾小球系膜区见电子致密物沉积(↑)(EM)
讨 论
临床病理特点本例为中年女性患者,临床表现为寒战、高热、腰痛及膀胱刺激症状,实验室检查发现蛋白尿、血尿、白细胞尿、亚硝酸盐阳性和SCr升高,中段尿培养见大肠杆菌,病程中曾发作尿路感染并予以抗感染治疗,症状缓解后仍存在镜下血尿和大量蛋白尿。肾活检组织学表现为肾小球系膜增生性病变,伴有新月体形成,系膜区见大量嗜复红物沉积。肾小管间质慢性病变合并急性病变,肾小管周围见中性粒细胞聚集分布,间质灶性纤维化伴大量炎细胞浸润。免疫荧光IgA、C3肾小球系膜区沉积。电镜观察肾小球系膜增生性病变伴系膜区电子致密物沉积。
鉴别诊断本例肾小管间质病变,需要考虑继发于肾小球疾病和原发性肾小管间质病变。肾小球疾病如IgA肾病、局灶节段性肾小球硬化、狼疮性肾炎、干燥综合征等,可伴有不同程度的肾小管间质损伤。本例组织学IgA肾病诊断明确,且伴有新月体形成,不能排除肾小管间质损害与IgA肾病有关。需要注意的是本例肾小管间质慢性病变程度与肾小球硬化比例并不一致,肾间质大量中性粒细胞浸润,聚集于肾小管周围,不符合IgA肾病的肾小管间质损伤特点。ANCA相关性肾炎、抗GBM肾炎可伴肾间质大量中性粒细胞浸润,但ANCA抗体谱和抗GBM抗体阴性排除了以上可能。
原发性急性肾小管间质性肾炎中最常见的原因为药物和感染[1]。本例病程中曾多次发作尿路感染,抗生素治疗后症状好转。抗生素是导致肾小管间质性肾炎的常见药物之一,药物导致的肾小管间质性肾炎通常表现为弥漫性病变,间质浸润细胞通常为淋巴细胞和单核巨噬细胞,亦可伴有嗜酸性粒细胞和浆细胞浸润,但中性粒细胞少见,可见肾小管炎[2]。药物相关性肾小管间质性肾炎可伴有全身表现,如发热、皮疹,血嗜酸性粒细胞增高[3]。本例患者发热与尿路刺激症状同时出现,而不是发生在膀胱刺激症状缓解之后,且未见皮疹和血嗜酸性粒细胞增高,间质浸润细胞以中性粒细胞为主,伴有较多浆细胞和单个核细胞,而未见嗜酸性粒细胞,因此药物相关性急性间质性肾炎可能性较小。
急性肾盂肾炎早期表现为肾小管内大量中性粒细胞管型,肾小管上皮细胞坏死和脱落,管周毛细血管内和肾小管周围可见大量中性粒细胞聚集。本例急性肾损伤与尿路感染病程一致,组织学可见白细胞管型、间质大量炎细胞浸润,并且肾小管周围中性粒细胞聚集分布,符合急性肾盂肾炎相关肾小管间质损伤。
尿路感染相关肾损害尿路感染可分为下尿路感染和上尿路感染,前者主要累及膀胱和尿道,后者则累及肾脏和输尿管,因此尿路感染肾损害主要指上尿路感染,即肾盂肾炎导致的肾脏损害。肾盂肾炎可分为急性肾盂肾炎和慢性肾盂肾炎。
急性肾盂肾炎好发于育龄已婚女性,亦见于妊娠、糖尿病、免疫功能抑制、导管置入和肾脏存在功能或解剖学异常的患者,大肠杆菌是最常见的致病菌[4-5]。尿路上行感染是最常见的感染途径,少部分经过血液和淋巴道感染。典型的临床表现包括全身炎症症状(如寒战、发热、头痛、恶心、呕吐)和泌尿系统症状(如尿频、尿急、尿痛,腰痛和肾区叩痛)。严重者可出现肾周脓液、败血症和肾衰竭,也有部分患者临床症状并不典型[6-7]。尿液检查常发现镜下血尿和白细胞尿,而蛋白尿少见,部分患者可出现SCr升高和尿浓缩功能减退。组织学肾小球病变轻,主要累及肾小管和间质,急性期肾小管腔内大量中性粒细胞管型,肾小管可出现坏死、基膜断裂,管周毛细血管和间质亦见大量炎细胞浸润,除中性粒细胞外,亦可见浆细胞、淋巴细胞和巨噬细胞,严重者可出现脓肿[8]。部分患者恢复期可遗留瘢痕组织[9]。需要注意的是,急性间质性肾炎、急性肾小管坏死和管型肾病中会出现类似的临床和组织学改变,需要结合实验室检查特别是中段尿细菌培养予以排除[10-11]。
急性肾盂肾炎反复发作后可出现慢性肾盂肾炎,也有部分慢性肾盂肾炎的患者病程中并没有急性肾盂肾炎的典型症状。慢性肾盂肾炎可分为梗阻性慢性肾盂肾炎和反流性肾病。慢性肾盂肾炎临床症状可不典型,肾脏损害可表现为尿浓缩功能和重吸收功能减退,高血压,肾功能不全等。组织学以肾小管间质慢性病变为主,不规则斑块状肾小管萎缩和间质纤维化,集合管周围出现条纹状的纤维化,灶性甲状腺样蛋白管型,肾小球可出现囊周纤维化、皱缩甚至节段硬化。曾经认为反复细菌感染是慢性肾盂肾炎瘢痕形成的原因,但后来的研究发现当不存在尿路梗阻的情况下,反复细菌尿很少产生慢性肾盂肾炎,而即使没有细菌尿时,仍观察到输尿管反流和慢性肾盂肾炎有关联。针对Tamm-Horsfall蛋白(THP)的免疫反应被认为是慢性肾盂肾炎肾间质纤维化的原因之一[12-14]。少数慢性肾盂肾炎还可以表现为特殊的组织学类型黄色肉芽肿性肾盂肾炎,大体观察肾脏肾盂周围见黄色的炎症组织,组织学表现为肾间质肉芽肿样改变,由中性粒细胞,淋巴细胞,浆细胞,多核巨细胞,胞浆包含PAS阳性颗粒的泡沫细胞组成[15]。
IgA肾病与肾盂肾炎是否存在关系呢?IgA肾病合并尿路感染肾损害的报道罕见,有零星的个案报道特殊的尿路感染合并IgA肾病[16],也有个案报道IgA肾病表现为急性肾盂肾炎的临床症状,但尿白细胞和尿培养细菌培养阴性[17]。多种感染性疾病和肾小球疾病存在一定的关系,如链球菌感染后急性肾小球肾炎、乙型肝炎和丙型肝炎病毒相关肾损害、感染性心内膜炎相关肾损害,而IgA肾病和上呼吸道和肠道炎症性疾病黏膜免疫的激活有关,尿路感染存在尿路黏膜对病原体的免疫应答,在尿路感染的患者和动物模型中检测出分泌性IgA,急性肾盂肾炎患者血中也检测到针对THP的抗体[18],但是尿道感染的黏膜免疫是否和IgA肾病有关,尚不明确。部分原因在于尿路感染特别是急性肾盂肾炎是肾活检的禁忌症,大部分尿路感染患者并不会行肾活检检查,尿路感染合并肾小球疾病有可能被低估。
急性肾盂肾炎时通常不建议行肾活检,但是当伴有急性肾功能不全,特别是移植肾需要鉴别肾盂肾炎和急性排斥反应时,需要考虑行肾活检明确和鉴别诊断[19-23]。本例急性肾盂肾炎患者经抗感染治疗感染好转的情况下,仍然存在镜下血尿和大量蛋白尿,经肾活检证实合并IgA肾病和肾小球增殖性病变,后续酌情给予泼尼松等药物治疗。
小结:本文报道一例表现为急性肾盂肾炎患者,同时伴有尿检异常和肾功能不全,经肾活检证实IgA肾病,伴有肾盂肾炎相关肾损害。提示在尿路感染患者,在尿路感染控制后如存在持续不缓解的镜下血尿和蛋白尿,需要考虑行肾活检,明确是否存在合并肾小球疾病的可能。

