伴蛋白结合毒素升高尿毒症模型的建立
张 冬 任宏伟 李 川 孔 凌 龚德华
血液透析(HD)是终末期肾病(ESRD)患者肾脏替代治疗的主要方式之一,其发展离不开对尿毒症毒素的不断认识和新型膜材料、吸附材料的推陈出新。近年来蛋白结合毒素(PBUTs),尤其是硫酸吲哚酚(IS)和硫酸对甲酚(PCS),对慢性肾脏病(CKD)患者心血管并发症的影响备受关注[1-3],其可能作用途径为介导氧化应激[4-7],促进炎症激活[7-9],诱导细胞凋亡[10]等对肾脏和心血管系统产生严重损害。由于其蛋白结合率高(>90%)[11],难以被常规的HD包括弥散和对流方式清除,而吸附被认为是可能的唯一有效清除手段。从小分子毒素到中分子毒素,对应着低通量透析与高通量透析及血液透析滤过技术的发展,而PBUTs则需应用吸附技术。新的HD材料及模式,在用于人体治疗之前,都必须经过体外实验及动物实验来验证其效果及安全性,尿毒症动物模型建立是动物实验的前提。现有文献报道尿毒症模型如缺血再灌注模型[12],5/6肾切除模型[13],腺嘌呤肾衰竭模型[14]等都是基于小动物模型,不适合HD治疗,而大动物尿毒症模型的缺乏,使得目前对新型HD材料的验证,一般采用血制品进行体外循环实验,极少数基于微型血液净化平台进行在体小动物模型HD实验。建立能满足HD治疗的大动物尿毒症模型很有必要。本研究通过关木通提取物造成猪尿毒症状态,并予吲哚酚和对甲酚灌胃,建立了伴PBUTs升高的大动物尿毒症模型;观察3个月内肾功能指标、PBUTs、β2微球蛋白、钙磷代谢等相关参数的动态变化及组织形态学改变。
材料与方法
关木通提取物制备称取关木通切片200g,加入95%乙醇溶液2 000 ml,浸泡1h,加热至微沸,回流提取2h,过滤;滤渣中再加入95%乙醇溶液1 600 ml回流提取2h,过滤。合并两次提取物,减压浓缩至浸膏状,4℃保存。采用高效液相色谱法测定关木通浸膏中马兜铃酸A含量为1.02%(10.2 mg/g)。
动物模型制备取9头体重30~40 kg家猪(雌雄不限,由东部战区总医院比较医学科提供),于实验第1天、第3天给予关木通浸膏1.5 g/kg·d(相当于15.3 mg/kg·d马兜铃酸A)灌胃;实验第4d、8d、10d、12d,给予吲哚酚50 mg/kg(sigma,美国)+对甲酚100 mg/kg (sigma,美国)+20 ml 75%酒精灌胃。给药期间,家猪自由饮食。另取2头家猪处死以留取肾脏组织作正常肾脏病理。
观察项目灌胃给药期间(第1天~第13天),每日从猪前腔静脉采血,留取血液标本;实验第1天、第4天、第11天在超声引导下进行膀胱穿刺留取尿液;实验第15天、第20天、第25天、第30天、第45天、第60天、第75天、第90天留取血液标本。实验结束前(第90天),存活猪在全麻状态下,经腹正中切口取出一侧肾脏,留取部分组织作形态学观察,并注射过量丙泊酚处死。
血液标本中生化项目及血液常规项目由东部战区总医院检验科检测,β2微球蛋白按ELISA试剂盒(Elabscience,中国)说明书进行检测。送检蛋白结合毒素IS、PCS的血液标本经离心后取上层血清-80℃冰箱冻存,集中采用质谱-高效液相色谱法检测(济南英盛生物公司),尿检标本由国家肾脏疾病临床医学研究中心检测。肾脏组织由10%福尔马林固定,经脱水、透明、石蜡包埋、切片后行HE及Masson染色。
统计分析采用《SPSS 21.0》软件进行数据分析,符合正态分布的计量资料用平均数±标准差表示,两两比较采用配对样本t检验。不符合非正态分布的计量资料采用中位数(四分位数间距)表示,两两比较采用Wilcoxon符号秩检验。P<0.05为差异有统计学意义。
结 果
经2次关木通提取物灌胃后,所有猪均出现不同程度活动减少、食欲降低及胃肠道反应,1周内体重下降达4~11 kg。在9头实验猪中,3头(2、7、9号)出现少尿,水肿,嗜睡,均在3周内死亡;其余6头表现为尿量增多,除4号猪因手术台上呕出大量胃内容物误吸死于第5周外,其余5头均在1个月左右食欲、精神好转,并存活至3个月后实验结束。
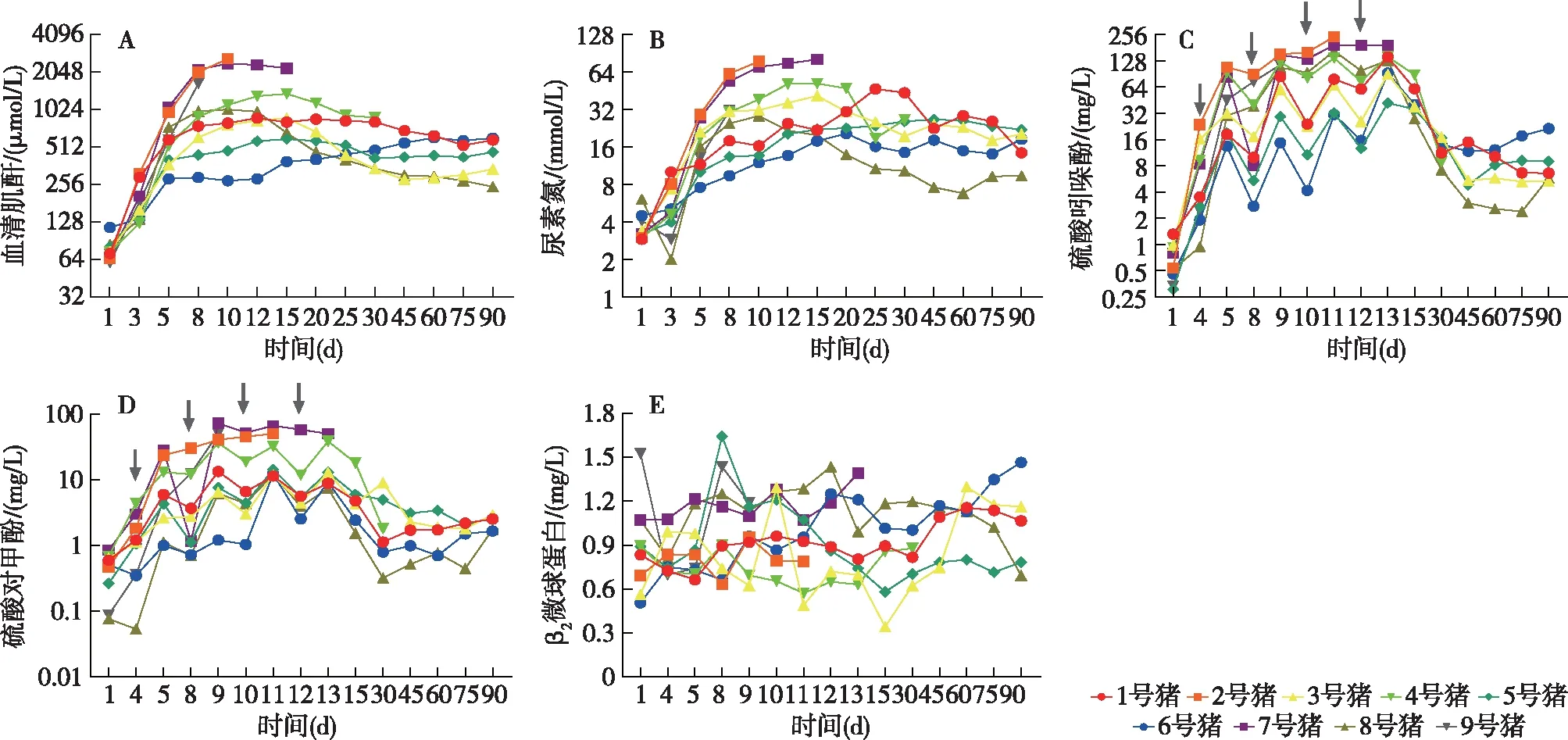
图2 尿毒症模型前后猪血清主症毒素水平
尿液指标实验第4天,所有猪的尿蛋白和尿红细胞计数均出现阳性,以轻~中度为主,同时伴不同程度的尿葡萄糖和N-乙酰-β-D-氨基葡萄糖苷酶(NAG)升高;第11天大部分猪尿检转为阴性,尿葡萄糖和尿NAG仍保持轻~中度升高水平(图1)。
血清主要尿毒症毒素关木通提取物灌胃后,SCr和BUN进行性升高,在第8d~15d达高峰,实验第15d,两者分别达基础水平的12.9倍(P<0.01)和9.9倍(P=0.011);第20d后,血清肌酐(SCr)和血清肌酐(BUN)逐步下降;第45d后,SCr和BUN分别稳定在基础水平的6.2倍和5.1倍左右(P均<0.05),直至实验结束(图2A、B)。

图1 猪尿毒症模型前后尿检变化
IS和PCS在关木通提取物灌胃后明显升高,实验第4天,IS和PCS升至基础水平6.5倍和2.2倍(P均<0.05); 经4次对甲酚和吲哚灌胃后,实验第15d,IS和PCS升至基础水平的73.3倍 和8.9倍(P均<0.05);吲哚酚和对甲酚停止给药后,IS和PCS水平逐渐下降;第45天后,IS和PCS分别稳定在基础水平的12.5倍和3.8倍左右(P均<0.05)直至实验结束(图2C、D)。血清β2微球蛋白在实验期间无明显变化(图2E)。
其他指标血钙仅在实验第90天较基础水平轻度升高(P<0.05);血磷在实验期间未见明显变化(P均>0.05)(图3A、B)。同型半胱氨酸在实验第15天升高不显著(P>0.05),第90天较基础水平显著升高(P<0.05)(图3C)。血红蛋白在实验第15天较基础水平显著下降(P<0.05),实验第90天仍低于基础水平,但差异不显著(P>0.05)(图3D)。

图3 尿毒症模型前后其他指标的变化
组织形态学改变2、7、9号猪因夜间死亡未及时留取肾脏组织,死于实验第31d的4号猪留取了肾脏组织,余5头猪存活至3月时处死留取肾脏组织。HE染色: 实验1个月广泛可见大量肾小管扩张,伴有间质淋巴细胞浸润(4号猪);3个月可见肾小球数量减少,球囊腔扩大,残余肾小管高度扩张(1号猪)。Masson染色:1个月间质中可见较多的胶原纤维增生(4号猪);3个月可见大量胶原纤维增生(6号猪)(图4)。

图4 猪尿毒症模型后肾脏组织病理变化
讨 论
本文报道了通过关木通提取物灌胃建立的可长期存活的猪尿毒症模型,其特点如下:早期(第1天~第20天)主要表现为肾功能的快速下降及SCr和BUN的急剧上升,一过性的血尿、蛋白尿和持续的肾小管损伤表现(如尿NAG和尿糖升高),IS和PCS明显升高,吲哚酚和对甲酚灌胃加速两者累积;中期(第20天~第45天)主要表现为肾功能的部分恢复,SCr、BUN、IS和PCS水平达峰后下降;晚期(第45天~第90天)表现为相对稳定肾衰竭期。本模型在大动物上再现了临床马兜铃酸肾病及既往小动物马兜铃酸肾病模型的特点[15],即急性期的肾小管损伤及远期的慢性化病变即尿毒症状态。建立本模型的主要目的是为今后尿毒症毒素清除的血液净化大型动物实验打下基础。
我们选择马兜铃酸作为肾损伤药物主要基于其直接损伤肾小管上皮细胞,使之变性、坏死或凋亡[16],临床则表现为肾小管重吸收障碍及非少尿性肾功能衰竭。造模动物长期存活的关键是保证水负荷调节能力存在,即尿量正常,而本实验中3头早期死亡的猪正是因为少尿、水肿所致。此外,这种肾小管功能损伤模型也有利于PBUTs的蓄积。既往研究证实,大剂量的马兜铃酸损伤近端肾小管上皮细胞,而PBUTs的排泄则依赖于基底膜侧阴离子转运蛋白的分泌作用[17]。因此,本实验早期即出现IS和PCS的显著升高。为进一步升高两者血清水平,我们还采用了吲哚酚和对甲酚灌胃的方法,而体内IS和PCS的生成也主要源于肠道菌群分解食物蛋白产生吲哚酚和对甲酚,并经门脉系统入肝后再经硫酸化形成IS和PCS[18]。在预实验阶段(结果未展示),我们以吲哚酚和对甲酚在大鼠中的LD50为依据,在安全范围内对吲哚酚和对甲酚剂量进行多次调整,最终将两者的灌胃剂量确定为50 mg/(kg·d)和100 mg/(kg·d),经实验证实,经4次灌胃后,IS和PCS血清水平可达到甚至超出HD人群的平均水平。这种伴高水平PBUTs的大动物尿毒症模型可为新型吸附材料的研发提供极大便利。既往新型吸附材料在研发阶段主要通过体外动、静态吸附的方式评估PBUTs的清除效果[19-22]。近年来,随着电脑技术的发展,可模拟患者体内蛋白、游离毒素及PBUTs三者动态平衡的动力学模型也可用于PBUTs的清除效果评估[23-24]。然而,在模拟人体血流动力学、毒素分布容积以及评估生物相容性等方面,体外实验和数学模型均不及体内实验。截至目前,PBUTs在动物模型中的研究仅局限于部分小鼠或大鼠的肾衰竭模型。尽管研究显示,缺血再灌注损伤[12]和5/6肾切除的小鼠肾衰竭模型中[10,13]可伴PBUTs明显升高,但大型动物手术操作难度远比小动物复杂,且术后护理困难。而部分肾毒性药物,如顺铂[25],腺嘌呤[14],虽可引起PBUTs升高,但价格昂贵,同样不适用于大动物肾衰竭模型的建立。本研究报告的伴PBUTs升高的猪尿毒症模型,不仅具有造模时间短,尿毒症毒素水平高,存活时间长等优点,而且操作简单,成本低廉,可用于今后血液净化域对PBUTs清除方面的研究。
需要注意的是,尽管本实验马兜铃酸剂量参照小动物模型而来[14],但大动物对马兜铃酸反应的个体差异更为明显。虽然本实验中大部分猪存活3个月以上并稳定表现为尿毒症,但也有1/3猪肾损伤严重,表现为少尿型急性肾损伤,毒素升高速度及程度远高于非少尿型,导致其生存时间短于3周,且尿检与临床所见与马兜铃酸所致少尿型急性肾损伤相似。因此,为提高动物模型存活率,今后研究可尝试适当降低关木通提取物灌胃剂量。此外,本模型并未发现尿毒症患者常见的血磷升高,可能与肾小管吸收障碍后磷丢失增加有关,这也与临床肾小管损伤患者常表现低磷血症相一致。是否可在此模型基础上通过高磷饮食喂饲的方式制造出尿毒症高磷血症模型还需今后进一步研究。同样,本模型也未观察到β2微球蛋白水平的升高,而小分子蛋白毒素清除也是血液净化材料研发重点,因此今后还需进一步研究伴β2微球蛋白水平升高的大动物尿毒症模型。
小结:通过关木通提取物灌胃方式可建立长期存活的猪尿毒症模型,在此基础上进行吲哚酚和对甲酚灌胃,可显著升高PBUTs水平。这种简便的大动物尿毒症模型,可为今后血液净化动物实验提供最为接近人体治疗的途径,特别是针对PBUTs的清除研究。但此模型并未能表现出高磷血症及高β2微球蛋白水平,提示仍需进一步研究建立具有此类特征的大动物尿毒症模型的方法。
——凹脉马兜铃

