微泡性多囊肝影像学检查表现比较*
王秀清,马燕君,詹晋莉
多囊肝(polycystic liver disease,PLD)是一种基因异常导致的疾病,临床比较罕见。它是常染色体显性多囊肝(autosomal dominant polycystic liver disease,ADPLD),也可以伴有常染色体显性多囊肾(autosomal dominant polycystic kidney disease,ADPKD)或者常染色体隐性遗传性多囊肾(autosomal recessive polycystic kidney disease,ARPKD)[1,2]。现代医学研究证明PLD的发生与人体第19号染色体有着直接的关系[3]。PLD起源于胆管上皮细胞,因基因突变所致的。它的主要表现是肝囊肿。这类囊肿会随着时间的推移而不断增大或不断增多,肝脏的体积也会不断增大,每年增加约0.9% ~1.6%,最终肝脏体积增加到10升以上。在囊肿较小时,PLD患者通常无明显的临床症状,在囊肿增多增大时,则会出现腹胀、腹痛、胃食管反流等,严重者会伴有营养不良和呼吸困难。如果不予以及时的治疗,会导致肝脏功能受损,引发各种并发症,甚至危及生命[4]。由于PLD多发囊性病变的特性,临床需要与胆管错构瘤(biliary hamartoma,BH)和先天性肝内胆管扩张(Caroli病)鉴别[5-7]。目前,主要采用TACE治疗PLD患者,以精准栓塞供血血管,效果非常明显[8-11]。随着医学影像学技术的不断发展,超声成为目前肝脏疾病最常用的诊断方法。超声造影(contrast-enhanced ultrasonography,CEUS)技术在不断进步,对于各种疾病的诊断准确性很高。CEUS可以直观地显示病变的微循环。二维超声造影(twodimensional contrast-enhanced ultrasound,2D-CEUS)提高了PLD的诊断和鉴别诊断水平。三维超声造影(three-dimensional contrast-enhanced ultrasound,3D-CEUS)不受层面的限制,可以全面地展示器官的立体构造。本研究比较了微泡性PLD的CT、MRI和超声检查表现特征。
1 资料与方法
1.1 临床资料 2016年2月~2018年12月我院肝胆外科收治的PLD患者60例,男36例,女24例;平均年龄为(45.7±5.8)岁。其中22例为体检发现,25例因其他疾病而接受超声检查检出,3例在外院诊断为肝硬化、3例为原发性肝癌、7例为慢性乙型肝炎。排除标准:存在其他认知障碍等疾病、已经进行过肝脏病变手术、患有其他恶性肿瘤患者。本研究经我院医学伦理委员会审批同意,患者及其家属签署知情同意书。
1.2 超声检查 使用Simens S2000彩色多普勒超声诊断仪,线阵探头频率为6~12 MHz。患者空腹,采取平卧位或侧卧位,平静呼吸,充分暴露腹部,观察肝脏病变的大小、形态、内部结构、后方回声、边界、包膜情况。使用彩色多普勒超声检查并观察病变内部及周边的血流信号分布以及变化。然后,换用高频探头,观察肝脏边缘和肝脏内部细微结构。最后,扫查肾脏。
1.3 CT检查 行上腹部CT平扫和增强扫描,使用德国西门子sensation 64CT(Siemens SOMATOM Sensation,Germany)扫描仪,扫描范围为膈顶至肝脏下缘。探测器准直组合(64×0.6)mm,矩阵(512×512),120 kVp,160 mA,层厚和层间距均为1 mm。行常规CT平扫。经肘静脉高压团注碘海醇 (300 mg I/ml)100 ml,注射速度为3.0 ml/s。在注射对比剂后30 s、50~60 s和180 s时分别行动脉期、门脉期和延迟期扫描。
1.4 MR检查使用美国GE Singa CV/I 1.5T超导MR扫描仪行上腹部MR平扫和增强扫描。先行肝脏常规 T2WI、T1WI、DWI和增强扫描,轴位 T1WI采取 TR 120-250 ms,TE 4.2 ms,翻转角 80 ~90°,层厚 5 ~6 mm,层间距2 mm,矩阵256×160;轴位T2WI脂肪抑制序列采取TR 6000~8000 ms,TE 50 ms,层厚5~6 mm,层间距2 mm,矩阵288×224;DWI序列采取TR 6000 ms,TE 50 ms,层厚5~6 mm,层间距2 mm,矩阵128×128,b值选择600、800 s/mm2。增强扫描选择TR 3.7 ms,TE 1.6 ms,翻转角12°,层厚5~6 mm,层间距0,矩阵256×160。使用对比剂钆喷酸葡胺(Gd-DTPA,德国拜耳医药公司)0.1 mmol·kg-1,经肘静脉高压注射,注射速度为1.5~2 ml/s,注射后20~40 s、50~60 s、180 ~240 s分别进行屏气扫描以获取动脉期、门脉期和延迟期图像。将数据传输至PACS工作站(Carestream Health,version 11.0)上,由2名医师对CT和MRI图像互盲评价。基本征象主要包括直径(mm)、密度、病变内有无分隔、各个期相强化特点、包膜情况、扩散受限以及门静脉和胆管显像情况。
2 结果
2.1 入选患者临床资料 在60例入选患者中,19例表现为肝脏肿大,25例有明显的腹部不适症状,6例表现为腹部肿块。
2.2 CT和MRI检查特点 CT检查表现主要为肝实质内散在分布的类圆形低密度影,大小不一,最大者直径约10 cm,数目较多。增强扫描无强化,伴有或不伴有肝脏肿大。MRI表现为肝实质内散在分布的类圆形长T1长T2信号,大小不一,数目不等。增强扫描无强化,部分患者合并肝脏肿大。36例患者肾脏也有同样表现的病变(图1~3)。
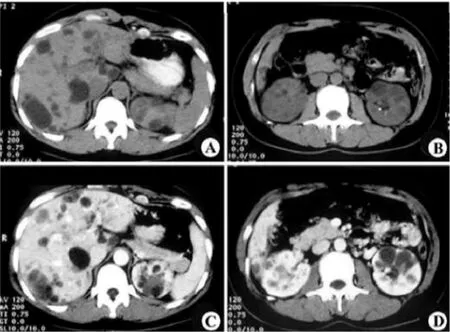
图1 PLD患者CT表现 42岁男性微泡性多囊肝,肝实质内弥漫分布大小不一的类圆形低密度影,无强化,伴有肾脏病变(A~D)
2.3 超声检查特点 肝脏形态饱满、体积增大,肝实质呈不均匀回声增强,为斑片状或条状分布,肝实质内多发大小不一的低回声区,部分直径小;肝脏外缘凸凹不平,血管走行紊乱。应用高频探头检查可见弥漫分布的管状无回声区,部分侧壁显示不清,后方可见蝌蚪状回声增强。门静脉主干、左右支、肝左中右静脉和胆管走行正常(图4~7)。
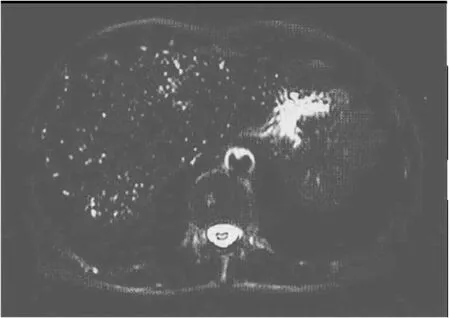
图2 I型微泡型PLD患者MRI表现 49岁女性,T2WI STIR序列
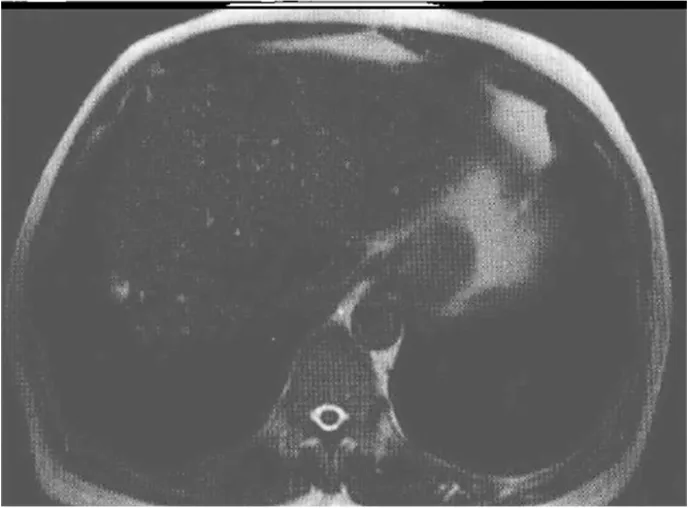
图3 II型微泡型PLD患者MRI表现 52岁女性,T2WI序列
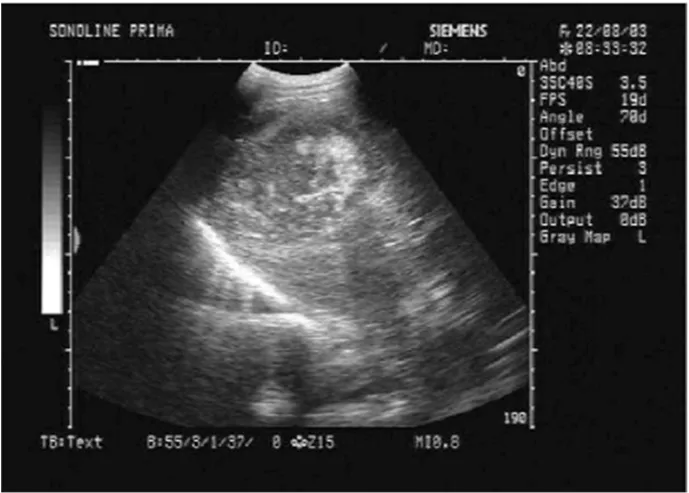
图4 PLD患者超声表现 42岁男性,微泡性多囊肝,肝实质回声增粗,血管走行紊乱
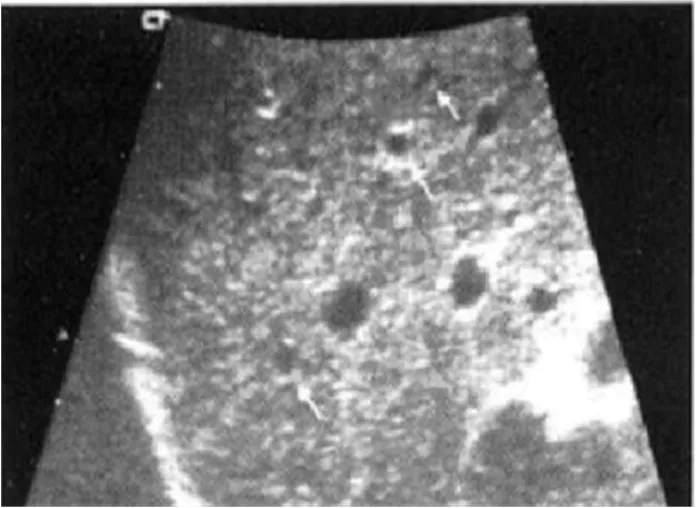
图5 PLD患者超声表现 52岁女性,微泡性多囊肝,肝实质内多发蝌蚪状高回声,侧壁显示不清
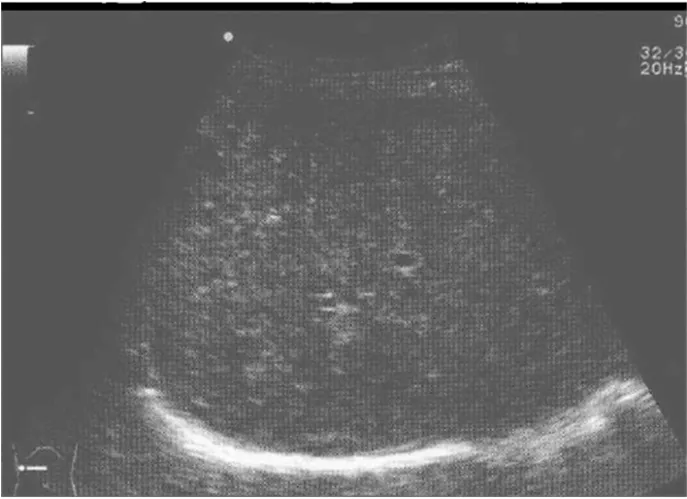
图6 PLD患者超声表现49岁女性,I型微泡型PLD表现
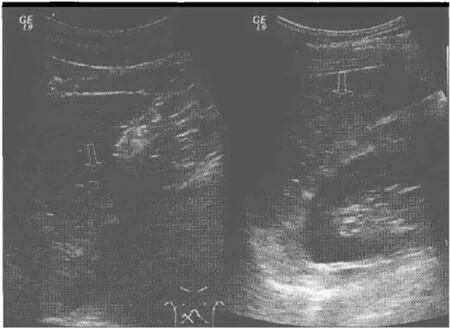
图7 PLD患者超声表现 52岁女性,II型微泡型PLD超声表现
3 讨论
目前研究发现,PLD主要是与PRKCSH、SEC63、PKD1、PKD2 4个基因突变有关[12]。一般将微泡性PLD直径在1~2 mm之间,称为I型微泡性PLD;而当异常回声肝实质内可见个别3 mm以上典型囊肿者,则称为II型微泡性PLD。
医学影像学技术如CT和MRI检查是临床应用价值较高的诊断技术,也是微泡性PLD的可靠检查方法,可以全面清晰地显示多囊的特点。双输入双室Exchange模型可以全面判断肝脏病理生理以及血流微循环状态[13]。CT和MRI造影的应用可以动态地观察肝脏强化的过程,而后重建处理还可以获得肝脏血流灌注图像等[14]。超声医学的发展也在不断完善和扩大诊断范围,在实质脏器病变的筛查、结石、肿瘤等方面的应用较为理想。同时有50%以上的PLD会合并PKD、多囊脾、多囊胰等,检查时需要全面和仔细。PLD患者一般不需要治疗,但是需要定期随访。微泡性PLD在超声声像图上有着特殊的征象。PLD患者肝脏外缘多呈现为结节状,肝实质内囊肿数目数不清,大多部分累及整个肝脏,个别患者囊肿局限于某个肝叶。肝脏体积增大,肝切面的正常肝叶较少。微泡性PLD临床较为少见,常常容易被漏诊。如果使用高频探头使局部放大,可以准确地判断病变。在放大后,可见看到直径约5 mm的囊肿,囊肿后方回声增强。微泡性PLD囊肿直径约在1~2 mm之间,由于多重反射,可以看到散乱粗大的回声区,呈短棒状,两端无回声,呈蝌蚪状。这些特点在本研究中也得到了证实,属于I型微泡性PLD。除以上特点外,同时可见单个或者几个毫米大小的囊肿,即为II型微泡性PLD。本研究中实际上存在I型和II型病例。微泡性PLD患者肝实质内看不到典型的囊性病变,主要是由于肝脏本身是多血管供血,具有交错复杂的大静脉,微小囊肿会被误以为是血管交叉点。CT和MRI仍是微泡性PLD可靠的诊断方法。值得注意的是,微泡性PLD与胆管错构瘤在影像学特点方面相近[15],后者胆管结构走行紊乱。依据影像学表现便可区分它们,而不需要穿刺活检。同时需要明确肝内胆管结石、肝硬化以及胆管先天性异常是其危险因素[16]。
PLD的治疗目的是缓解症状、缩小肝脏体积。除了外科治疗外,有研究表明应用生长抑素类似物可见明显缩小肝脏体积,减轻患者症状[17]。熊去氧胆酸(UDCA)可以抑制PCK小鼠肝囊肿的生成以及肝纤维化,小鼠运动活力得到了提高[18]。对于晚期PLD患者,UDCA治疗对于肝脏体积影响不大,但是可以缩小囊肿体积[19]。针对PKD,可以采用腹膜透析(PD)进行肾脏替代治疗[20]。
尽管本研究经过严格的试验设计,但是纳入的样本量仍较少,尤其是微泡性PLD患者。另外,针对各亚型微泡性PLD的研究尚不够详细,有待于未来更大样本、更细致的进一步研究。综上所述,虽然在PLD诊断方面,CT和MRI检查有着明显的优势,然而超声检查对于微泡性PLD患者也具有明显的特征性。超声检查在微泡性PLD患者诊断和分型方面具有一定的临床价值,因为其方便、可重复和患者依从性高。

