探讨HE4、CEA、ProGRP、CYFRA21-1以及NSE联合检测在肺癌诊断中的应用
周小斌,王 艳
(1.泰州市人民医院 检验科;2.泰州职业技术学院,江苏 泰州 225300)
肺癌(lung cancer,LC)是全球癌症及与癌症相关死亡的主要原因。非小细胞肺癌(Nonsmall cell lung cancer,NSCLC)占多数,为85%,其余主要为小细胞肺癌(small cell lung cancer,SCLC)[1]。尽管目前肺癌相关诊疗技术在不断发展,但患者五年生存率总体约为18%,其主要取决于肺癌诊疗时间点,早期干预治疗生存率可达55%,而晚期则只有4%[2]。因此,肺癌的早期诊断及适当治疗对于改善预后至关重要。肺癌诊疗的前提在于病理学诊断与分期,由于目前主要通过病理活检或者脱落细胞检测对肺癌进行诊断,往往患者确诊时已处于疾病晚期[3]。此外,当活检样本不足或制片质量不高时,则可影响诊断和组织学分型。对于部分身体状态较差的患者,有时甚至无法进行活检,由此可见急需一种非侵入性的诊断方法。目前尚无比较理想的可用于肺癌诊断的单个血清肿瘤标志物,但是组合检测可能有助于提高肺癌诊断的敏感性和特异性。在本次研究中,我们分析了五种肿瘤标志物的血清水平(HE4、CEA、ProGRP、CYFRA21-1以及NSE),用以评估联合检测对肺癌诊断的应用价值。
1 材料和方法
1.1 材料
1.1.1 研究对象 肺癌患者104例,其中男性68例,女性36例,年龄37~72岁,平均年龄48岁,为2019年1月至2019年12月期间泰州市人民医院肿瘤科门诊及住院患者,其中小细胞肺癌21例,非小细胞癌83例;肺炎患者62例;健康体检者75例。三组研究对象性别与年龄均匹配。
1.1.2 试剂和仪器 ProGRP检测试剂盒,HE4检测试剂盒,CEA检测试剂盒,CYFRA21-1检测试剂盒,雅培ARCHITECTi2000SR全自动免疫分析仪(美国雅培公司);NSE检测试剂盒,新产业MAGLUMI 4000 Plus全自动化学发光免疫分析仪(深圳新产业生物医学工程有限公司)。
1.2 方法
1.2.1 标本采集 使用含分离胶的真空负压管无菌采集各组研究对象静脉血并及时离心以分离出血清。
1.2.2 结果检测 采用化学发光法检测三组研究对象血清中NSE、ProGRP、HE4、CEA、CYFRA21-1水平。五种肿瘤标记物生物参考区间分别为:NSE<6ng/mL;ProGRP<63pg/mL;HE4<70pmol/L;CEA<5ng/mL;CYFRA21-1<3.07ng/mL。
1.3 统计学处理 采用SPSS18.0软件对三组研究对象检测数据进行统计学分析,数值变量以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用q检验,P≤0.05为差异有统计学意义。
2 结果
2.1 通过分析三组实验对象血清中NSE、ProGRP、HE4、CEA、CYFRA21-1水平显示,肺癌组中五种肿瘤标志物表达水平均高于肺炎组和健康对照组,差异有统计学意义(P<0.05)。肺炎组NSE水平略高于健康对照组(P<0.05),差异有统计学意义,其它四种肿瘤标志物血清水平与健康对照组无统计学差异(P>0.05)(见表1)。
2.2 进一步对两种肺癌病理分型中五种肿瘤标志物血清水平进行分析发现,SCLC组ProGRP、NSE血清水平高于NSCLC组,差异有统计学意义(P<0.05)。相比于SCLC,CYFRA 21-1、HE4、CEA血清水平在NSCLC组较高,差异有统计学意义(P<0.05)(见表2)。
2.3 通过分析发现,单个血清肿瘤标志物对于肺癌诊断的敏感性和特异性分别为:NSE为50%和68%;ProGRP为20%和91%;HE4为68%和61%;CEA为73%和39%;CYFRA21-1为75%和80%。联合检测五种肿瘤标志物敏感性和特异性为82%和74%。
3 讨论
NSE是一种糖酵解酶,在各类神经内分泌肿瘤,尤其是SCLC中表达增高。目前NSE已作为SCLC诊断、治疗、监测和判断预后的首选肿瘤标志物[4]。然而,NSE的敏感性相对较低[5]。有研究显示,CYFRA 21-1是区分肺部良性病变以及NSCLC分型的最敏感指标[6]。CEA是一种复杂的可溶性糖蛋白,其不仅在胚胎性肿瘤组织中表达,在人的胃肠、肺等也有表达。血清CEA水平对肺癌尤其是肺腺癌具有重要的诊断价值[7]。人附睾蛋白4(HE4)是一种新型肿瘤标志物,在卵巢癌组织中高表达,而在正常组织中表达极低,因此在临床上主要用于卵巢癌的早期诊断以及监测卵巢肿瘤的治疗效果和预后。近年来,有文献报道HE4也可用于肺癌的早期诊断[8]。除恶性肿瘤外,血清HE4水平还受多种因素影响,如女性绝经前参考区间为<70pmol/L,绝经后为<140pmol/L。ProGRP是一种新型肿瘤标志物,主要存在于成人胃肠道和呼吸道中;GRP为神经肽激素,最初从猪胃组织中分离出来;ProGRP是GRP的血清前体肽,在血清中稳定,可以用作SCLC的诊断[9]。
表1 三组实验对象NSE、ProGRP、HE4、CEA、CYFRA21-1血清水平比较(±s)
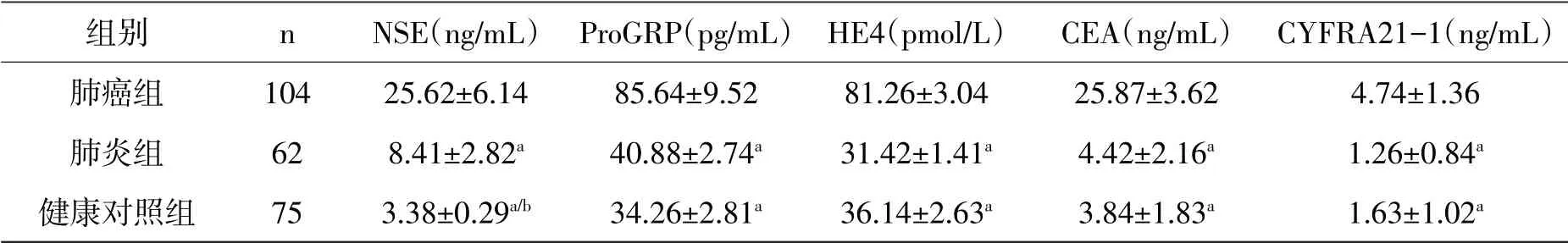
表1 三组实验对象NSE、ProGRP、HE4、CEA、CYFRA21-1血清水平比较(±s)
注:与肺癌组比较,a P<0.05;与肺炎组比较b P<0.05
组别肺癌组肺炎组健康对照组n 104 62 75 NSE(ng/mL)25.62±6.14 8.41±2.82a 3.38±0.29a/b ProGRP(pg/mL)85.64±9.52 40.88±2.74a 34.26±2.81a HE4(pmol/L)81.26±3.04 31.42±1.41a 36.14±2.63a CEA(ng/mL)25.87±3.62 4.42±2.16a 3.84±1.83a CYFRA21-1(ng/mL)4.74±1.36 1.26±0.84a 1.63±1.02a
表2 两种肺癌病理分型中NSE、ProGRP、HE4、CEA、CYFRA21-1血清水平比较(±s)

表2 两种肺癌病理分型中NSE、ProGRP、HE4、CEA、CYFRA21-1血清水平比较(±s)
注:与SCLC组比较,a P<0.05;与NSCLC组比较,b P<0.05
组别SCLC组NSCLC组n 21 83 NSE(ng/mL)32.21±6.76 15.87±3.12a ProGRP(pg/mL)96.35±7.85 73.42±3.63a HE4(pmol/L)73.17±8.44b 86.73±5.14 CEA(ng/mL)21.26±3.89b 33.75±4.15 CYFRA21-1(ng/mL)3.73±1.28b 6.12±2.56
根据组织学分型可将肺癌分为两类:小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),两者治疗方法和预后均不相同。相比于后者,SCLC对化学疗法和放射疗法高度敏感,但SCLC通常于患者晚期才发现,在诊断时已发生区域淋巴结或器官转移[10]。血清肿瘤标志物已在肺癌的诊断、治疗和预后监测中得到广泛应用。然而,由于它们的敏感性较低或组织学分型特异性不高,导致临床应用价值仍存在争议。本研究中,相比于健康对照组和肺炎组,肺癌组血清HE4、CEA、ProGRP、NSE和CY⁃FRA21-1五种血清标志物血清水平均显著增高,差异有统计学意义。此外,肺炎组NSE水平略高于健康对照组,提示肺部炎性病变可能会增加NSE血清水平。通过进一步分析发现,SCLC组NSE和ProGRP血清水平较高;而CYFRA 21-1、CEA、HE4血清水平在NSCLC组中较高,差异有统计学意义。由此可见,HE4作为一种新型肿瘤标志物,不但在卵巢癌患者血清中表达升高,而且在肺癌患者血清中也有高表达。提示HE4可能是肺癌诊断和预后的潜在标志物,具有重要的临床应用价值。此外,NSE检测结果易受标本质量影响,标本溶血或放置时间过久可导致结果异常,因此ProGRP在SCLC诊断中的应用价值优于NSE。
本研究中,单项肿瘤标志物肺癌诊断敏感性和特异性分别是:CYFRA21-1为75%和80%;HE4为68%和61%;ProGRP为20%和91%;NSE为50%和68%;CEA为73%和39%;联合检测敏感性为82%。因此组合检测可以提高肺癌临床诊断效能,有利于肺癌患者的治疗和预后。

