三七总皂苷诱导下的肝癌细胞Hep G2细胞转录组测序分析
申文豪,杨 颂,姜 敏,张 玮
(泰州市人民医院,江苏 泰州 225300)
虽然肝癌的新增发病率逐年下降,2019年全世界新增肿瘤发病率排名中已跌出前十,但其肿瘤死亡病例的占比仍高居第5位[1]。由于地域性经济的差距,导致各地医疗水平和人们重视程度不同,很多人在确诊时就已处于肿瘤晚期。进行肝癌治疗时,患者多采用综合治疗原则,早期应用手术或者肝移植,中晚期应用动脉栓塞、局部消融、放疗、化疗及生物分子靶向治疗等措施。中药三七提取物三七总皂苷具有抑制肿瘤细胞增殖和诱导凋亡等作用,我们的前期研究也发现其具有化疗增敏和放疗增敏的作用,但其作用机制尚不明确[2,3]。本研究以肝癌细胞株HepG2为研究对象,采用基因芯片检测技术,探讨三七总皂苷诱导肝癌细胞HepG2的基因表达谱的变化,筛选差异表达的基因,并进行差异表达基因功能分析,以期为研究三七总皂苷的抗肿瘤机制奠定基础。
1 材料与方法
1.1 药物和试剂三七总皂苷(成都贝斯特试剂有限公司);二甲基亚砜(DMSO,Sigma公司);胎牛血清、高糖培养基(HyClone公司);Trizol试剂(Invitrogen公司)。
1.2 细胞培养肝癌HepG2细胞(中国科学院上海细胞库),培养于37℃、5%CO2细胞培养箱中。含10%胎牛血清的高糖培养基培养,每3d~4d传代一次。取对数增殖期细胞进行实验,传代次数<20次。
1.3 基因芯片200微摩尔/升三七总皂苷处理HepG2细胞,同样体积的DMSO处理同时细胞作为对照组,48小时后,采用Trizol试剂提取总RNA。由基尔顿生物科技(上海)有限公司采用Illumina TruseqTMRNA sample prep Kit方法进行文库构建、测序。
1.4 差异表达基因及功能富集分析采用Audic S
算法进行差异表达基因分析,将错误发现率(Falsediscovery rate,FDR)校正后的FDR<0.05且差异倍数|log2FC|≥1的视为差异表达基因,并对筛选得到的差异表达基因进行聚类分析。利用GO数据库对差异表达的基因进行GO信号通路富集分析。
2 结果
2.1 转录组测序与差异表达基因分析转录组测序得到对照组和处理组总的reads数分别有64025270和64179790条,过滤得到clean reads数所占比例分别为96.8%和96.7%,共检测到58233个基因,有统计学差异表达基因77个,其中上调的基因30个,下调的基因47个,聚类图(1A)和火山图(1B)见图1。
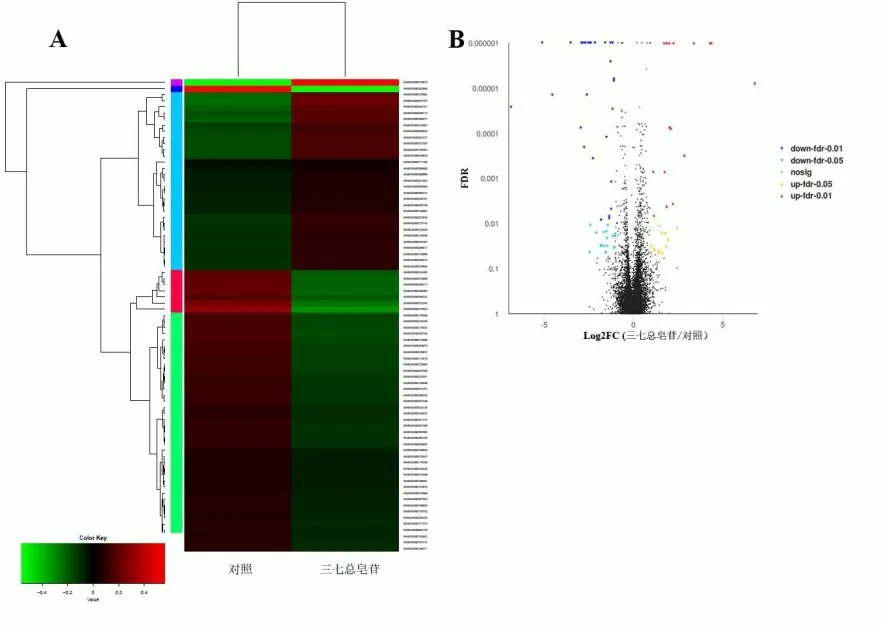
图1 差异表达基因聚类图(1A)和火山图(1B)
2.2 差异表达基因GO分类统计利用GO数据库(Gene Ontology,http://www.geneontology.org/),将基因按照它们参与的生物学过程(Biological Process,BP)、构成细胞的组分(Cellular Compo⁃nent,CC)和实现的分子功能(Molecular Func⁃tion,MF)进行分类。对差异表达基因进行GO分类统计,并将所得结果绘制上、下调基因GO注释柱形图(图2)。
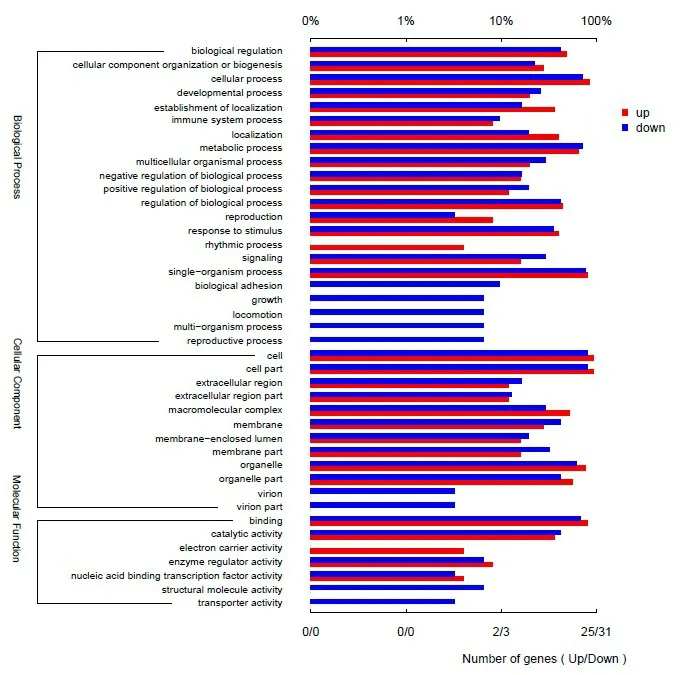
图2 差异表达基因GO注释柱形图
2.3 差异表达基因GO富集分析利用GO数据库,对差异表达基因进行GO功能显著性富集分析,使用软件:Goatools(https://github.com/tanghai⁃bao/GOatools),使用方法为Fisher精确检验,为控制计算的假阳性率,使用4种多重检验方法(Bon⁃ferroni,Holm,Sidak和false discovery rate)(West⁃fall和Stanleyyoung,1989)对P值进行了校正,经过校正的P值≤0.05时,认为此GO功能存在显著富集情况。见图3。
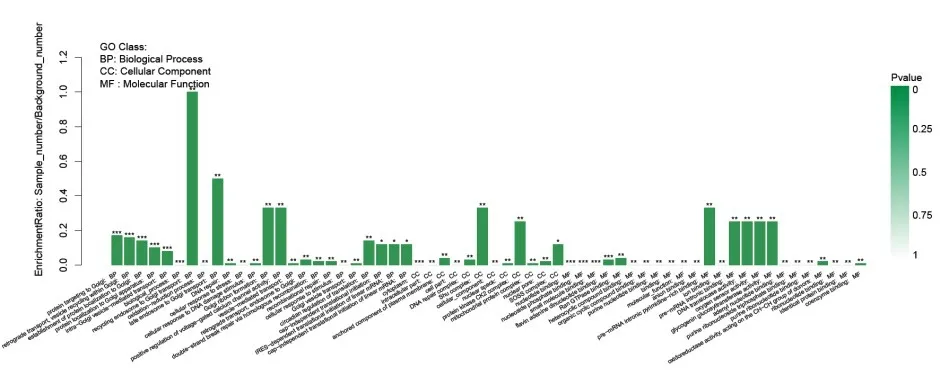
图3 差异表达基因GO富集柱状图
2.4 显著富集GO的层级结构展示通过对GO富集分析产生的GO主题进行可视化分析,发现三七总皂苷在多个方面产生影响,主要为分子功能:小分子、核苷酸磷酸化分子,核苷酸分子,黄素腺嘌呤二核苷酸分子;生物过程中的高尔基体功能相关;高尔基体囊泡介导转运、高尔基体内囊泡循环逆行转运、定位高尔基体的蛋白;细胞组分:细胞质等方面存在显著差异性,见图4。
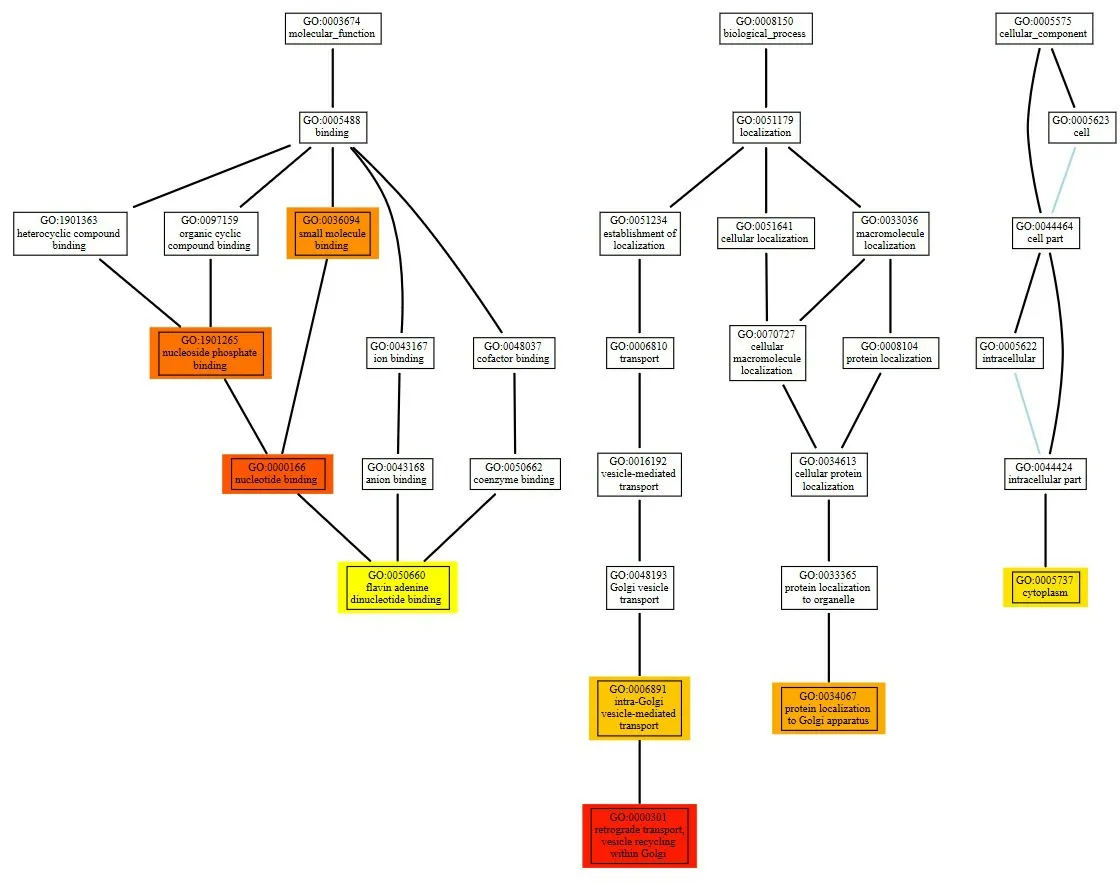
图4 差异表达基因的显著性GO有向无环图
3 讨论
本研究共发现三七总皂苷处理肝癌HepG2细胞后异常表达的基因77个,其中56个基因与GO Term中的41个主题相关,分别是25个上调的基因和31个下调的基因。相关主题占比超过50%的基因有7个,分别为ARPC4-TTLL3、RBM4、MYBPC1、
ATP6V1B1、NUPR1、PLB1、XXbac-BPG32J3.22,它们分别至少同21个主题相关。其中研究较多的与肿瘤的发生发展相关的基因为上调基因中的RBM4、下调基因中的NUPR1。
RBM4是RNA结合蛋白,具有抑制肿瘤生长的作用,可以通过调节靶基因前体mRNA的可变剪接发挥抑制作用。RBM4通过促进雌激素受体α(ERα)的泛素化降解下调ERα的表达,发挥抑制乳腺癌的作用[4]。更多资料显示,RBM4可以抑制肺癌H157细胞、卵巢癌SKOV3细胞、胰腺癌Panc-1细胞、肝癌HepG2细胞及前列腺PC-3细胞的生长[5]。RBM4通过抑制SRSF1的表达,降低致癌基因S6K1和4E-BP1的磷酸化激活,抑制mTOR通路[5]。大量临床数据显示,非小细胞肺癌、乳腺癌和胰腺癌的肿瘤组织中表达的RBM4比癌旁正常组织中的低[6-8]。KM plotter数据库分析RBM4和肿瘤患者生存率之间的关系,发现RBM4的高表达与肺癌、乳腺癌和卵巢癌总体生存率的上升有相关性,可能是影响肿瘤患者生存率的独立预后因素[5]。
NUPR1蛋白是一种定位于细胞核的小分子蛋白,在肿瘤的发生、发展过程中发挥重要的调节作用,能够促进乳腺癌、胰腺癌、甲状腺癌、非小细胞肺癌等肿瘤的生长[9]。NUPR1蛋白及其mRNA在临床收取的多种类型的肿瘤标本中呈现高表达状态。乳腺良性病变向乳腺癌前病变发展,最后发展为乳腺癌,NUPR1在其发展过程种逐渐增高,且其高表达与预后不良相关[9]。正常肝脏组织中无NUPR1的表达,肝癌的癌前病变,如肝炎和肝硬化中,NUPR1表达逐渐增高,肝癌样本中表达最高。ZZW-115是一种NUPR1抑制剂,不仅能诱导细胞凋亡和坏死抑制肿瘤细胞生长,而且能诱导线粒体衰竭导致细胞死亡[10]。
我们前期的研究显示三七总皂苷抑制肝癌细胞的生长,提高其对顺铂和X射线的敏感性[2,3],可能和三七总皂苷上调RBM4的表达、下调NU⁃PR1的表达相关。通过本次基因芯片检测与分析,可以提出假设:三七总皂苷可以通过增加RBM4的表达,抑制mTOR通路,启动细胞凋亡和坏死机制,抑制NUPR1的表达,通过线粒体衰竭诱导细胞死亡,达到抑制肿瘤细胞生长的作用。
4 结论
肝癌发生发展过程涉及多个生物学过程和信号通路的改变。本研究分析了三七总皂苷对肝癌HepG2细胞的基因表达的影响,发现差异表达的基因77个,其中上调30个,下调47个。基因功能注释结果表明三七总皂苷通过改变多个基因的表达,影响与肿瘤密切相关的生物学进程和信号通路。在异常表达的基因中,RBM4和NUPR1是已知的与肿瘤发生发展密切相关的基因,可能与三七总皂苷调控肝癌的放疗和化疗敏感性存在一定的相关性。

