一株从原蚕分离的微孢子虫的生物学特性及其系统发育分析
黄旭华 何强 汤庆坤 蒋满贵 李田 龙江琼 潘国庆 郑宁 鲁成 潘志新

黄旭华(1978-),高级农艺师,广西“新世纪十百千人才工程”第二层次人选,2019年广西“最美科技工作者”,主要从事蚕病防控技术研究工作。主持完成国家自然科学基金项目“家蚕与野外昆虫间微孢子虫交叉传染性及其传染机制”、广西科学研究与技术开发计划项目“广西家蚕微粒子病防控技术研究与应用”、广西自然科学基金项目“广西桑园主要昆虫的微孢子虫资源调查及其对家蚕感染研究”、国家现代农业产业技术体系广西创新团队桑蚕病虫害岗位项目等;参与完成国家自然科学基金项目、广西科学研究与技术开发计划项目等国家级、省部级项目10余项。在《Journal of Basic Microbiology》《Analyst》《Applied Microbiology and Biotechnology》《南方农业学报》《蚕业科学》等国内外期刊发表科技论文40余篇。获得国家发明专利1项。
摘要:【目的】研究从广西蚕种繁育中分离獲得的微孢子虫,调查其感染性和分类地位,为蚕种生产掌握病原来源及有效控制家蚕微粒子病流行提供参考依据。【方法】采用生物试验测定从蚕种生产一线分离获得微孢子虫(GXM14)对家蚕的半数感染浓度(IC50)和胚种传染率,显微镜观察其孢子形态,采用吉姆萨染色法观察孢子的生活史;通过PCR扩增及测序获得GXM14的SSU rRNA基因序列和ITS 序列,并利用MEGA 5.0和DNASTAR中的Megalign构建系统发育进化树及进行相似性和遗传距离分析。【结果】GXM14孢子呈卵圆形,大小为(1.68±0.15)μm×(3.06±0.15)μm,其孢子生活史中有双核,以二分裂方式进行增殖,符合Nosema属的特征。GXM14对家蚕的IC50为3.53×105个/mL,是家蚕微孢子虫(N.b)的5.8倍;对家蚕的胚种传染率为5.0%,只是N.b的1/9。GXM14的SSU rRNA基因序列长度1226 bp,G+C含量为34.42%;ITS序列长度503 bp,G+C含量为29.82%。GXM14的SSU rRNA基因序列与甜菜夜蛾微孢子虫(Nosema sp. SE)SSU rRNA基因序列(KT336240.1)的遗传距离为0.2,相似度达98.9%,即GXM14与甜菜夜蛾微孢子虫(KT336240.1)的亲缘关系很近。基于微孢子虫ITS序列的相似性和遗传距离分析结果表明,GXM14与12株已知Nosema属微孢子虫的相似度均低于91.0%,而遗传距离在4.0以上,证实GXM14是一种新的微孢子虫,故将其暂命名为Nosema sp. GXM14。【结论】从蚕种生产一线分离获得的家蚕病原性微孢子虫(GXM14)属于Nosema属,与N.b同属异种,是一株新的微孢子虫,可能是野外昆虫微孢子虫交叉感染家蚕的病原。因此,在蚕种繁育中加强防虫杀虫,防止昆虫微孢子虫污染桑叶交叉感染家蚕,是控制家蚕微粒子病暴发流行的重要措施。
关键词: 家蚕;微孢子虫;蚕种繁育;感染性;Nosema属
中图分类号: S884.21 文献标志码: A 文章编号:2095-1191(2020)01-0011-08
Abstract:【Objective】The present study was conducted to investigate the pathogenicity and classification feature of the microsporidian that was isolated from silkworms(Bombyx mori) in egg production, that would provide reference basis for the pathogen sources and the control of pebrine in silkworm egg production. 【Method】GXM14 microspofidian was isolated from the parent silkworm in silkworm egg production line. The 50% infectious concentration(IC50) and the germinative infection rate of GXM14 were investigated with biological test methods, the spore shape of GXM14 was observed with optical microscope, and its life cycle was observed with Giemsas staining. The small subunit ribosomal RNA (SSU rRNA) gene and rRNA ITS sequence of GXM14 were obtained by PCR amplification, cloning and sequencing, the phylogenetic tree based on SSU rRNA sequences was constructed with the software of MEGA5 , and the genetic distance of SSU rRNA and rRNA ITS sequence were analyzed with Megalign in software of DNASTAR. 【Result】The IC50 of GXM14 to silkworm was 3.53×105 ind/mL,which was 5.8 times to that of Nosema bombycis(N.b), and the germinative infection rate of GXM14 was 5.0%, which was only 1/9 of that of N.b. The spore of GXM14 was oval in shape and (1.68±0.15)μm×(3.06±0.15)μm in size. There was binuclear in the life cycle of GXM14, and propagated in binary fission, which was conformed to the taxonomic features of Nosema. The SSU rRNA gene sequence of GXM14 was 1226 bp long, the G+C content was 34.42%, the rRNA ITS sequence of GXM14 was 503 bp long, the G+C content was 29.82%. The SSU rRNA genetic distance of GXM14 and Nosema sp. SE(KT336240.1) was 0.2, and its similarity was 98.9%, showed that GXM14 had close relationship with Nosema sp. SE. Analysis on rRNA ITS of microsporidian indicated that the similarity of GXM14 and 12 known Nosema microsporidian isolates were all lower than 91.0%, and their genetic distance were more than 4.0. It showed that GXM14 was a new Nosema microsporidian, and named Nosema sp. GXM14. 【Conclusion】There is a pathogenic microsporidan(GXM14) of silkworm that is isolated from the silkworm in egg production line. GXM14 is a new Nosema microsporidian, GXM14 and N.b belong to different species of the same genus. It is probable that GXM14 is transmitted by wild insect in the process of silkworm egg production. Therefore, the working of pest control for preventing the cross-infection microsporidium from wild insects to silkworm through mulberry leaf has practical value on the prevention of microsporidiosis for silkworm.
Key words: Bombyx mori; microspofidian; silkworm egg production; pathogenicity; Nosema
Foundation item:National Natural Science Foundation of China(31560048,31460035); State Key Laboratory of Mulberry Silkworm Genome Biology Open Project(2016)
0 引言
【研究意义】家蚕微粒子病是一种具有食下传染和胚种传染的蚕病,也是蚕种生产中唯一的检疫对象,《蚕种管理办法》规定所有生产蚕种必须通过检疫合格才能应用于蚕业生产(浙江大学,2000;黄旭华等,2018a)。据统计,我国蚕种生产每年因感染微粒子病的检疫淘汰率均在3.0%以上,约数十万张蚕种遭淘汰,经济损失十分严重(徐杰等,2015)。此外,在蚕种检疫中常出现一些与典型家蚕微孢子虫(Nosema bombycis,N.b)孢子形态大小不同的异型微孢子虫,但这些异型微孢子虫的感染力及分类地位尚未明确,极大影响蚕种检疫工作的开展(郑祥明等,1999;鲁兴萌和邵勇奇,2016)。因此,在蚕种繁育过程中调查异型微孢子虫来源,明确其感染力和分类地位,对蚕种生产中有效防控家蚕微粒子病具有重要意义。【前人研究进展】微粒子病是一种危害性非常严重的家蚕传染病,1870年法国科学家巴斯德创立的“母蛾检验,淘汰病蛾所产蚕卵,应用无毒蚕种”方法为防控家蚕微粒子病提供了重要手段(万永继,2005),但随着蚕业生产的发展,蚕种检疫中常出现异型微孢子虫干扰的问题。早在20世纪60—70年代,日本蚕业科学家为了完善家蚕微粒子病防控方法,曾对感染家蚕的异型微孢子虫进行深入研究,并相继从家蚕体内分离获得具褶孢虫属的M25和M27(Pleistophora spp.)、泰罗汉孢虫M32(Thelohania sp.)及变形孢虫M12(Vairimolpha sp.)等异型微孢子虫(Takeshi,2003)。从20世纪末开始,在我国蚕业传统强省也有诸多学者开展了异型微孢子虫感染家蚕的相关研究。方定坚等(1991)从广州石牌地区饲养的家蚕原种母蛾中分离出2株异型微孢子虫MG1和MG2,但在形态构造、病原性和血清学性状等方面与N.b存在明显差异;万永继等(1995)研究了SCM微孢子虫,证实其与N.b异属异种,对家蚕胚种传染力很弱;沈中元和徐莉(2001)从蚕蛾中分离获得一种小型微孢子虫MZ1,其形状呈卵圆形,寄生在家蚕的大多数组织器官,可经胚种传染给下一代;潘敏慧等(2002)对家蚕微孢子虫SCM8进行研究,发现SCM8仅感染寄生于家蠶的中肠上皮组织,具食下传染力,但无胚种传染力,致病力较弱;时连根等(2002)从家蚕体中分离到一种新的病原性微孢子虫SLN1,主要感染寄生于家蚕肌肉、气管上皮细胞和脂肪等组织,致病性弱,胚种传染率低;Meng等(2018)从家蚕分离获得一株变形孢仔虫V. necatrix BM,并证实其对家蚕无胚种传染性。随着广西蚕业的快速发展,广西学者也相继开展了家蚕异型微孢子虫的调查研究。罗梅兰等(2012)从家蚕体内分离得到一株新的病原性微孢子虫GXM1,与N.b同属异种,但对家蚕食下感染和胚种感染均较低;黄旭华等(2012a)从家蚕体内分离获得另一株病原性微孢子虫GXM2,并证实该微孢子虫对家蚕具有较强的食下感染力,但只有轻微的胚种传染力,与N.b异属异种,属于Vairimorpha属。【本研究切入点】蚕种微粒子病检疫出现的异型微孢子虫是蚕种繁育过程中饲养家蚕感染所造成,因此追踪蚕种繁育过程病原性微孢子虫的感染情况,并明确其感染性和遗传系统发育规律,可为深入研究病原性微孢子虫对蚕种生产的危害打下基础。【拟解决的关键问题】深入研究从广西蚕种繁育中分离获得的微孢子虫,调查其感染性和分类地位,为蚕种生产掌握病原来源及有效控制家蚕微粒子病暴发流行提供参考依据。
1 材料与方法
1. 1 试验材料
供试异型微孢子虫从广西贵港市蚕种场原蚕点饲养的原蚕分离获得,编号为GXM14;N.b由广西蚕业科学研究院桑蚕病虫害研究室继代保存。分别取GXM14和N.b两种微孢子虫接种二龄起蚕,饲养12 d后(五龄第2 d),取发病蚕体进行提取、纯化与精制微孢子虫(黄旭华等,2013)。供试家蚕品种为932×芙蓉。
1. 2 GXM14形态观察
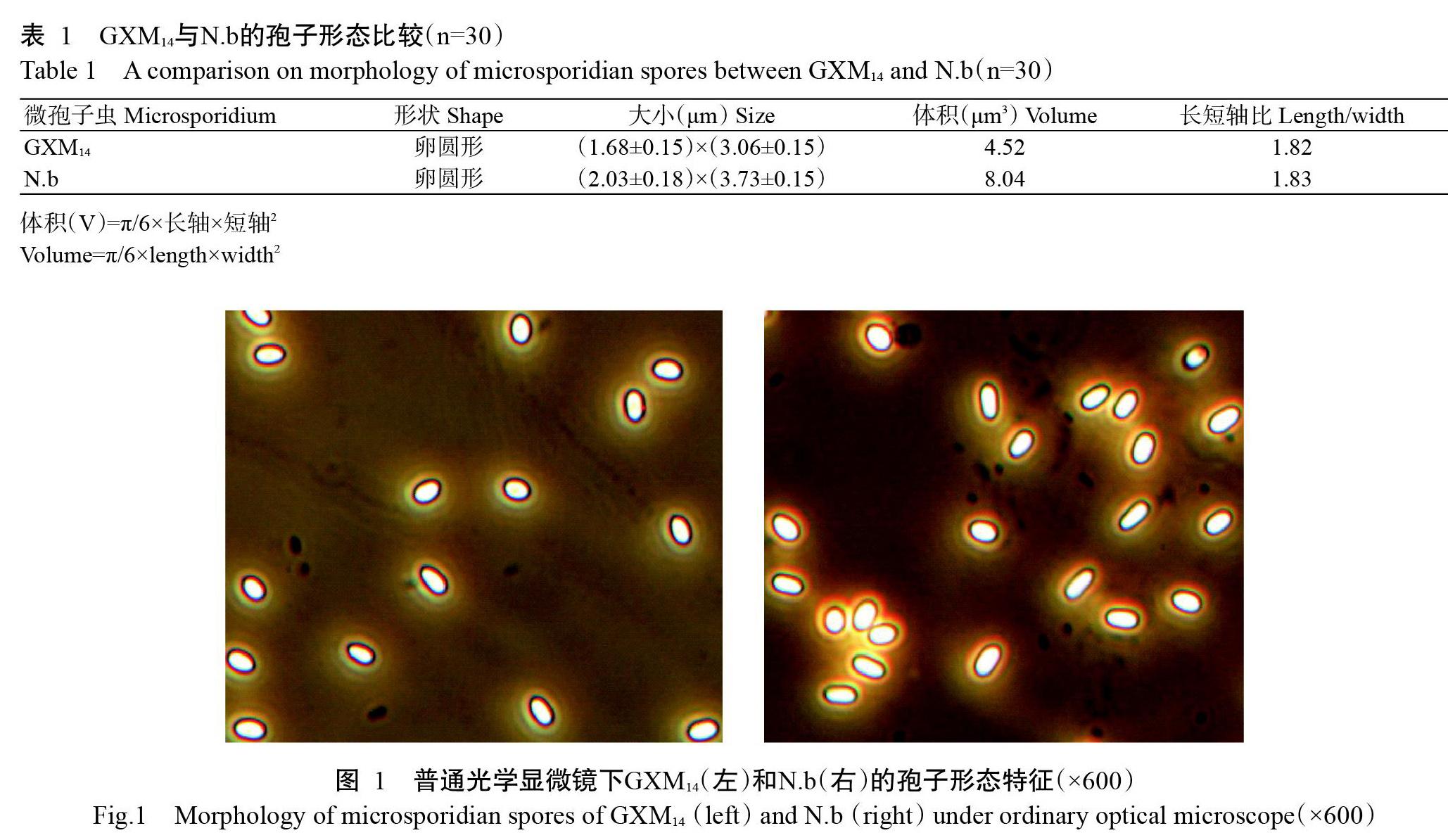
将纯化的GXM14和N.b孢子悬浮液制成临时标本,利用相差显微镜(Nikon E200)以600倍进行观察,并以明美显微数码测量分析系统(v1.0)的测微尺分别测量30个GXM14和N.b的孢子长轴与短轴,比较其形状差异(黄旭华等,2013)。
1. 3 GXM14生活史观察
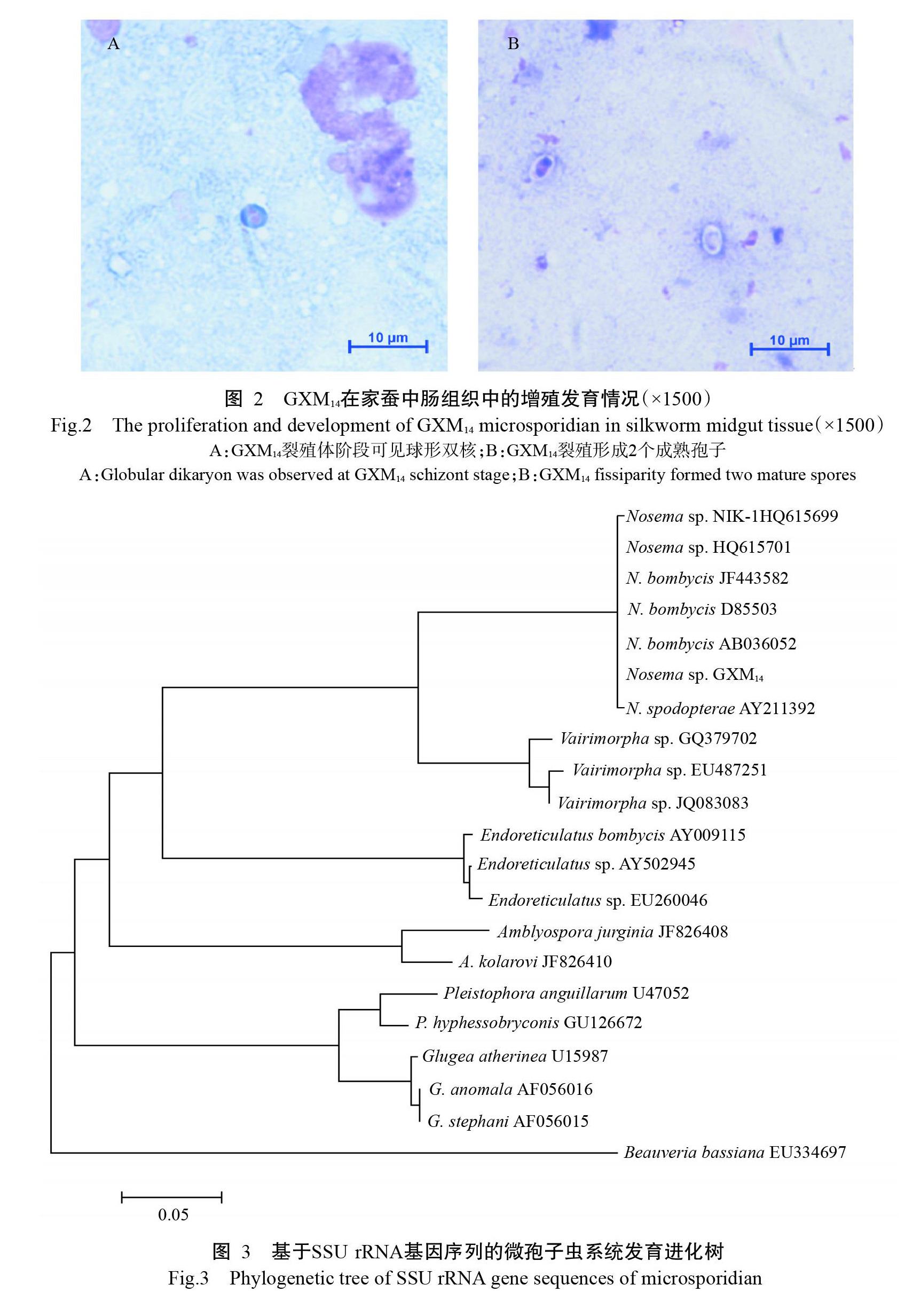
以GXM14孢子悬浮液(浓度3×107个/mL)涂抹桑叶,稍晾干后饲喂二龄起蚕12 h,再用洁净桑叶继续饲育,每隔12 h取出家蚕解剖并采集中肠组织涂抹玻片,以95%甲醇固定5 min后进行吉姆萨染色,清水冲洗,晾干,中性树脂封片,显微镜下观察孢子的发育增殖状态(黄旭华等,2012b)。
1. 4 GXM14对家蚕的感染性调查
1. 4. 1 GXM14对家蚕的食下感染 将GXM14配制成1×107个/mL的孢子悬浮液,再用无菌水以10倍梯度稀释成4个系列稀释液(106、105、104和103),分别取各稀释梯度的孢子悬浮液0.2 mL,涂抹在2片面积为8.0 cm2的桑叶上,稍晾干,饲喂二龄起蚕(30头)12 h,重复2区。各区家蚕食完含GXM14孢子的桑叶后,更换蚕座纸片,改用洁净桑叶饲养12 d(五龄第3 d),对各区家蚕逐头进行研磨镜检,计算孢子感染率,同时以N.b孢子感染为对照。采用Reed Muench法计算半数感染浓度(IC50)(浙江大学,2000)。
1. 4. 2 GXM14对家蚕的胚种传染调查 将GXM14配制成2.0×105个/mL的孢子悬浮液,取洁净桑叶浸泡于孢子液中,稍晾干,饲喂五龄起蚕12 h,再以洁净桑叶饲育至上蔟,化蛹、化蛾后制种,检验产卵母蛾,将感染GXM14的重症母蛾(孢子检出密度>100个孢子/视野)所产卵圈即时浸酸处理,催青,孵化蚁蚕,饲养至三龄起蚕,逐头镜检(包括死卵),调查胚种传染率。
1. 5 GXM14系统发育分析
1. 5. 1 基因组DNA抽提 参照蔡顺风等(2011)的方法,取1.0 mL GXM14孢子悬浮液(浓度约1×109个/mL),12000 r/min离心5 min;加入700 μL GP1悬浮,转入专用破碎管中(装有0.2 g大玻璃珠和0.2 g小玻璃珠),以组织破碎仪破碎3次(40 s/次);使用植物基因组DNA提取试剂盒抽提基因组DNA。
1. 5. 2 SSU rRNA基因和ITS序列扩增及测序 参照Huang等(2004)的方法,选取引物18f(5'-CACCA GGTTGATTCTGCC-3')和1537r(5'-TTATGATCCTC CTAATGGTTC-3')进行微孢子虫SSU rRNA基因扩增。PCR扩增程序:94 ℃预变性5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 70 s,进行30个循环;72 ℃延伸 10 min。PCR扩增产物以1.5%琼脂糖凝胶进行电泳,并以回收胶试剂盒对目的条带进行回收;再利用pEASY?-T1 Simple Cloning Kit试剂盒对目的产物进行克隆,将阳性菌落的菌液送至深圳华大基因科技有限公司测序。同时,以引物ILSUF(5'-TGGGTT TAGACCGTCGTGAG-3')和S33R(5'-ATAGCGTCT ACGTCAGGCAG-3')进行微孢子虫ITS序列扩增,PCR扩增程序:94 ℃预变性5 min;94 ℃ 45 s,56 ℃ 45 s,72 ℃ 45 s,进行30个循环;72 ℃延伸 10 min。目的序列的回收、克隆及测序步骤同SSU rRNA基因。
1. 5. 3 序列同源性比对及系统发育进化树构建
参照董世楠等(2009)的方法,对SSU rRNA基因和ITS序列进行同源性比对及遗传距离分析,并基于SSU rRNA基因序列的相似性构建系统发育进化树。
2 结果与分析
2. 1 GXM14的基本形态
通过显微镜观察发现,GXM14的孢子大小较一致,呈卵圆形,整体上比N.b明显偏小。测量获得两种微孢子虫(GXM14和N.b)的长轴和短轴如表1所示,GXM14孢子的体积仅是N.b孢子的56%。GXM14孢子和N.b孢子具有相同的折光性,在普通光学显微镜下均呈淡绿色(图1)。
2. 2 GXM14的生活史
采用吉姆薩染色法观察GXM14在家蚕中肠组织中的增殖情况,发现GXM14在家蚕中肠组织中增殖的裂殖体阶段(48 h)可见球形双核(图2-A),且以二分裂方式进行增殖,最终形成2个双核的成熟孢子(图2-B)。GXM14发育周期约108 h,其发育模式符合Nosema属的特征。
2. 3 GXM14对家蚕的致病性
2. 3. 1 GXM14对家蚕的IC50 分别以GXM14和N.b的梯度浓度孢子悬浮液感染家蚕二龄起蚕。在孢子高浓度感染区(×107和×106个/mL),两种微孢子虫感染家蚕在三龄后期开始出现发育缓慢现象,入眠约推迟6 h;四龄起蚕表皮缩皱,体色深暗,行动迟缓,入眠困难,入眠约推迟12 h,出现不蜕皮或半蜕皮的家蚕,且N.b感染区的家蚕发病症状较GXM14感染区更明显;在孢子低浓度感染区(×105、×104和×103个/mL),两种微孢子虫感染家蚕的生长发育与空白对照无明显差异。经计算获得,GXM14对家蚕的IC50为3.53×105个/mL,N.b对家蚕的IC50为6.00×104个/mL,即GXM14对家蚕的IC50是N.b的5.8倍,说明GXM14对家蚕虽然有较强的食下感染力,但明显低于N.b。
2. 3. 2 GXM14对家蚕的胚种传染力 利用GXM14孢子感染家蚕五龄起蚕,调查感染GXM14重症母蛾(孢子检出密度>100个孢子/视野)所产蚕卵孵化后代的微孢子虫感染情况。结果表明,GXM14对家蚕的胚种传染率为5.0%,而N.b对家蚕的胚种传染率为45.0%,表明GXM14对家蚕具有较低胚种传染力。
2. 4 微孢子虫的SSU rRNA基因和ITS序列分析结果
测序结果表明,GXM14的SSU rRNA基因序列长度1226 bp,G+C含量为34.42%;ITS序列长度503 bp,G+C含量为29.82%。基于SSU rRNA基因序列,利用MEGA 5.0对GXM14及已知的6株微粒子属(Nosema)、2株钝孢虫属(Amblyospora)、3株内网虫属(Endoreticulatus)、3株变形孢虫属(Vairimorpha)、2株具褶孢虫属(Pleistophora)和3株格留虫属(Glugea)等微孢子虫构建系统发育进化树,以白僵菌(Beauveria bassiana)(EU334679)作为外群,结果(图3)发现GXM14位于Nosema属类群中,说明GXM14是Nosema属微孢子虫,与其生活史观察等传统分类结果一致。同时,采用DNASTAR中的Megalign对GXM14及13株已知微孢子虫和白僵菌的SSU rRNA基因序列进行相似性和遗传距离分析,结果(表2)发现GXM14的SSU rRNA基因序列与甜菜夜蛾微孢子虫(Nosema sp. SE)SSU rRNA基因序列(KT336240.1)的遗传距离为0.2,相似度达98.9%,说明GXM14与甜菜夜蛾微孢子虫(KT336240.1)的亲缘关系很近。此外,基于微孢子虫ITS序列的相似性和遗传距离分析结果表明,GXM14与12株已知Nosema属微孢子虫的相似度均低于91.0%,而遗传距离均在4.0以上(表3),证实GXM14是一种新的微孢子虫,故将其暂命名为Nosema sp. GXM14。
3 讨论
家蚕微粒子病是一种危害最严重的传染性蚕病(万永继,2005)。1845年欧洲养蚕业大面积暴发家蚕微粒子病,经济损失惨重,虽然法国科学家巴斯德建立的袋制种母蛾镜检法逐步控制了家蚕微粒子病的蔓延,但其危害致使欧洲蚕业持续衰落及萎缩(周泽扬等,2014);在日本和我国蚕区也曾暴发过严重的家蚕微粒子病,尤其在20世纪80年后期我国蚕区每年因家蚕微粒子病而烧毁的蚕种约占总产量的10%,即超过100万张蚕种因感染微孢子虫而被淘汰(徐杰等,2015)。进入21世纪,广西蚕业规模迅速扩大,已逐渐发展成为世界最重要的蚕茧生产基地,与此同时广西蚕种繁育深受家蚕微粒子病威胁,大量蚕种因母蛾检疫携带微孢子虫而被淘汰。掌握病原来源是控制流行性疾病的首要条件(吕抒真等,2014),本课题组前期在蚕种生产一线调查感染家蚕的病原性微孢子虫,结果从广西贵港市蚕种场原蚕点饲养的家蚕中分离获得一株微孢子虫(GXM14),以期为蚕种生产中溯源家蚕微粒子病病原提供参考依据。
本研究结果显示,GXM14对家蚕的食下和胚种感染力均较弱,GXM14对家蚕的IC50是N.b的5.8倍,GXM14对家蚕的胚种传染率为5.0%,只是N.b的1/9,即GXM14的感染性较差,与前期对一些家蚕异型微孢子虫和昆虫微孢子虫的研究结果(黄旭华等,2018a,2018b)一致。此外,GXM14的形态大小明显比N.b小,其生活史观察发现具有双核,以二分裂方式进行增殖,具备Nosema属的典型特征;从基于微孢子虫SSU rRNA基因序列构建的系统发育进化树也发现GXM14属于Nosema属,与甜菜夜蛾微孢子虫Nosema sp. SE(KT336240.1)的相似度达98.9%,二者的亲缘关系很近;而基于ITS序列的相似性和遗传距离分析发现,GXM14与其他Nosema属微孢子虫的相似度均低于91.0%,而遗传距离在4.0以上,证实GXM14是一株新的Nosema属微孢子虫,暂命名为Nosema sp. GXM14。
本研究还追踪调查了检出GXM14的家蚕的亲本蚕种,排除家蚕微粒子病胚种传染可能性,确定是原蚕饲养过程中环境污染造成家蚕食下感染GXM14。根据微孢子虫的系统发育进化分析结果,推测GXM14来源于野外昆虫(甜菜夜蛾),进一步证明野外昆虫微孢子虫交叉感染家蚕是引起蚕种繁育家蚕微粒子病发生的重要方式(黄旭华等,2018b)。因此,在蚕种繁育过程中加强防虫杀虫及采取有效方法净化桑叶,防止病虫的粪便或尸体污染桑园桑叶,是控制家蚕微粒子病暴发流行的重要措施。
4 结论
从蚕种生产一线分离获得的家蚕病原性微孢子虫(GXM14)属于Nosema属,与N.b同属异种,是一株新的微孢子虫,可能是野外昆虫微孢子虫交叉感染家蚕的病原。因此,在蚕种繁育中加强防虫杀虫,防止昆虫微孢子虫污染桑叶交叉感染家蚕,是控制家蚕微粒子病暴发流行的重要措施。
参考文献:
蔡顺风,何欣怡,何祥康,邱海洪,李光才,何永强,鲁兴萌. 2011. 一种快速高效制备家蚕微孢子虫基因组DNA和总蛋白的方法[J]. 蚕业科学,37(6):1019-1024. [Cai S F,He X Y,He X K,Qiu H H,Li G C,He Y Q,Lu X M. 2011. A protocol for fast and efficient preparation of genomic DNA and total proteins of Nosema bombycis[J]. Science of Sericulture,37(6):1019-1024.]
董世楠,朱峰,徐莉,沈中元. 2009. 七种微孢子虫核糖体小亚基基因(SSU rRNA)的克隆及其系统发育分析[C]//中国蚕学会. 中国蚕学会第六届青年学术研讨会论文集:1-23. [Dong S N,Zhu F,Xu L,Shen Z Y. 2009. Sequence and phylogenetic analysis of SSU rRNA gene of seven microsporidia[C]//Chinese Society of Sericultural Science. Proceedings of the Sixth Youth Academic Symposium:1-23.]
方定坚,廖森泰,郑祥明,朱德贞,陈汉明,刘隽,祁丽然,卢铿明,农朝志,白碧璋,毛铿祖,陈锦汉. 1991. 家蚕新微孢子虫MG1、MG2的研究——I.形态、病原性和传播途径[J]. 广东农业科学,(2):35-38. [Fang D J,Liao S T,Zheng X M,Zhu D Z,Chen H M,Liu J,Qi L R,Lu K M,Nong C Z,Bai B Z,Mao K Z,Chen J H. 1991. Stu-dies on morphology,pathogenicity and infection path of new Nosema bombysis MG1 and MG2—Ⅰ. Morphology,pathogenicity and infection path[J]. Guangdong Agricultural Sciences,(2):35-38.]
黃旭华,罗梅兰,汤庆坤,王桂文,黄深惠,潘国庆,蒋师东,夏青,王霞,毛洪斌,潘志新. 2018a. 家蚕病原性微孢子虫多样性调查分析[J]. 南方农业学报,49(6):1208-1214. [Huang X H,Luo M L,Tang Q K,Wang G W,Huang S H,Pan G Q,Jiang S D,Xia Q,Wang X,Mao H B,Pan Z X. 2018a. Diversity of pathogenic microsporidan of Bombyx mori[J]. Journal of Southern Agriculture,49(6):1208-1214.]
黄旭华,祁广军,汤庆坤,潘志新,罗梅兰,蒋满贵,朱方容,黄深惠. 2012a. 一株从家蚕体内分离获得的微孢子虫GXM2的生物学特性[J]. 南方农业学报,43(7):1049-1053. [Huang X H,Qi G J,Tang Q K,Pan Z X,Luo M L,Jiang M G,Zhu F R,Huang S H. 2012a. Biological characteristics of a strain of microsporidia GXM2 isolated from silkworm[J]. Journal of Southern Agriculture,43(7):1049-1053.]
黄旭华,祁广军,汤庆坤,潘志新,朱方容,黄元姣,林强,罗梅兰,石美宁,吴勇浒,黄深惠. 2012b. 从野外昆虫体内分离的5株微孢子虫的生物学特性与分子系统发育研究[J]. 蚕业科学,38(5):864-872. [Huang X H,Qi G J,Tang Q K,Pan Z X,Zhu F R,Huang Y J,Lin Q,Luo M L,Shi M N,Wu Y H,Huang S H. 2012b. Biological characters and molecular phylogenesis of five microsporidia isolated from field insects[J]. Science of Sericulture,38(5):864-872.]
黄旭华,祁广军,汤庆坤,潘志新,朱方容,刘玉生,于先哲,罗梅兰,蒋满贵,石美宁,唐亮,虞崇江. 2013. 从稻纵卷叶螟分离的一株微孢子虫的生物学特性与分子系统发育分析[J]. 蚕业科学,39(3):543-550. [Huang X H,Qi G J,Tang Q K,Pan Z X,Zhu F R,Liu Y S,Yu X Z,Luo M L,Jiang M G,Shi M N,Tang L,Yu C J. 2013. Biolo-gical characters and molecular phylogenetic analysis of a microsporidium strain isolated from Cnaphalocrocis medinalis[J]. Science of Sericulture,39(3):543-550.]
黄旭华,汤庆坤,罗梅兰,黄深惠,蒋师东,夏青,黄景滩,李安华,鲁成,陈小青,毛洪斌,潘志新. 2018b. 广西昆虫微孢子虫资源调查及其特性分析[J]. 南方农业学报,49(8):1541-1547. [Huang X H,Tang Q K,Luo M L,Huang S H,Jiang S D,Xia Q,Huang J T,Li A H,Lu C,Chen X Q,Mao H B,Pan Z X. 2018b. Investigation on resource of insect microsporidan in Guangxi and its characters[J]. Journal of Southern Agriculture,49(8):1541-1547.]
鲁兴萌,邵勇奇. 2016. 家蚕微粒子病防控技术研究的发展现状与趋势[J]. 蚕业科学,42(6):945-952. [Lu X M,Shao Y Q. 2016. A review on current status and development trend of pebrine prevention and control technology[J]. Science of Sericulture,42(6):945-952.]
罗梅兰,黄旭华,潘志新,蒋满贵,汤庆坤,黄深惠,安春梅,胡文娟,甘丽红. 2012. 一株家蚕病原性微孢子虫的生物学特性与分子系统发育分析[J]. 蚕业科学,38(5):856-863. [Luo M L,Huang X H,Pan Z X,Jiang M G,Tang Q K,Huang S H,An C M,Hu W J,Gan L H. 2012. Biological characters and molecular phylogenetic analysis of a microsporidian isolate pathogenic to Bombyx mori[J]. Science of Sericulture,38(5):856-863.]
吕抒真,范兆军,李天宪,阎保平. 2014. 我国重要自然宿主及媒介昆虫病毒性病原调查本体的构建与应用[J]. 科研信息化技术与应用,5(4):53-61. [Lü S Z,Fan Z J,Li T X,Yan B P. 2014. Construction and application of the investigation ontology for viral pathogens in important na-tural hosts and insect vectorsn[J]. E-science Technology & Application,5(4):53-61.]
潘敏慧,萬永继,祝仁英. 2002. 家蚕病原性微孢子虫SCM8的研究[J]. 蚕业科学,28(2):115-119. [Pan M H,Wan Y J,Zhu R Y. 2002. Studied on a microsporidium(SCM8) pathogenic for the Silkworm,Bombyx mori[J]. Acta Sericologica Sinica,28(2):115-119.]
沈中元,徐莉. 2001. 从家蚕蛾中分离的微孢子虫MZ1(Nosema sp.)对家蚕的病原性研究[J]. 蚕业科学,27(3):197-199. [Shen Z Y,Xu L. 2001. Studies on the pathogenicity of a microsporidium MZ1(Nosema sp.) to the silkworm,Bombyx mori[J]. Acta Sericologica Sinica,27(3):197-199.]
时连根,刘淑梅,徐俊良. 2002. 从家蚕体分离的一种新微孢子虫SLN1的研究[J]. 蚕业科学,28(3):211-214. [Shi L G,Liu S M,Xu J L. 2002. Study on a new microspori-dium SLN1 isolated from the silkworm,Bombyx mori[J]. Acta Sericologica Sinica,28(3):211-214.]
万永继. 2005. 家蚕病原性微孢子虫若干种群的研究与控制[D]. 北京:中国农业大学. [Wan Y J. 2005. Study and control on several population of pathogenic microspori-dian in the silkworm,Bombyx mori(Bombycidae,Lepidoptera)[D]. Beijing:China Agricultural University.]
万永继,张琳,陈祖佩,潘敏慧,杜云,敖明军,杨彪. 1995. 家蚕病原性微孢子虫SCM7(Endoreticulatus.sp)的分离和研究[J].蚕业科学,21(3):168-172. [Wan Y J,Zhang L,Chen Z P,Pan M H,Du Y,Ao M J,Yang B. 1995. Study of a pathogenic microsporidium SCM7 (Endoreti-culatus. sp) isolated from the larvae of silkworm,Bombyx mori[J]. Acta Sericologica Sinica,21(3):168-172.]
徐杰,陈灵方,楼霞,朱春群. 2015. 浙江省蚕种微粒子病防治的现状与对策[J]. 蚕桑通报,46(3):1-3. [Xu J,Chen L F,Lou X,Zhu C Q. 2015. Present situation and countermeasures of silkworm pebrine disease prevention and control in Zhejiang Province[J]. Bulletin of Sericulture,46(3):1-3.]
浙江大学. 2000. 家蚕病理学[M]. 北京:中国农业出版社:148-173. [Zhejiang University. 2000. Histopathology of silkworm[M]. Beijing:China Agriculture Press:148-173.]
郑祥明,杨琼,黄炳辉,廖森泰,方定坚,黄星光,余爱群,徐兴耀,卢铿明. 1999. 家蚕分离的微孢子虫Vairimorpha sp. MG4的研究[J]. 蚕业科学,25(4):225-229. [Zheng X M,Yang Q,Huang B H,Liao S T,Fang D J,Huang X G,Yu A Q,Xu X Y,Lu K M. 1999. Study on a microspori-dian Vairimorpha MG4 separated from silkworm,Bombyx mori[J]. Acta Sericologica Sinica,25(4):225-229.]
周澤扬,潘国庆,李田,许金山. 2014. 家蚕微孢子虫基因组生物学[M]. 北京:科学出版社:2-3. [Zhou Z Y,Pan G Q,Li T,Xu J S. Genome biology of Nosema bombycis[M]. Beijing:Science Press:2-3.]
Huang W F,Tsai S J,Lo C F Y,Soichi Y,Wang C H. 2004. The novel organization and complete sequence of the ribosomal RNA gene of Nosema bombycis[J]. Fungal Genetics and Biology,41(5):473-481.
Meng X Z,Luo B,Tang X Y,He Q,Xiong T R,Fang Z Y,Pan G Q,Li T,Zhou Z Y. 2018. Pathological analysis of silkworm infected by two microsporidia Nosema bombycis CQ1 and Vairimorpha necatrix BM[J]. Journal of Invertebrate Pathology,153:75-84.
Takeshi K. 2003. Biology of microsporidians infecting the silkworm,Bombyx mori,in Japan[J]. Journal of Insect Biotechnology Sericology,72(1):1-32.
(责任编辑 兰宗宝)

