与家蚕丝氨酸蛋白酶抑制剂serpin—3相互作用蛋白的筛选
王明慧 毛钰霞 许雅香
摘要:丝氨酸蛋白酶抑制剂超基因蛋白质家族,参与调节昆虫体内多种生理反应。本研究在体外原核表达 6His-Bmserpin-3,以此作为饵蛋白,采用His-pull down技术及SDS-PAGE分析,从家蚕血液中筛选出了能与 Bmserpin-3 结合的2个蛋白质,分子量分别为83.04、83.57 ku。对家蚕幼虫sp-2、sp-3在不同组织的表达变化分析可知,sp-2 在脂肪体、血淋巴中表达量比较高,sp-3在精巢、脂肪体、血淋巴里表达量比较高。
关键词:家蚕;pull-down;蛋白相互作用
中图分类号: S881.2文献标志码: A文章编号:1002-1302(2015)01-0037-03
收稿日期:2014-03-03
基金项目:现代农业产业技术体系建设专项(编号:CARS-22);江苏高校优势学科建设工程项目。
作者简介:王明慧(1986—),女,山东滨州人,硕士,主要从事家蚕资源与功能基因组学研究。E-mail:wangminghui.219@163.com。
通信作者:许雅香,副教授,主要从事家蚕资源与功能基因组学研究。Tel:(0512)65880260;E-mail:xuyaxiang@suda.edu.cn。Serpin全称为serine protease inhibitor,是一类能够抑制丝氨酸蛋白酶活性的超家族蛋白质,参与调节生物体内多种生理反应,包括血液凝集、纤维蛋白溶解、补体激活、免疫黑化、生长发育过程中组织构建等[1-5]。Serpin在昆虫各组织中均有分布,对昆虫的生命活动起到重要作用,目前关于家蚕Serpin的研究很多,但是几乎没有关于家蚕Serpin相互作用蛋白方面的研究,生物的生命活动主要体现在蛋白质水平,许多蛋白是通过与其他蛋白相互作用来发挥作用的,因此,研究蛋白质相互作用能更好地理解生物的生命活动。本研究原核表达并纯化了Bmserpin-3蛋白,应用pull-down及质谱技术筛选到Bmserpin-3的相互作用蛋白,并通过荧光定量PCR技术初步探索了这2个基因的组织分布,旨在为深入探讨 Bmserpin-3 的功能机制提供依据。
1材料与方法
1.1材料
家蚕品种为笔者所在研究室保存的大造,正常桑叶育,取5龄4 d幼虫的脂肪体,-70 ℃保存备用。Trizol RNA提取及M-MLV反转录试剂等化学常规试剂均购自宝生物工程(大连)有限公司。引物由上海生工生物工程技术服务有限公司合成。
1.2重组表达载体的构建和鉴定
采用反转录的家蚕5龄4 d幼虫脂肪体的cDNA模板,PCR扩增serpin-3基因。引物为F:5′-CTAGCTAGCAACATAGATCCGAACACCCTAAG-3′(下划线为NheⅠ酶切位点)和R:5′-ACGCGTCGACCTATAGTACTTTATAATCCCCATCG-3′(下划线为SalⅠ酶切位点)。扩增条件是:95 ℃ 预变性 3 min;95 ℃变性30 s,60.4 ℃退火35 s,72 ℃延伸3 min,33个循环;最后72 ℃终延伸10 min。将PCR扩增产物与pET-28a(+)进行双酶切,然后再将其目的片段与 pET-28a(+) 连接,转化至E.coli Top10中,挑选阳性克隆进行酶切鉴定及测序检验。
1.3重组表达载体的诱导表达
含家蚕serpin-3全长cDNA的阳性菌株在含30 mg/L卡那霉素的LB培养基中加入诱导剂异丙基硫代-β-D-半乳糖苷(IPTG)至终浓度为0.5 mmol/L,37 ℃诱导表达6 h后,4 ℃ 5 000 r/min离心10 min收集菌体,用PBS重悬,在冰浴中超声破碎,直到溶液变澄清。4 ℃ 5 000 r/min离心 10 min,收集沉淀即得包涵体形式的6His-Bmserpin-3。
1.4重组蛋白的纯化、鉴定
4 ℃ 5 000 r/min离心20 min收集细胞,以1 ∶20比例添加0.01 mol/L PBS (pH值为 8.0),在PBS中悬浮细胞,冰上超声后添加等量的蛋白loading buffer,蛋白样品煮沸5 min,5 000 r/min 离心20 min。上清通过SDS-PAGE(没有梳子)来纯化,锌染后,将胶条切成1 cm的条带,装到透析袋里,4 ℃ 透析过夜。用Brandford法检测蛋白含量后,-20 ℃保存备用,将纯化好的蛋白用SDS-PAGE来鉴定。
1.5pull-down筛选与Bmserpin-3重组蛋白相互作用蛋白
按照每100 mg组织加入1 mL裂解液的比例加入RIPA裂解液(使用前数分钟加入PMSF使PMSF终浓度为1 mmol/L),通过强烈的涡旋使样品裂解充分,5 000 r/min离心5 min,取上清,储存于-20 ℃冰箱中备用。用10 mL binding buffer 平衡250 μL树脂,将纯化后的Bmserpin-3蛋白与树脂在4 ℃下缓慢摇晃结合5 h,使Bmserpin-3蛋白与树脂充分结合,让蛋白液流出,用含50 mmol/L咪唑的Tris洗脱Ni2+柱,祛除未结合的Bmserpin-3蛋白,将1 mL血液总蛋白加入Ni2+柱中,与Bmserpin-3蛋白复合物共同4 ℃孵育过夜,使血液内靶蛋白与Bmserpin-3蛋白结合,从而形成树脂-Bmserpin3-血液总蛋白的复合物,用含50 mmol/L咪唑的Tris洗脱Ni2+柱,祛除未结合的血液总蛋白,用含 200 mmol/L 咪唑的 elution buffer洗脱液,将Bmserpin3-血液总蛋白复合物与树脂分离,收集洗脱液,12% SDS-PAGE分析收集的洗脱液。
1.6靶标蛋白基因的分布
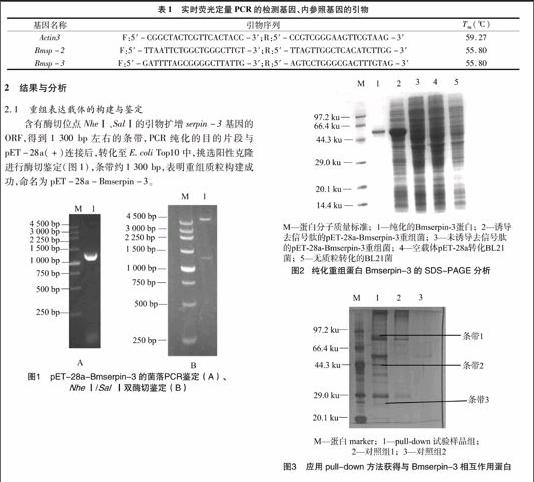
采用Primer 5.0软件,引物如表1所示。采用SYBR PrimeScriptTM RT-PCR试剂盒测定,具体步骤按照说明书进行,反应程序为:95 ℃预变性1 min;95 ℃变性15 s,60 ℃退火 30 s,循环45次。反应体系为:SYBRPremix Ex TaqTM(2×) 10 μL,上游引物0.4 μL,下游引物0.4 μL,ROX Reference Dye Ⅱ(50×) 0.4 μL,DNA模板 2 μL,ddH2O 6.8 μL。反应过程由ABI7300荧光定量PCR仪(Applied Biosystems公司)软件自动设定,每个样品重复3次。表1实时荧光定量PCR的检测基因、内参照基因的引物
基因名称引物序列Tm(℃)Actin3F:5′-CGGCTACTCGTTCACTACC-3′;R:5′-CCGTCGGGAAGTTCGTAAG-3′59.27Bmsp-2F:5′-TTAATTCTGGCTGGGCTTGT-3′;R:5′-TTAGTTGGCTCACATCTTGG-3′ 55.80Bmsp-3F:5′-GATTTTAGCGGGGCTTATTG-3′;R:5′-AGTCCTGGGCGACTTTGTAG-3′ 55.80
2结果与分析
2.1重组表达载体的构建与鉴定
含有酶切位点NheⅠ、SalⅠ的引物扩增serpin-3基因的ORF,得到1 300 bp左右的条带,PCR纯化的目的片段与 pET-28a(+)连接后,转化至E.coli Top10中,挑选阳性克隆进行酶切鉴定(图1),条带约1 300 bp,表明重组质粒构建成功,命名为pET-28a-Bmserpin-3。
2.2重组蛋白的纯化与鉴定
重组质粒转化至E.coli BL21,经IPTG诱导表达重组 Bmserpin-3 蛋白,表达的蛋白多是以包涵体方式存在,用锌染、透析的方式进行纯化,结果如图2所示,SDS检测到1条单一的约49 ku的蛋白条带。
2.3重组蛋白相互作用蛋白的鉴定
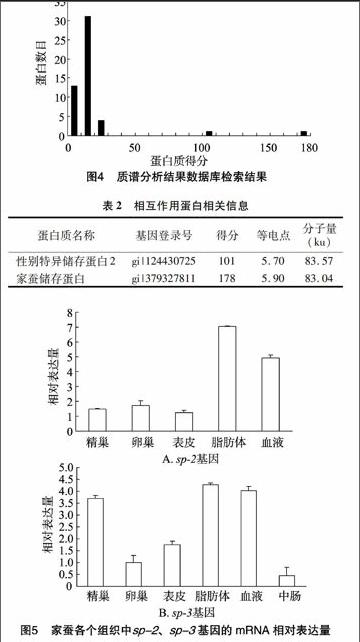
样品组内形成树脂-Bmserpin-3-血液总蛋白的复合物后,先用含50 mmol/L咪唑的Tris洗脱,祛除非特异性结合,然后用含200 mmol/L咪唑的elution buffer洗脱液使 Bmserpin-3-血液总蛋白复合物与树脂分离,收集样品,后期用SDS-PAGE分析(图3)。可见与Bmserpin-3相互作用的3条蛋白条带。从SDS-PAGE胶上将3条蛋白条带切下,放入EP管中,加入胰蛋白酶进行胶内酶切,然后用LC-MS/MS技术对获得的3条蛋白条带进行分析(图4)。鉴定出的蛋白是家蚕储存蛋白、性别特异储存蛋白2,相关蛋白信息见表2。
2.4家蚕幼虫Bmsp-2,3在不同组织的表达变化
由图5可以看出,sp-2、sp-3在各个组织都有分布,且sp-2在脂肪体、血淋巴中表达量比较高;sp-3在精巢、脂肪体、血淋巴中表达量比较高。
4结论与讨论
蛋白质是生物生命活动的重要体现者之一,几乎参与生物所有的生命过程、细胞活动。它在体内主要通过与自身或其他蛋白质及核酸形成复合体来进行基因调节、免疫应答、信
表2相互作用蛋白相关信息
蛋白质名称基因登录号得分等电点分子量
(ku)性别特异储存蛋白2gi|1244307251015.7083.57家蚕储存蛋白gi|3793278111785.9083.04
号转导、细胞组装等生物学功能[6-7]。通过研究蛋白质之间的相互作用可获得更多的细胞功能信息。目前蛋白质相互作用的主要研究方法有酵母双杂交技术、免疫共沉淀法、噬菌体展示技术、pull-down技术、荧光共振能量转移(FRET)技术及生物信息学分析法等。已有学者利用pull-down 方法鉴定已知的2种蛋白质间的相互作用,或采用少量Ni2+-NTA agarose beads 在Eppendorf 管中进行小体积的pull-down[8-9]。笔者采用Ni2+-NTA agarose beads 柱使整个体系放大,更利于蛋白质的结合、洗脱,并结合质谱分析来筛选与Bmserpin-3相互作用的蛋白质。丝氨酸蛋白酶抑制剂在生物体内分布广泛,参与调节生物体内多种生理反应。研究发现,云杉卷叶蛾serpin-1在表皮中高表达,且在蜕皮期间的转录水平高于蜕皮期。烟草天蛾serpin-1mRNA在5龄幼虫脂肪体中含量丰富,但在蜕皮、化蛹时mRNA水平骤然降低[10]。冈比亚按蚊serpin-2与丝氨酸蛋白酶CLIPB9结合调节黑化反应,此外CLIPB9与serpin2的相互作用还影响雌性成虫寿命[11]。果蝇serpin27A与serpin28D都参与了先天性免疫反应,但果蝇serpin28D只参与由创伤引起的酚氧化酶激活产生的黑化,serpin27A在酚氧化酶激活路径中调节病毒或病原菌引起的黑化[12-13]。果蝇中serpin43AC参与了toll途径调节的先天性免疫反应[14-15]。研究发现,冈比亚按蚊中serpin10在中肠上皮细胞聚集与疟疾病原体的传播有关[16]。Serpin家族在昆虫的表皮、头部、血淋巴、脂肪体、丝腺、中肠、精巢、卵巢中均有分布,对家蚕的各种生理活动起到调节作用[17]。董照明等认为,serpin-16在维持丝腺稳定的泌丝环境中发挥重要作用[18]。查宏贤研究表明,家蚕serpin-4参与了先天性免疫反应[19]。王彦云等证实serpin-6与家蚕表皮黑化、蜕皮变态、先天性免疫等生理过程有关[20]。李国胜等推测serpin-5与家蚕的生殖生理有关,可能参加了家蚕的先天免疫反应[21]。serpin-3是以单体的形式发挥作用还是与伴侣分子一起作用或是与其他蛋白质形成复合物来发挥作用还不得而知。本研究选择适宜大分子量蛋白质的六聚组氨酸作为标签,构建了家蚕serpin-3六聚组氨酸蛋白,并以此为饵蛋白,采用His-pull down技术,从家蚕血液中调取了2个与该蛋白相互作用的蛋白。它们均是血液储存蛋白,同源性很高,与β-芳基储存蛋白亚基(烟草天蛾)、芳基储存蛋白(棉铃虫)、血清储存蛋白2(印度蚕)具有很高的同源性,功能也相似,主要是参与免疫、信号传导。对家蚕幼虫sp-2、sp-3在不同组织的表达变化分析可知,sp-2在脂肪体、血淋巴中表达量比较高,sp-3在精巢、脂肪体、血淋巴里表达量比较高。
参考文献:
[1]Li W,Johnson D J,Esmon C T,et al. Structure of the antithrombin-thrombin-heparin ternary complex reveals the antithrombotic mechanism of heparin[J]. Nature Structural & Molecular Biology,2004,11(9):857-862.
[2]Kounnas M Z,Church F C,Argraves W S,et al. Cellular internalization and degradation of antithrombin Ⅲ-thrombin,heparin cofactor Ⅱ-thrombin,and alpha 1-antitrypsin-trypsin complexes is mediated by the low density lipoprotein receptor-related protein[J]. Journal of Biological Chemistry,1996,271(11):6523-6529.
[3]Collen D,Lijnen H R. Basic and clinical aspects of fibrinolysis and thrombolysis[J]. Blood,1991,78(12):3114-3124.
[4]Carrell R W,Evans D L,Stein P E. Mobile reactive centre of serpins and the control of thrombosis[J]. Nature,1991,353(6344):576-578.
[5]Travis J,Salvesen G S.Human plasma proteinase inhibitors[J]. Annual Review of Biochemistry,1983,52:655-709
[6]Brinda K V,Vishveshwara S. Oligomeric protein structure networks:insights into protein-protein interactions[J]. BMC Bioinformatics,2005,6:296.
[7]赵亚雪,唐赟. 蛋白质-蛋白质相互作用及其抑制剂研究进展[J]. 生命科学,2007,19(5):506-511.
[8]Sgarra R,Furlan C,Zammitti S,et al. Interaction proteomics of the HMGA chromatin architectural factors[J]. Proteomics,2008,8(22):4721-4732.
[9]Lee W J,Kim D U,Lee M Y,et al. Identification of proteins interacting with the catalytic subunit of PP2A by proteomics[J]. Proteomics,2007,7(2):206-214.
[10]Kanost M R,Prasad S V,Huang Y,et al. Regulation of serpin gene-1 in Manduca sexta[J]. Insect Biochemistry and Molecular Biology,1995,25(2):285-291.
[11]An Chunju,Budd A,Kanost M R,et al. Characterization of a regulatory unit that controls melanization and affects longevity of mosquitoes[J]. Cellular and Molecular Life Sciences,2011,68(11):1929-1939.
[12]Scherfer C,Tang H P,Kambris Z,et al. Drosophila serpin-28D regulates hemolymph phenoloxidase activity and adult pigmentation[J]. Developmental Biology,2008,323(2):189-196.
[13]Nappi A J,Christensen B M. Melanogenesis and associated cytotoxic reactions:Applications to insect innate immunity[J]. Insect Biochemistry and Molecular Biology,2005,35(5):443-459.
[14]Green C,Levashina E,Mckimmie C,et al. The necrotic gene in Drosophila corresponds to one of a cluster of three serpin transcripts mapping at 43A1.2[J]. Genetics,2000,156(3):1117-1127.
[15]Levashina E A,Langley E,Green C,et al. Constitutive activation of toll-mediated antifungal defense in serpin-deficient Drosophila[J]. Science,1999,285(5435):1917-1919.
[16]Danielli A,Kafatos F C,Loukeris T G. Cloning and characterization of four Anopheles gambiae serpin isoforms,differentially induced in the midgut by Plasmodium berghei invasion[J]. The Journal of Biological Chemistry,2003,278(6):4184-4193.
[17]刘衬丽,王东,李兵,等. 家蚕丝氨酸蛋白酶抑制剂基因 serpin-6 的克隆、序列分析和组织表达[J]. 昆虫学报,2009,52(1):1-9.
[18]董照明,赵萍,王凌燕,等. 家蚕丝氨酸蛋白酶抑制剂基因 serpin16 的表达规律及体外重组表达[J]. 蚕业科学,2010,36(2):236-242.
[19]查宏贤. 家蚕丝氨酸蛋白酶抑制剂Serpin4的基因克隆、表达及多克隆抗体制备[D]. 苏州:苏州大学,2011.
[20]王彦云,何渐鸣,李国胜,等. 家蚕丝氨酸蛋白酶抑制剂Bmserpin-6的特异性表达分析[J]. 蚕业科学,2013,39(2):257-260.
[21]李国胜,王彦云,王明慧,等. 家蚕丝氨酸蛋白酶抑制剂5的多克隆抗体制备及组织表达分析[J]. 蚕业科学,2013,39(2):261-265.