干扰TonEBP基因对Raw264.7细胞迁移、增殖和吞噬功能的影响
朱 哲,赵季红,杨国红,李 覃,候月辉,李玉明
近年研究发现,巨噬细胞在众多非免疫源性疾病的发生发展过程中处于核心地位,其功能和表型的多样性和异质性是它们在不同组织、不同疾病中发挥作用的病理生理学基础,很大程度上影响着疾病的发生与转归[1]。张力反应性增强因子结合蛋白(tonicity-responsive enhancer binding protein, TonEBP)是细胞高渗应激的主要转录因子,控制高渗环境下影响细胞存活的关键基因的表达[2]。本实验室前期研究发现,在高盐刺激下小鼠巨噬细胞(Raw264.7细胞)的细胞活性、迁移能力、吞噬及增殖能力均显著增强,同时伴有TonEBP表达水平的上调。目前有关TonEBP在巨噬细胞功能行使过程中发挥的作用尚不清楚,由此我们推测TonEBP可能是调节巨噬细胞功能学特性的潜在位点。本研究旨在明确TonEBP对巨噬细胞生理功能的影响,为进一步揭示巨噬细胞在相关疾病中的作用机制提供参考。
1 材料与方法
1.1 材料 小鼠Raw264.7细胞株由本实验室提供,TonEBP基因沉默慢病毒载体设计构建及包装服务由上海合生基因生物公司提供;高糖培养液(DMEM)、胎牛血清(FBS)购自美国Gibco公司;嘌呤霉素(Puromycin)、碘化丙啶(PI)、高效RIPA组织/细胞快速裂解液(RIPA buffer high)、RNase A均购自北京索莱宝科技公司;CCK-8试剂盒购自中国碧云天公司;TRIzol购自日本TAKARA公司;5X All-IN-One RT MasterMix、SYBRGreen实时定量PCR试剂购于美国abcam公司;实验所用抗体均购自美国Affinity 公司;Transwell购于美国Costar公司;红色酵母多糖吞噬试剂盒(EZCellTM Phagocytosis AssayKit)购于美国BioVision公司;Model280酶标仪购于美国BIO-RAD公司;ABI 7300荧光定量PCR仪购于美国Applied Biosystems公司;CytomicsFC500流式细胞仪购于德国Beckmancoμlter公司。
1.2 方法
1.2.1 细胞培养 将Raw264.7细胞置于10%FBS的DMEM培养液中,5%CO2、37 ℃恒温恒湿条件下培养,取对数生长期细胞进行实验,待细胞长至80%密度大小时传代。
1.2.2 慢病毒感染和筛选 针对小鼠TonEBP基因序列(ID:54446)设计3条带有嘌呤霉素抗性的不同干扰靶点的RNA干扰慢病毒及1条空载慢病毒,慢病毒载体信息见表1。慢病毒感染及稳定干扰TonEBP细胞株的建立, 将对数生长期细胞按5×104/孔接种于24孔板,感染前根据各组慢病毒滴度及预实验确定的MOI值计算出需要加入的量,待细胞融合至50%时加入慢病毒进行感染。感染成功后继续培养10 d,期间正常传代,后以5 μg/ml嘌呤霉素筛选各组细胞,得到稳定株后扩大培养。提取各组细胞RNA及蛋白,real time-PCR法检测各组细胞TonEBP mRNA相对表达量(引物序列:TonEBP上游引物,5′-TTCATAGTTGGAATTTCAGAGCA-3′;下游引物,5′-TTGCGAGTATACAAATGTTCCAA-3′。GAPDH上游引物,5′-TAAGAGGGATGCTGCCCTTAC-3′;下游引物,5′-AATCCGTTCACACCGACCTT-3′),Western blot法检测各组细胞TonEBP蛋白表达量,将干扰效率最高的稳定细胞株命名为TonEBP-shRNA组,空载慢病毒感染组细胞株命名为negative control(NC组),野生型Raw264.7细胞株命名为wide type(WT组)进行后续实验。

表1 shRNA慢病毒靶序列
1.2.3 CCK-8法检测细胞活性 将上述各组细胞以1×103/孔接种于96孔板,每组设5个复孔,重复3次。在细胞贴壁后(0 h),继续培养24、48、72、96、120 h后弃原培养液,加入配制好的CCK-8溶液,于培养箱中孵育2 h后用酶标仪检测450 nm处吸光光度(A)值。细胞活力(%)=(干扰细胞OD-空白OD)/(对照细胞OD-空白OD)×100%
1.2.4 Transwell法检测细胞迁移能力 选用8 μm孔径的迁移小室,取对数生长期细胞,用无血清培养液按5×105/ml的密度重悬细胞后取200 μl加入上室,下室加入含10%胎牛血清培养液600 μl,培养24 h后取出小室,擦净其上表面,无水乙醇固定15 min后用结晶紫染色30 min,PBS清洗3次,显微镜下随机选取10个视野,计数每个视野下小室下表面细胞数,取平均值。
1.2.5 流式细胞术检测细胞周期 取各组对数生长期细胞5×105个,加入2 ml预冷的70%乙醇4 ℃固定30 min,洗涤1次后加入含有RNase A的PBS 500 μl,37 ℃孵育30 min后PBS洗涤1次,再加入配好的PI溶液,室温避光孵育30 min,300目筛网过滤后上机检测。用Modfit 4.0软件分析各时相细胞比例,细胞增殖指数(proliferation index, PI,%)=[(S+G2/M)/(G0/G1+S+G2/M)]×100%。
1.2.6 流式细胞术检测细胞吞噬能力 将各组细胞按2×105/孔接种于6孔板,每组设两个复孔。细胞融合至80%后消化离心,弃上清,依次加入含10%FBS培养液200 μl及红色酵母多糖(Red Zymosan) 5 μl后重悬,培养箱中开盖孵育2 h后离心弃上清,500 μl吞噬测定缓冲液清洗3次后上机检测。
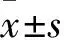
2 结 果
2.1 稳定干扰TonEBP细胞株的建立 慢病毒成功感染细胞后经筛选得到稳定株。测定各组稳定细胞株中TonEBP mRNA及蛋白的相对表达量,结果显示与正常组细胞相比,编号为pHS-ASR-LW222的病毒株干扰效率达70%以上(P<0.01,表2),明显高于其他慢病毒感染组,而pHS-ASR-LW198组与对照组相比,干扰效率无统计学差异(图1)。


载体编号TonEBP mRNATonEBP蛋白正常细胞组1.000±0.0000.548±0.03pHS-ASR-LW1981.091±0.0820.581±0.03pHS-ASR-LW2220.163±0.028①②0.141±0.01①②pHS-ASR-LW2230.567±0.008①②0.365±0.02①②pHS-ASR-LW2240.506±0.092①②0.346±0.06①②
注:与正常细胞组比较,①P<0.01;与pHS-ASR-LW198组比较,②P<0.01

图1 Western blot 法检测细胞TonEBP蛋白表达
A.正常细胞组;B.pHS-ASR-LW198;C.pHS-ASR-LW222;D.pHS-ASR-LW223;E.pHS-ASR-LW224
2.2 CCK-8法检测细胞活性 与WT组相比,TonEBP-shRNA组细胞增殖活性自24 h起降低(P<0.05),NC组与WT组结果比较无统计学差异 (表3)。


组别WT组NC组TonEBP-shRNA组F00.31±0.020.31±0.040.33±0.030.63924 h0.46±0.010.45±0.010.39±0.02①②11.44748 h0.63±0.020.60±0.020.57±0.02①②5.30272 h1.01±0.111.00±0.080.71±0.02①②13.32096 h1.42±0.041.34±0.070.93±0.06①②61.080120 h1.56±0.091.50±0.151.26±0.06①②6.935
注:与WT组比较,①P<0.05;与NC组比较,②P<0.05
2.3 Transwell检测细胞迁移能力 对各组小室下表面的细胞数进行计数,结果显示TonEBP-shRNA组穿过小室的细胞数(88±7.00)明显低于WT组(356±35.23),差异有统计学意义(P<0.05),NC组(361±22.59)与WT组结果比较差异无统计学意义 (图2)。

图2 Transwell法检测各组细胞迁移功能(结晶紫染色,×200)
2.4 流式细胞术检测细胞周期 根据流式结果计算各组细胞增殖指数,结果显示TonEBP-shRNA组细胞增殖指数(38.73±2.57)明显低于WT组(50.20±2.29),差异有统计学意义(P<0.05),NC组(51.44±1.20)与WT组比较结果差异无统计学意义(表4,图3)。


组别G0/G1期G2/M期S期PIWT组49.81±2.299.92±0.7740.28±1.5450.20±2.29NC组48.56±1.199.77±1.3841.67±0.9551.44±1.20TonEBP-shRNA组61.26±2.56①②4.44±0.55①②34.30±2.06①②38.73±2.57①②F33.3831.5318.4033.33
注:与WT组比较,①P<0.01;与NC组比较,②P<0.05
2.5 流式细胞术检测细胞吞噬能力 与WT组[(5.63±0.42)%]相比,TonEBP-shRNA组的吞噬能力明显降低[(2.26±0.10) %],差异有统计学意义(P<0.05),NC组[(5.37±0.48%)]与WT组比较结果无统计学差异(图4)。

图3 流式细胞术检测各组细胞周期

图4 流式细胞术检测各组细胞吞噬能力
3 讨 论
巨噬细胞作为机体固有免疫的重要组成部分,在抗炎、调节免疫方面发挥着十分重要的作用[3]。随着对巨噬细胞研究的深入,我们认识到其功能作用的发挥不仅局限于免疫系统,在肿瘤[4]、动脉粥样硬化(atherosclerosis,AS)[5]、盐敏感性高血压[6]和糖尿病[7]等疾病的病程初期甚至整个病程都存在与巨噬细胞相关的炎性反应。如炎性反应初期,受到体内炎性信号刺激后,巨噬细胞增殖活性明显增强,大量巨噬细胞迁移至病变部位,通过吞噬病原体、分泌炎性介质对抗感染、修复组织损伤、促进伤口愈合[8]。若巨噬细胞持续处于活化状态,大量巨噬细胞迁移浸润在组织中会诱发过度的炎性反应从而加重组织损伤[9]。如因颅脑外伤造成的脑部损伤中发现有巨噬细胞介导的炎性反应参与其中,可促进脑组织局部发生过度炎性反应,致使神经元死亡最终导致机体行为和认知障碍[10]。研究发现,通过调节巨噬细胞免疫功能、减少细胞因子分泌,抑制其增殖活性、迁移、吞噬功能能够减轻过度炎性反应,降低因过度炎性反应造成的负面影响[11]。另外,巨噬细胞介导的慢性炎性反应在众多疾病的发生发展过程中起到了关键作用。近年研究发现,AS的病理改变是基于动脉壁的慢性无菌性炎性反应[12]。在AS早期,单核细胞黏附于血管内皮细胞,在跨越内皮层后成熟为巨噬细胞,巨噬细胞局部增殖累积,吞噬脂质后成为泡沫细胞,从而导致AS斑块的逐步形成[13]。由此可见,若能在AS早期通过抑制巨噬细胞生理功能,降低其迁移、增殖及吞噬能力,或可防止斑块的形成,一定程度上减缓AS的发生与发展,同时提示我们对巨噬细胞生理功能的调控或是防治此类病理改变的有效路径。
TonEBP最初被定义为一种响应于高渗应激的调节蛋白,因细胞外钠离子浓度升高而被激活[14],保护细胞在高渗环境中免受损伤[15]。新的证据表明TonEBP还可因炎性刺激表达增强,通过影响细胞功能,在一些疾病的炎性阶段发挥作用[8]。研究发现TonEBP可以通过限制染色质进入启动子来抑制抗炎细胞因子IL-10的表达,从而促进炎性反应[16]。在类风湿关节炎小鼠模型中,TonEBP单倍体缺失小鼠血管翳的形成较正常模型小鼠明显减少[17]。随着研究的深入,TonEBP与炎性反应之间的联系被逐渐揭开,未来有关TonEBP与巨噬细胞之间的研究或是我们认识炎性疾病和免疫相关疾病的另一窗口。
本实验利用慢病毒感染技术敲低Raw264.7细胞TonEBP的表达,在成功干扰小鼠巨噬细胞TonEBP表达后进行相关功能学实验。CCK-8实验发现干扰细胞TonEBP表达后,细胞吸光光度值自24 h起至120 h均明显低于正常组细胞,表明其活性较正常组细胞显著降低;Transwell实验结果显示TonEBP敲低组细胞迁移数目较正常组细胞明显减少,迁移能力下降;经流式细胞术检测细胞周期可知TonEBP敲低组细胞S期和G2/M期细胞比例较正常组显著下降,细胞增殖能力降低;与此同时,流式结果显示TonEBP敲低组细胞吞噬功能亦受到抑制,表现为对红色酵母多糖的吞噬率显著低于正常组细胞。
综上所述,下调巨噬细胞TonEBP的表达,可降低其活性,抑制其增殖、迁移及吞噬功能,说明TonEBP对巨噬细胞的生理功能具有调控作用。如前所述,巨噬细胞生理功能的行使与多种炎性疾病的发生与转归密切相关。基于巨噬细胞在炎性反应中的“双面性”,我们可尝试通过TonEBP调节其迁移、吞噬、增殖等生理功能,干预由巨噬细胞介导的炎性反应,从而降低巨噬细胞在相关疾病某个病程阶段所造成的不利影响,本实验的研究结果为进一步探索TonEBP对巨噬细胞病理、生理的作用和机制提供了有力参考。

