系统性红斑狼疮患者免疫功能与自身抗体的关系研究
何媛,周小娟,方欢欢*,熊静洁
(1.九江学院附属医院,江西 九江 332000;2.九江学院临床学院,江西 九江 332000)
系统性红斑狼疮(SLE)是一种可能致命的慢性自身免疫性疾病,易累及皮肤、心脏、大脑、肾脏等多系统器官[1],随着疾病的进展可使多器官受损。其发病机制至今未明,有研究认为是由于自身抗体的产生导致循环免疫复合物在血管内沉积,产生炎症或者通过启动固有免疫产生细胞因子[2-3],进而使组织破坏。补体系统作为固有免疫系统的重要组成部分,在SLE患者中可下降[4]。目前,一些免疫功能指标如免疫球蛋白IgG、补体C3,C4和自身免疫学检测指标如抗核抗体(ANA),抗SmD1抗体、抗dsDNA抗体等被广泛应用于SLE的检测中。由于这些检测指标的敏感性和特异性不一样,给临床医生在诊断SLE和评估预后方面带来一定的困难。本研究欲通过探讨免疫功能和自身抗体检测指标之间的关系,以帮助临床医生对SLE进行早期诊断、治疗监测和预后判断。
1 资料与方法
1.1 一般资料
选择2015年1月—2018年12月在我院风湿免疫科住院的SLE患者94 例,其中男9 例,女85 例,年龄(38±14.6) 岁,均符合2009年美国风湿病学会修订的SLE分类标准[5]。排除其他免疫系统疾病的患者。患者疾病活动性指标用SLE疾病活动指数(SLEDAI)评分标准进行衡量,以SLEDAI评分≥10 分作为判定疾病活动的标准。非SLE疾病组患者81 例[包括血小板减少性紫癜(ITP)9 例、硬化症(Scl)15 例、干燥综合征(SS)21 例、类风湿性关节炎(RA)36 例],其中男14 例,女67 例,年龄(35±11.2) 岁。健康对照组为我院同期体检者66 例,其中男8 例,女58 例,年龄(37±13.5) 岁,经体检排除心、肾、肺、肝等器质性疾病和糖尿病、高血压病、各种肿瘤、炎症和自身免疫性疾病等。各组年龄、性别等一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 标本采集
所有待测者清晨空腹抽静脉血5 mL,血液凝固后离心5 min,离心转速3 000 r/min。
1.2.2 检测方法
免疫球蛋白IgG、补体C3,C4检测采用免疫速率散射比浊法测定,仪器为美国贝克曼公司IMMAGE-800特定蛋白分析仪,使用配套原装试剂,按照仪器操作说明书进行操作。自身抗体的检测采用免疫印迹法检测抗核抗体谱IgG,试剂购自胡曼(德国)诊断有限公司,采用德国胡曼公司CycleBolt48全自动免疫印迹仪,按照操作说明进行操作。
1.3 统计学方法

2 结 果
2.1 三组自身抗体检测指标阳性率比较
自身抗体各检测指标除抗Jo-1抗体外,SLE组、非SLE疾病组其余指标阳性率均高于健康对照组,差异均具有统计学意义(P<0.05);SLE组中AnuA、抗dsDNA抗体、AHA、抗SmD1抗体、抗Rib-P抗体阳性率均高于非SLE疾病组,两组比较,差异有统计学意义(P<0.05),而抗U1-snRNP抗体、抗SS-A/Ro 60kD抗体、抗SS-A/Ro 52kD抗体、抗SS-B/La抗体、抗Scl 70抗体、抗着丝点B抗体、抗Jo-1抗体等七项检测指标和非SLE疾病组比较,差异无统计学意义(P>0.05)(见表1)。
2.2 SLE患者疾病活动期组、稳定期组与健康对照组免疫功能比较
SLE活动期组血清免疫球蛋白IgG水平高于SLE稳定期组和健康对照组,而血清补体C3,C4水平低于SLE稳定期组和健康对照组(均P<0.05),SLE稳定期组血清C3,C4,IgG水平和健康对照组相比,血清补体C3,C4水平更低,IgG水平则要高,差异有统计学意义(均P<0.05)(见表2)。
2.3 SLE组免疫功能检测指标与抗SmD1的关系
SLE患者中,将抗SmD1阳性组与抗SmD1阴性组免疫功能进行比较后发现,抗SmD1阳性组血清补体C3,C4水平低于抗SmD1阴性组,两组比较,差异有统计性意义(P<0.05)(见表3)。
2.4 SLE组免疫功能检测指标与抗dsDNA抗体关系
SLE患者中,按照抗dsDNA阴阳性进行分组比较免疫功能后发现,抗dsDNA阳性组血清补体C3,C4水平低于抗dsDNA阴性组(均P<0.05),而IgG水平两组变化无统计学意义(均P>0.05)(见表4)。
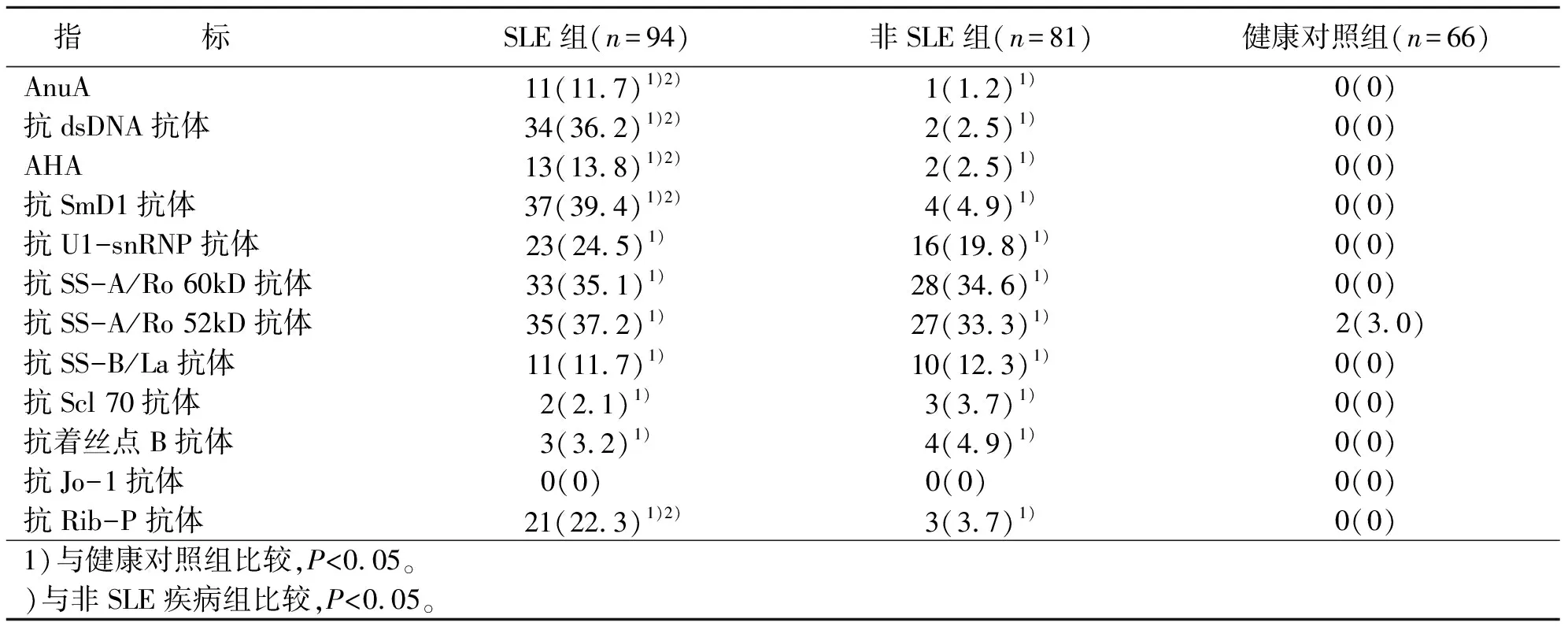
表1 三组自身抗体检测指标阳性率比较 例(%)

表2 SLE活动期组、稳定期组与健康对照组免疫功能检测指标比较

表3 SLE组免疫功能检测指标与抗SmD1关系

表4 SLE组免疫功能检测指标与抗dsDNA抗体关系
3 讨 论
SLE属于全身性、系统性疾病,临床表现不一。有研究认为其发病机制在遗传、免疫环境等因素作用下,SLE体内B细胞产生了针对自身反应性T细胞抗原成分相应的自身抗体[6],形成抗原抗体免疫复合物,这些免疫复合物沉积在体内,导致免疫调节系统异常,进而产生炎症,使组织坏死[7]。故实验室指标如自身抗体、免疫功能等项目检查对SLE的诊断和监测显得尤为重要。SLE患者体内可产生各种自身抗体,如抗SmD1抗体、AnuA、抗dsDNA抗体、AHA、抗Rib-P抗体、抗SSA抗体、抗SSB核体、抗U1-SnRNP抗体等。在本研究中,SLE组AnuA、抗dsDNA抗体、抗组蛋白抗体、抗SmD1抗体、抗dsDNA抗体阳性率分别为11.7%,36.1%,13.8%,39.4%,22.3%,比非SLE疾病组和健康对照组高,且差异具有统计学意义(均P<0.05),说明这些检测指标可帮助鉴别SLE和其他自身免疫性疾病。其他的自身抗体指标抗U1-snRNP抗体、抗SS-A/Ro 60kD抗体、抗SS-A/Ro 52kD抗体、抗SS-B/La抗体、抗Scl 70抗体、抗着丝点B抗体、抗Jo-1抗体,和非SLE疾病组相比,差异无统计学意义(P>0.05)。尽管抗SS-A/Ro 60kD抗体、抗SS-A/Ro 52kD抗体两个检测指标在SLE组很高,阳性率甚至超过了30%,但抗SS-A/Ro 60kD抗体、抗SS-A/Ro 52kD抗体、抗SS-B/La抗体可出现在多种自身免疫性疾病中,没有诊断特异性,更多时候作为干燥综合征的标志性抗体,并且抗SS-A/Ro 60kD抗体、抗SS-A/Ro 52kD抗体敏感度更高,抗SS-B/La抗体特异性稍强[8]。本研究中非SLE疾病组抗SS-A/Ro 60kD抗体、抗SS-A/Ro 52kD抗体抗体,抗SS-B/La抗体出现的阳性率和SLE疾病组差不多,这和张红等[6]的研究相符。
本研究将SLE按照SLEDAI评分分成活动期组和稳定期组,并和健康对照组比较,分析血清免疫功能相关指标补体C3,C4,gG。结果发现,补体C3,C4的水平变化为活动期组<稳定期组<健康对照组,而免疫球蛋白IgG的水平变化为活动期组>稳定期组>健康对照组,且差异具有统计学意义(均P<0.05)。说明SLE患者免疫功能与疾病活动性相关。SLE患者补体C3,C4减少的原因可能为SLE患者体内产生大量且多样的自身抗体,并和体内可溶性抗原形成免疫复合物,这些复合物可激活补体系统。激活的补体系统既可帮助清除免疫复合物,又可造成病理损害。因此,消耗补体过多,补体水平下降。SLE患者免疫球蛋白IgG水平与疾病程度正相关,其可能为SLE患者体内的自身抗体主要是IgG型。有报道说SLE患者自身抗体筛查指标抗核抗体滴度越高,IgG水平越高,病情越重[9]。本研究也发现SLE活动期IgG水平比稳定期水平要高。SLE患者免疫球蛋白IgG水平与疾病程度呈正相关,综合推测可能原因为SLE患者体内的自身抗体主要是IgG型。
抗Sm抗体是目前公认的诊断SLE的标志性特异性抗体之一。Sm抗原是由U-RNA,B′,B,N,D1,D2,D3,E,F和G等多种蛋白质组成,其中D1是Sm的主要抗原之一。本研究采用的试剂检测的是抗SmD1抗体,已有报道说其检测的敏感性高于抗Sm抗体[10-11]。本研究中,抗SmD1抗体的敏感性为39.4%,可能由于标本量较少的原因,这一结果比詹文丽等[11]报道的略低。此外,本研究还比较了SLE患者中抗SmD1抗体阳性组与抗SmD1抗体阴性组免疫功能情况,发现除IgG差异无统计学意义外,抗SmD1抗体阳性组C3,C4水平比抗SmD1抗体阴性组低,差异具有统计学意义(均P<0.05)。也有研究[6]报道抗Sm抗体阳性组C3,C4水平低于抗SmD1抗体阴性组。这些提示抗Sm阳性与补体C3,C4水平负相关。
抗dsDNA抗体是诊断SLE另一标志性抗体,可在SLE早期出现且其滴度高低与疾病的活动性及预后密切相关[12],在SLE疾病静止期或治疗后可出现阴性。补体C3,C4是补体系统的重要组成部分,在激活补体、参与免疫活动和维持内环境的稳定方面具有重要作用[13]。本研究同时比较了抗dsDNA抗体阳性组与抗dsDNA抗体阴性组的免疫功能情况。结果抗dsDNA抗体阳性组C3,C4水平比抗dsDNA抗体阴性组低(均P<0.05)。王峰来等[14]研究也表明补体C3,C4水平和抗dsDNA抗体定量负相关。
综上所述,联合检测自身抗体及补体C3,C4,免疫球蛋白IgG可提高SLE的检出率,具有互补作用,此外在评估SLE的病情和治疗监测方面也具有重要的临床价值。

