同步热放化疗治疗中晚期宫颈癌的效果及对细胞增殖凋亡相关蛋白表达的影响
刘 昵 刘新福 陈忠东
宫颈癌属于临床多发性妇科恶性肿瘤,临床主要治疗手段包括放射治疗以及手术治疗,但是临床疗效不甚理想,患者5年存活率较低,而且治疗后容易出现多种不良反应,不但影响治疗效果,同时也严重降低其生存品质。热疗属于临床常用肿瘤治疗方式,不但能够杀灭恶性肿瘤细胞,联合应用化疗、放疗等治疗可使化疗敏感性得到明显增加,同时还能够使机体免疫力得到提高[1-2]。此次研究旨在探讨应用同步热放化疗治疗中晚期宫颈癌的效果及其对细胞增殖凋亡相关蛋白表达产生的影响,分析如下。
1 材料与方法
1.1 基本资料
于2016年2月至2018年6月我院收治的中晚期宫颈癌患者中随机抽取64例,纳入标准:FIGO分期为Ⅱb期~Ⅲb期;Karnofsky得分≥70分;患者年龄不超过75周岁;病情经宫颈组织活检确诊;无恶液质以及远处转移;患者与其家属均签署知情同意书[3]。排除标准:重度贫血患者;免疫缺陷疾病患者;出现严重并发症;无法配合进行本次研究患者;重度认知功能异常患者;精神异常或者意识模糊患者[4]。根据患者就诊顺序将其随机分为2组。参照组(n=32)患者年龄23~69周岁,平均(44.5±5.6)岁,2例腺鳞癌、3例腺癌、27例鳞癌,3例Ⅱb期、15例Ⅲa期、11例Ⅲb期、3例Ⅳa期。研究组(n=32)患者年龄21~72周岁,平均(45.3±5.9)岁,1例腺鳞癌、3例腺癌、28例鳞癌,2例Ⅱb期、17例Ⅲa期、11例Ⅲb期、2例Ⅳa期。两组一般资料对比差异无统计学意义(P>0.05)。
1.2 方法
参照组患者接受同步放化疗,应用全盆野常规分隔外照射放疗法,每次1.8 Gy,每日治疗1次,每周连续治疗5次。待照射量达到DT30.6 Gy后,为患者实施全盆野中央挡铅持续照射治疗,DT14.4 Gy,DT照射总量45 Gy。然后为患者实施常规妇科检查,若未取得理想的宫旁肿瘤消退效果则为其实施全盆野中央挡铅照射治疗,持续治疗3次,照射量以45~50.4 Gy为宜,待DT至27 Gy后为患者实施腔内照射治疗,每次7 Gy,每周照射治疗1次,共7次[5]。若患者体内肿瘤体积较大则为其实施照射放疗前实施阴道盒消瘤,每次10 Gy。持续照射治疗1周后为患者实施同步化学治疗,静脉滴注顺铂,滴注剂量以40 mg/m2为宜,持续6周。研究组患者接受同步热放化疗,同步放化疗方式同参照组患者,化疗当日即应用UHR-2000型微波热疗机为患者实施盆腹腔深部局部热疗,每次治疗60 min,每周治疗1次,共计治疗4周[6]。
1.3 观察项目
对比2组患者病灶缩小幅度,应用免疫组化法分别检测2组患者治疗中宫颈肿瘤组织C-myc以及VEGF蛋白表达情况,对比治疗中2组患者VEGF蛋白阳性表达强度分布情况以及C-myc蛋白阳性率表达情况。
1.4 疗效评价
PD:治疗后患者出现新病灶或者病灶体积较治疗前增长20%;SD:治疗后患者病灶体积有所增大,增大幅度不超过治疗前的20%,或者病灶较治疗前缩小,缩小幅度不足治疗前的30%;PR:治疗后患者病灶体积缩小幅度超过治疗前的30%且维持时间不短于4周;CR:治疗后患者病灶完全消失,治疗后4周内未见新病灶[7]。
1.5 统计学应用
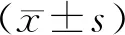
2 结果
2.1 对比2组患者临床治疗效果
研究组患者治疗总有效率为65.62%,参照组患者治疗总有效率为46.87%,对比2组患者临床疗效差异有统计学意义(P<0.05),见表1。
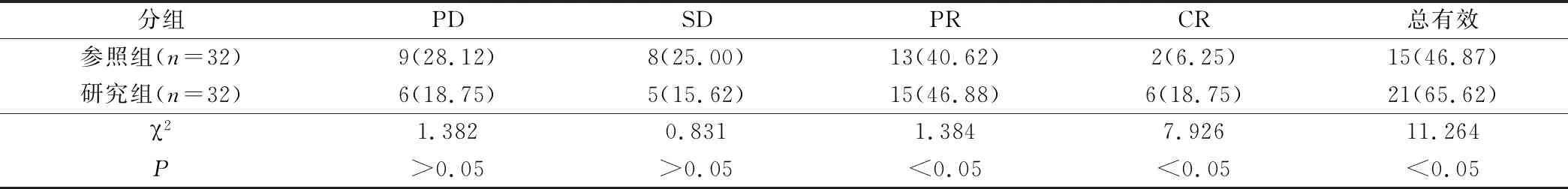
表1 对比2组患者临床治疗效果(例,%)
2.2 对比2组患者治疗中VEGF、C-myc蛋白阳性表达强度分布情况
治疗中研究组患者VEGF、C-myc蛋白阳性表达强度明显较参照组患者VEGF、C-myc蛋白阳性表达强度分布情况减弱,2组患者治疗中VEGF、C-myc蛋白阳性表达强度分布情况差异有统计学意义,见表2。

表2 对比2组患者治疗中VEGF、C-myc蛋白阳性表达强度分布情况
3 讨论
肿瘤热疗主要通过物理方法加热组织以取得杀灭肿瘤细胞的效果,既能够取得理想的肿瘤细胞破坏效果,同时还不会对患者正常组织造成损伤,属于临床常用恶性肿瘤治疗方法[8-10]。肿瘤血管及血流形态存在明显异常且存在较大的血流阻力,而且随着肿瘤面积不断加大,血管受到压迫,极易导致血管闭塞并形成血栓;肿瘤组织毛细血管壁主要包括外膜以及单层内皮细胞,受高压以及高热影响极易出现破裂现象,肿瘤毛细血管在常温下保持开放状态,温度升高后不会出现明显的血流增加现象,而且肿瘤血管缺乏健全的的神经感受器,对温度感受性不佳。为患者实施热疗时,肿瘤与周围正常组织均存在温度升高现象,正常组织血液循环良好,而且热量能够起到扩张正常组织血管的功效,可加快血液流动,而且由于散热充分,不会出现明显的温度升高现象。肿瘤组织血液流通速度明显下降,血管闭塞后存在较大的散热难度并积聚大量热量,肿瘤中心区域血流量明显减少,使得肿瘤组织与其周围正常组织存在一定的温差,可杀灭癌细胞并且不会对正常组织细胞构成损害[11-13]。
热疗能够直接杀灭肿瘤细胞,大部分细胞临界温度为42.5 ℃~43 ℃,少量细胞为44 ℃,临界温度会引发细胞坏死现象并可直接杀死细胞。细胞坏死主要包括细胞膜改变、细胞骨架损伤以及细胞核酸和蛋白改变等。热疗还能够产生细胞凋亡诱导效果,使线粒体得到激活,通过细胞受体途径诱导细胞凋亡,可使caspase上游作用以及TNF-α、TRAIL以及Fas-L下游作用得到明显增强,使细胞对死亡受体的敏感性得到增强而取得细胞凋亡诱导效果。热处理还可损伤细胞膜,细胞内Ca2+明显升高,可使蛋白激酶C、蛋白酶、核酸内切酶等得到激活从而起到细胞凋亡效果。热疗还能够使患者机体免疫功能得到提高,使体内肿瘤免疫抑制因子来源得到消除,对肿瘤组织可产生直接破坏作用并改变肿瘤以及宿主优势对比[14-15]。
同步热放化疗属于临床常用放射增敏措施,具有较高的临床应用安全性和有效性,在宫颈癌、前列腺癌、直肠癌以及食管癌等病症中有着广泛的应用,可诱导肿瘤细胞凋亡。化疗能够对放疗造成的细胞受损产生明显抑制,可在肿瘤细胞不同周期发挥作用,从而起到互补的治疗效果。
此次研究中,研究组患者治疗总有效率明显高于参照组,2组临床疗效差异有统计学意义(P<0.05)。治疗中研究组患者VEGF蛋白阳性表达强度明显较参照组患者VEGF蛋白阳性表达强度分布情况减弱,2组患者治疗中VEGF蛋白阳性表达强度分布情况差异有统计学意义(P<0.05)。治疗中研究组患者C-myc蛋白阳性表达强度明显较参照组患者VEGF蛋白阳性表达强度分布情况减弱,2组患者治疗中C-myc蛋白阳性表达强度分布情况差异有统计学意义(P<0.05)。综上所述,中晚期宫颈癌患者应用同步热放化疗,有助于降低肿瘤VEGF表达强度、抑制肿瘤血管形成,有效抑制肿瘤增殖及转移,此外,还能够减弱C-myc蛋白阳性表达强度。同步热放化疗还能够发挥协同增强作用,改善血管通透性,提高化疗药物摄取量并可使化疗敏感性得到提高,有助于提高临床疗效,减轻患者的生理与心理不适感。

