根据CYP2D6多态性应用大剂量托瑞米芬治疗转移性乳腺癌*
段海波, 胡倩, 林颖欣, 曹硕, 蓝晓珊, 庞丹梅
佛山市第一人民医院乳腺肿瘤内科(广东佛山 528000)
相比欧美国家,我国乳腺癌患者绝经前占比较高[1],他莫昔芬是绝经前乳腺癌基础用药之一。他莫昔芬对雌激素受体亲和力微弱,几乎不能发挥药理作用。他莫昔芬进入体内需经肝脏CYP2D6酶代谢方能成为活性成分吲哚昔芬,从而发挥抗雌激素作用[2]。CYP2D6基因具有高度单核苷酸多态性,其中东亚人种中最常见的是CYP2D6*10(100C>T,rs1065852)。CYP2D6酶单核苷酸突变后代谢活性明显减弱,血浆中吲哚昔芬的浓度显著降低[3]。托瑞米芬在体内无需经过肝脏CYP2D6酶转化,原药即可拮抗雌激素受体[4],因此,从生物转化角度分析,托瑞米芬能够绕过CYP2D6*10的功能缺陷。既往数据提示,他莫昔芬治疗失败的乳腺癌患者再给予大剂量的托瑞米芬,有效率可达30%~50%[5]。本试验对他莫昔芬进展的乳腺癌患者根据CYP2D6基因多态性进行个体化治疗,对于CYP2D6*10突变型患者,采用大剂量托瑞米芬挽救治疗,探讨托瑞米芬能否绕过CYP2D6*10代谢缺陷,试图为患者提供一种廉价和有效的挽救治疗方案。
1 资料与方法
1.1 一般资料 收集我院肿瘤中心和乳腺外科2015年1月至2017年3月治疗的晚期乳腺癌患者,按照入排标准纳入病例。入组标准:(1)年龄18~70岁;(2)复发转移性乳腺癌,病理证实为浸润性癌,ER(+)和(或)PR(+),辅助/晚期接受过芳香化酶抑制剂以及他莫昔芬治疗;(3)心脏左室射血分数(LVEF)≥50%,肝脏转氨酶及胆红素在正常上线2倍以内;(4)功能状态评分(performance status,PS) 0~1分; (5)自愿加入本试验,签署知情同意书,配合随访。排除标准:(1)不能控制的脑转移、脑膜转移或有脊髓压迫症状;(2)Ⅱ级以上缺血性心脏病;Ⅲ~Ⅳ级心功能不全,或LVEF<50%;控制不良的心律失常;(3)活动性肝炎;(4)活动性感染。
1.2 标本采集和DNA提取 托瑞米芬治疗前1周内抽静脉血3 mL,EDTA抗凝后以3 000 r/min离心10 min,然后应用苯酚-氯仿法提取DNA,DNA 的OD260/OD280值在1.60~1.80之间,浓度需>10 ng/μL。
1.3 CYP2D6 基因多态性检测 查询NCBI GenBank数据库,根据CYP2D6的DNA序列设计引物。CYP2D6*10 下游引物:5′-GAGACCCAGCCTCCTGATCCTGG-3′;CYP2D6*10 上游引物:5′-GAGCCCATTTGGTAGTGAGGCAGGT-3′(上海英骏公司合成)。PCR扩增体系制备如下:取3 μL DNA模板,10 μm CYP2D6*10上游引物和10 μm CYP2D6*10 下游引物分别1 μL,2倍 Taq PCR MasterMix(购自北京百泰克公司)10 μL,用水补足20 μL体系。应用ABI Veriti多区域控温热循环仪进行PCR扩增。按以下程序进行扩增:95℃ 5 min;95℃ 30 s→60℃ 30 s→72℃ 30 s(共循环40次);72℃ 5 min;4℃ ∞。PCR产物经虾碱酶纯化、BDT染色、酒精沉淀及甲酰胺变性后,采用ABI3130xl测序仪测序,依据峰图判断结果。
1.4 给药方案及疗效评价 口服120 mg托瑞米芬片,1次/d。依据 RECIST 1.1标准每8周进行1次疗效评价,疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD)。对于非进展(CR/PR/SD)的患者继续治疗直至毒性不可耐受或疾病进展。本试验主要研究终点为疾病控制率(disease control rate,DCR),DCR=CR+PR+SD。次要终点为总生存期(overall survival, OS)。
1.5 统计学方法 应用SPSS 23.0 统计软件进行统计分析。CYP2D6*10突变类型和病理临床特征之间的相关性采用2检验;用Kaplan-Meier 法估计生存概率。以P<0.05 为差异有统计学意义,均为双侧检验。
2 结果
2.1 CYP2D6*10突变类型与乳腺癌患者临床病理特征的相关性 41例受试者中CYP2D6 基因杂合突变型Wt/*10有26例(63.4%),纯合突变型*10/*10有15例(36.6%)。CYP2D6*10突变类型与年龄、病理类型、Ki-67表达高低、转移部位、转移灶多寡等均无显著相关性。见表1。
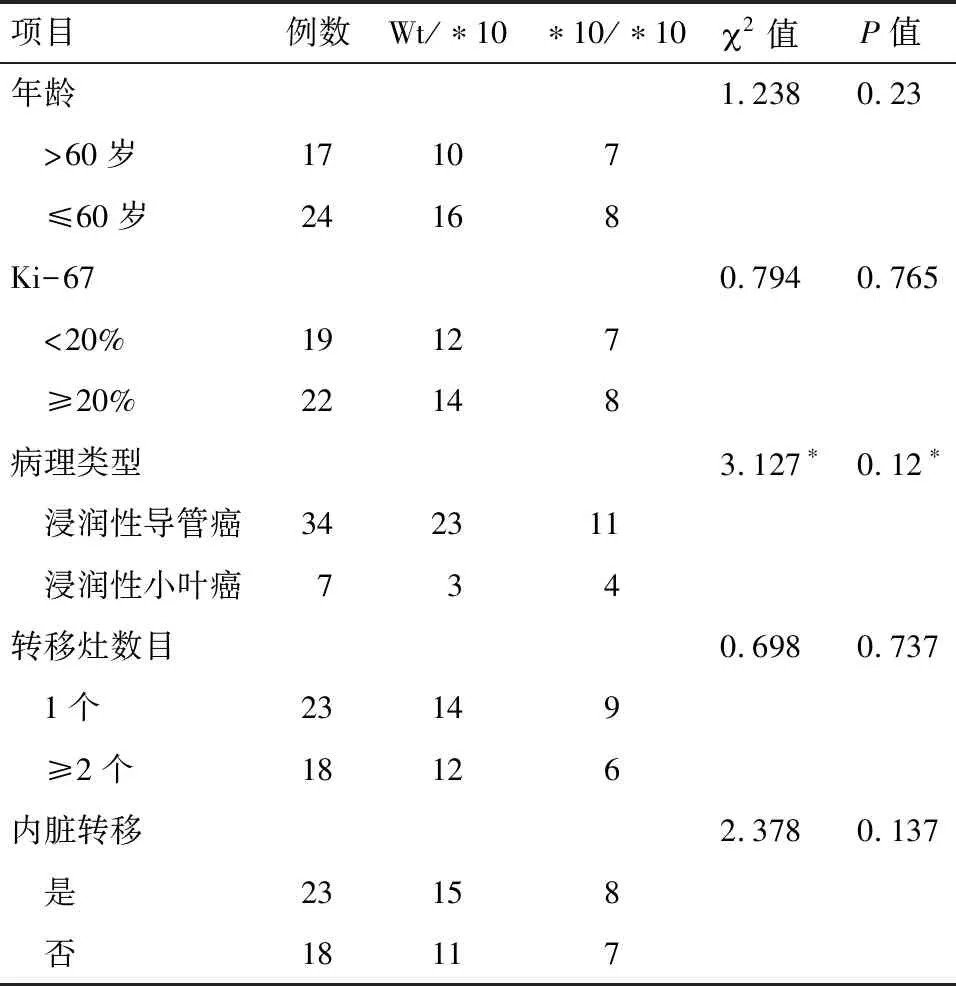
表1 乳腺癌CYP2D6突变类型和临床病理特征的相关性 例
注:*采用Fisher′s精确法
2.2 托瑞米芬治疗效果 41例乳腺癌患者,10例达到疾病控制(CR/PR/SD),总体DCR为24.4%。15例纯合突变*10/*10患者中,无CR病例,PR 为3例,SD为2例,DCR为33.3%,26例杂合突变Wt/*10患者中,CR和PR均为0例,SD 为5例,DCR为19.2%。见表2。

表2 CYP2D6 基因多态性与托瑞米芬治疗效果的关系 例
注:※采用Fisher′s精确法
2.3 后继治疗和总生存 托瑞米芬进展后,34例乳腺癌患者给予化疗,7例给予内分泌治疗(氟维司群3例,氟维司群+帕博西林4例)。截止2019年6月,中位随访时间43个月,*10/*10亚型患者和Wt/*10亚型患者各有1例失访。杂合突变患者和纯合突变患者的中位生存期分别为43.2个月和41.5个月,差异无统计学意义(P=0.327)。见图1。
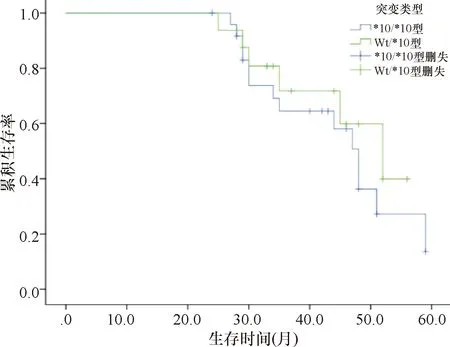
图1 CYP2D6 Wt/*10型患者和*10/*10型患者总生存
3 讨论
CYP2D6位于第22号染色体上(22q13.1),属于由单基因控制的P450酶,包括9个外显子和8个内含子。其单核苷酸变异形式复杂,在亚洲人群中最常见的变异形式为CYP2D6*10(100C>T, rs1065852)。根据突变形式,分为:纯合突变*10/*10,两个等位基因均为无功能型,对他莫昔芬的代谢明显降低;杂合突变Wt/*10,其中一个等位基因无功能型或两条等位基因均为功能减弱型,对他莫昔芬的代谢能力轻度降低;正常表型Wt/Wt,两条等位基因均为正常功能型,可以将他莫昔芬迅速代谢成活性成分吲哚昔芬[6]。东亚人种中CYP2D6纯合和杂合突变超过50%[7]。
托瑞米芬和他莫昔芬同属选择性雌激素受体调节剂,两者结构相似,但体内代谢过程明显不同。托瑞米芬经肝药酶CYP3A脱甲基生成N-去甲基托瑞米芬,托瑞米芬原药即具有强大的抗雌激素作用。因此,托瑞米芬的转化过程不受CYP2D6单核苷酸突变的影响。托瑞米芬的标准剂量是60 mg/d,临床前和临床研究均证实,托瑞米芬的急慢性毒性非常低,即使剂量递增至600 mg/d仍然是安全的[8]。大剂量托瑞米芬除了经典的抗雌激素效应外,还有阻滞细胞周期、诱导细胞凋亡和分泌生长因子等非雌激素依赖的抗肿瘤效应[9]。国外小样本Ⅱ期试验提示,他莫昔芬进展后再给予大剂量托瑞米芬解救治疗,DCR约为30%~50%。
本研究对他莫昔芬进展的患者,基于CYP2D6基因多态性进行个体化治疗。对于野生型患者,按临床常规给予后线治疗。对CYP2D6*10突变患者(包括纯合突变和杂合突变),给予大剂量托瑞米芬(120 mg/d)解救治疗。由于他莫昔芬和托瑞米芬生物转化过程不同,理论上讲托瑞米芬可以绕过CYP2D6*10代谢缺陷,试图为患者提供一种廉价而有效的解救治疗方案。
CYP2D6基因具有高度多态性,目前尚无高水平的证据提示CYP2D6基因突变形式和频率与常见临床病理特征相关[10]。检测本组41例样本的CYP2D6基因多态性,并未发现CYP2D6单核苷酸多态性与病理类型、年龄、Ki-67表达高低、是否内脏转移及转移灶多寡有确切的相关性,提示CYP2D6单核苷酸突变独立发生,具有一定的随机性。
东西方人群CYP2D6突变频率不同,突变结局也不同。相比于西方人群,亚洲人群中CYP2D6突变频率显著增高,但杂合突变Wt/*10患者,CYP2D6酶对他莫昔芬的代谢能力下降并不显著,只用纯合突变,代谢能力才会显著下降[11]。杨帏等[12]检测了133例患者CYP2D6表型,同时检测了88例患者他莫昔芬活性代谢产物吲哚昔芬的浓度,发现各表型之间吲哚昔芬以及他莫昔芬/吲哚昔芬比值差异非常大,作者提出杂合突变Wt/*10在中国人群占比太高,吲哚昔芬的浓度差异很大,西方人群的CYP2D6表型划分可能不适合中国人群。本试验杂合突变Wt/*10组大剂量托瑞米芬疾病控制率仅为19.2%,而纯合突变*10/*10组可高达33.3%,但由于样本量较小,统计学差异不显著。需要注意的是,3例PR病例均来自纯合突变组,而杂合突变组无一例获得PR。本试验结果也从侧面印证了CYP2D6酶杂合突变和纯合突变代谢能力的不同。对于纯合突变的患者,既往他莫昔芬治疗期间,CYP2D6酶代谢能力明显减弱,血浆中活性成分吲哚昔芬浓度低,相当于接受了“无效”治疗,所以后继用大剂量托瑞米芬挽救治疗,尚有一定的疗效。而杂合突变患者,由于CYP2D6酶对他莫昔芬的转化能力大致正常,他莫昔芬进展后继续应用同属选择性雌激素受体调节剂的托瑞米芬挽救治疗,效果往往不佳。
基于高加索人群的一些较小样本的研究提示CYP2D6突变(包含但不限于CYP2D6*10)的患者,术后接受他莫昔芬辅助治疗,无病生存期明显缩短[13]。然而,其后的多项随机对照试验的回顾性分析并未发现术后接受他莫昔芬治疗的患者生存受到CYP2D6多态性的影响[14]。中国人群研究提示,乳腺癌术后接受他莫昔芬辅助治疗,其生存与CYP2D6多态性并无显著的相关性[15]。对于晚期患者,CYP2D6单核苷酸多态性仅仅可能影响他莫昔芬治疗阶段的生存,本试验后线治疗不再使用选择性雌激素受体调节剂类药物,且晚期乳腺癌生存期相对较长,影响因素混杂,因此,本研究中杂合突变和纯合突变的患者OS无差别。
综上所述,CYP2D6*10突变的患者在他莫昔芬进展后应用大剂量托瑞米芬解救效果不甚理想。但对于CYP2D6纯合突变的患者,大剂量托瑞米芬可能有潜在的获益,值得进一步的研究。

