基线18F-FDG PET/CT 在转移性恶性黑色素瘤患者预后评估中的价值
来瑞鹤 蒋冲 滕月 孙一文 李爱 梅
南京大学医学院附属鼓楼医院核医学科 210008
恶性黑色素瘤(malignant melanoma,MM)是一种少见的、恶性程度极高的肿瘤,其发病率仅占皮肤恶性肿瘤的3%,但病死率却高达65%[1]。MM 在西方人群中发病率较高,在中国、韩国、日本等亚洲国家较少见,但近40 年来,亚洲人的发病率也呈稳定增长趋势[2]。约1/3 的患者会出现局部复发或转移的风险[3],美国癌症联合委员会(AJCC)黑色素瘤分期数据库的统计结果显示,Ⅳ期患者的5 年生存率仅为15%~20%[4]。因此,早期预测疾病的转归并采取积极有效的治疗迫在眉睫。
全身18F-FDG PET/CT 是评估肿瘤葡萄糖代谢和增殖最常用的功能成像方法。转移性MM 可能累及身体任何远离原发病变的器官,因此局部成像不能对疾病进行全方位地评估。已有研究结果证实,18F-FDG PET/CT 在检测黑色素瘤局部复发和隐匿性远处转移、预后和对治疗的影响等方面的诊断准确率均优于CT[5-7]。
SUV 已成为评估患者葡萄糖代谢水平的常用指标。大多数肿瘤的18F-FDG PET/CT 研究都使用SUVmax单一指标评估肿瘤的代谢情况[8-9]。然而,SUVmax仅代表肿瘤最活跃的部分,不能反映肿瘤的整体代谢情况。Biehl 等[10]和Larson 等[11]已提出采用肿瘤代谢体积(metabolic tumour volume,MTV)和病灶糖酵解总量(total lesion glycolysis,TLG)克服SUVmax的局限性。目前,全身MTV 和全身TLG 对转移性MM 患者预后的研究报道较少。本研究旨在评估基线18F-FDG PET/CT 的代谢参数在预测转移性MM 患者预后中的价值。
1 资料与方法
1.1 一般资料
收集2011 年8 月至2018 年12 月经南京大学医学院附属鼓楼医院病理确诊的47 例转移性MM 患者的临床资料,其中男性20 例、女性27例,中位年龄59(23~86)岁。对所有患者的临床数据,包括性别、年龄、血清乳酸脱氢酶(lactate dehydrogenase,LDH)水平、原发灶部位、转移灶部位、淋巴结转移情况、美国癌症联合委员会(AJCC)第8 版[4]TNM 分期及M 分期和治疗方式等进行回顾性研究。纳入标准:经病理确诊的MM患者。排除标准:(1)治疗后失访;(2)临床资料不全;(3)无可测量病灶;(4)未进行任何治疗。
1.2 治疗方法
对所有患者行化疗、免疫或靶向治疗。单纯化疗者15 例,化疗方案为安罗替尼+替莫唑胺+顺铂或替莫唑胺+顺铂;单纯免疫治疗者13 例,其中大剂量干扰素治疗12 例、帕博利珠单抗治疗1 例;单纯靶向治疗者1 例,治疗方案为达拉非尼口服治疗;联合治疗者18 例,治疗方案为化疗+靶向或免疫治疗。在随访期间,通过影像学检查判断疾病是否进展,并对可疑病变进行活检。
1.3 随访
随访时间为0.5~53.6 个月,中位随访时间为15 个月。随访期间,17 例患者病死,其中2 例(11.8%)患者在随访开始6 个月内病死(1 例0.5 个月后病死,另1 例0.7 个月后病死);其他患者的随访时间均超过6 个月。选择黑色素瘤特异性生存期(melanoma-specific survival,MSS)和无进展生存期(progression-free survival,PFS)作为随访的终点。患者的随访期定义为从18F-FDG PET/CT 成像到最后1 次临床回顾的时间;MSS 定义为从18F-FDG PET/CT 成像到病死的时间;PFS 定义为从18F-FDG PET/CT 成像到疾病进展或病死的时间。
1.4 PET/CT 检查
所有患者检查前均禁食6 h 以上,注射药物前空腹血糖≤10.0 mmol/L,按5.18×106Bq/kg 静脉注射18F-FDG(江原安迪科公司生产,放射化学纯度>95%)。1 h 后开始采集全身图像,扫描仪为荷兰Philips 公司生产的 GEMINI GXL PET/CT 仪。先行CT 定位扫描,扫描参数:管电压120 kV、管电流120 mA、层厚5.0 mm、间隔5.0 mm。然后行PET扫描,采用三维采集模式,脑部扫描范围自颅顶至下颌骨平面,采集时间为4 min/床位;身体扫描范围自颅底至股骨中下段,共8~9 个床位(双上肢立正姿势放置于大腿两侧或平行抱于胸前),双下肢扫描范围自股骨中下段至足底,共7~8 个床位,采集时间为1.2 min/床位。应用CT 数据进行衰减校正,迭代法重建最终获得横断面、矢状面、冠状面的CT、PET 及PET/CT 融合图像。所有患者均于检查前签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
1.5 图像分析
PET/CT 图像由2 位有PET/CT 诊断经验的主治及以上职称的核医学医师独立阅片,意见不一致时协商取得一致。在MEDEX 工作站对病灶进行勾画,以SUV>40% SUVmax的体素边界作为临界值[12],勾画出每个病灶的MTV,每个病灶的MTV之和为全身MTV。TLG 为ROI 内的平均标准化摄取值(SUVmean)与MTV 的乘积,勾画后由系统自动得出结果,每个病灶的TLG 之和为全身TLG。利用ROC 曲线进行分析,计算SUVmax、全身MTV、全身TLG 的最佳临界值。
1.6 分组
在MSS 和PFS 生存分析中分别以SUVmax、全身MTV 和全身TLG 的最佳临界值为界,将患者分为6 组:SUVmax≤临界值组和>临界值组、全身MTV≤临界值组和>临界值组、全身TLG≤临界值组和>临界值组。
1.7 统计学方法
采用SPSS 20.0 软件对数据进行统计学分析。定性资料采用率表示。采用Kaplan-Meier 法及Log-rank 检验预测2 组间MSS 和PFS 的差异。采用单因素分析法评估PET 参数和临床变量的预后意义。采用Cox 比例风险模型分析PET 参数是否为MSS 和PFS 的独立预后危险因素。P<0.05 为差异有统计学意义。
2 结果
2.1 临床特征
47 例MM 患者中,13 例(27.7%)的血清LDH水平≥245 U/L(正常范围109~245 U/L);39 例(83.0%)的肿瘤原发部位为四肢,7 例(14.9%)的肿瘤原发部位非四肢,1 例(2.1%)的肿瘤原发部位不明;40 例(85.1%)伴有淋巴结转移。M 分期结果:M0期20 例(42.6%)、M1 期27 例(57.4%)(M1a 期12 例、M1c 期13 例、M1d 期2 例)。TNM 分期结果:Ⅲ期20 例(42.6%)、Ⅳ期27 例(57.4%)。随访结果:22 例(46.8%)病情进展、17 例(36.2%)病死。
2.2 生存分析
ROC 曲线分析结果:SUVmax、全身MTV和全身TLG 的最佳临界值分别为10.86、8.12 cm3和91.45(图1)。高于临界值的SUVmax、全身MTV和全身TLG 的患者疾病进展率和病死率均上升,分别为92%、90%、94%和69%、47%、56%。7 例病死患者的SUVmax、全身MTV 和全身TLG 均高于临界值。
根据ROC 曲线获得的PET 参数的最佳临界值将患者重新分组,分别生成Kaplan-Meier 生存曲线。由图2 可见,通过Log-rank 检验,全身MTV和全身TLG 以最佳临界值为界的2 组患者PFS 的差异均有统计学意义(χ2=5.04、5.02,均P<0.05);SUVmax和全身TLG 以最佳临界值为界的2 组患者MSS 的差异均有统计学意义(χ2=10.22、4.38,均P<0.05)。由表1 可知,SUVmax>10.86、全身MTV>8.12 cm3、全身TLG>91.45 组患者的中位生存时间、1 年和2 年生存率均低于SUVmax≤10.86、全身MTV≤8.12 cm3、全身TLG≤91.45 组。
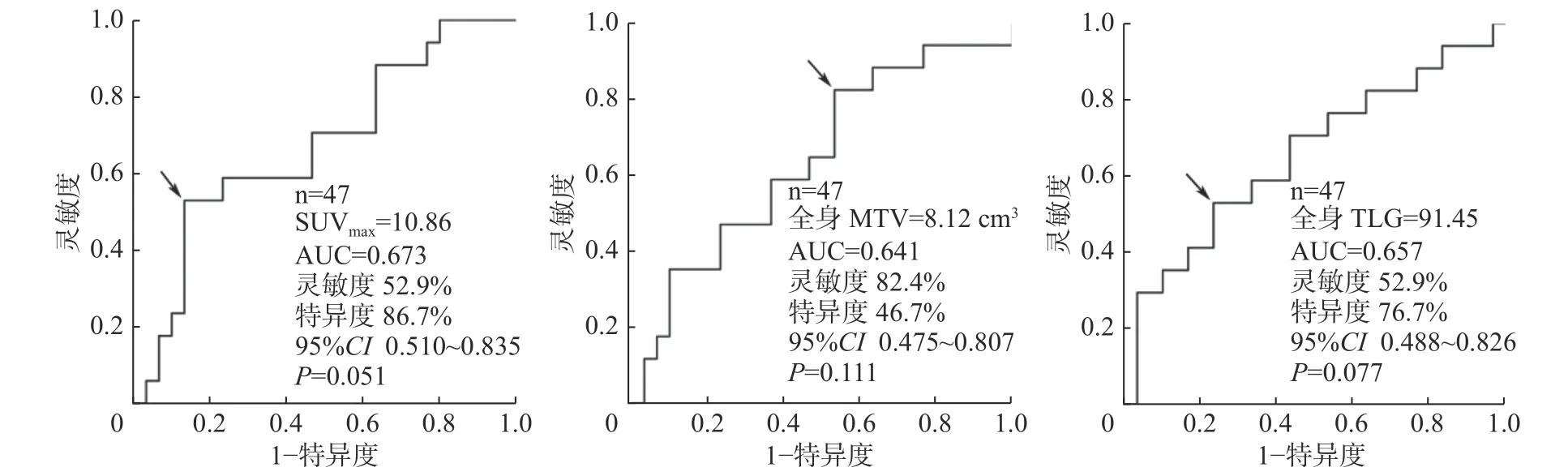
图 1 预测转移性恶性黑色素瘤PET/CT 参数最佳临界值的ROC 曲线 图中,箭头所示为最佳临界值。PET:正电子发射断层显像术;CT:计算机体层摄影术;ROC:受试者工作特征;SUVmax:最大标准化摄取值;AUC:曲线下面积;CI:可变区间;MTV:肿瘤代谢体积;TLG:病灶糖酵解总量Fig. 1 Receiver operating characteristic curve analysis showed the PET parameters optimal threshold of metastatic malignant melanoma
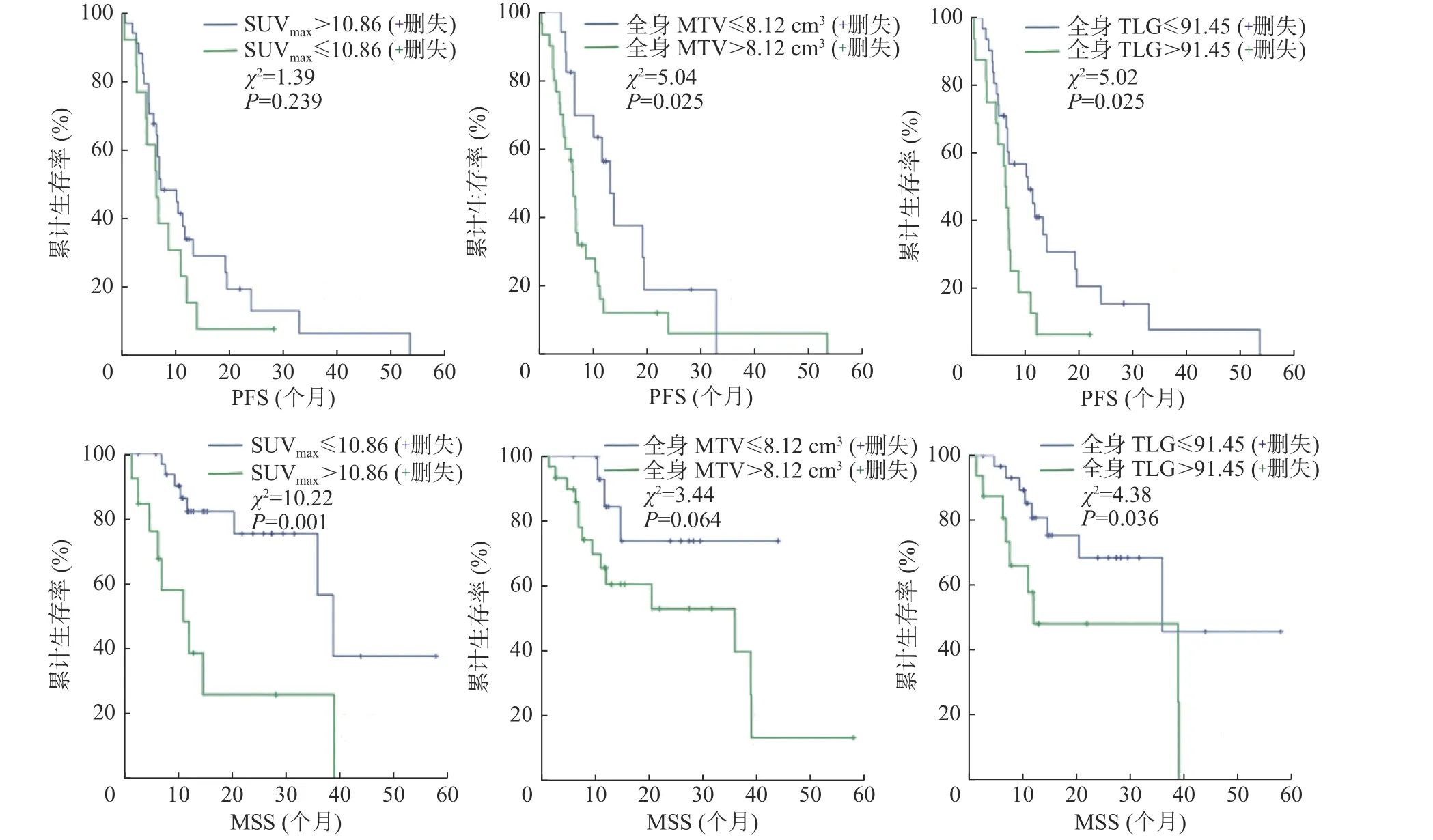
图 2 47 例转移性恶性黑色素瘤患者PFS、MSS 的Kaplan-Meier 生存曲线 图中,PFS:无进展生存期;MSS:黑色素瘤特异性生存期;SUVmax:最大标准化摄取值;MTV:肿瘤代谢体积;TLG:病灶糖酵解总量Fig. 2 Kaplan-Meier survival curves of progression-free survival and melanoma-specific survival in 47 patients with metastatic malignant melanoma

表 1 18F-FDG PET/CT 参数临界值评估47 例转移性恶性黑色素瘤患者的生存时间和生存率Table 1 Survival time and survival rate evaluated by 18F-FDG PET/CT parameter threshold in 47 patients with metastatic malignant melanoma
应用临床变量(性别、年龄、LDH 水平、原发灶部位、转移灶部位、淋巴结转移、M 分期、TNM 分期、治疗方式)和PET 参数对PFS 和MSS 进行单因素分析,由表2 可知,MSS 的预后危险因素包括LDH≥245 U/L、淋巴结转移、SUVmax>10.86 和全身TLG>91.45;PFS 的预后危险因素包括M1 期、全身MTV>8.12 cm3和全身TLG>91.45。
将单因素分析有意义的变量进行多因素Cox比例风险模型分析,评估转移性MM 的独立预后危险因素,由表3 可知,MSS 的独立预后危险因素是SUVmax>10.86(危险比 4.11,95%CI:1.40~11.78,P=0.008)。
3 讨论
黑色素瘤是起源于皮肤黏膜及色素膜黑色素细胞的恶性肿瘤。目前,18F-FDG PET/CT 在MM 中主要用于疾病的诊断、分期和疗效评价[13-14],对于疾病预后评估的研究较少,且研究方向也局限在原发灶或局部病变[15-16]。由于MM 具有侵袭程度高、极易转移和复发的特点,因此,对MM 的预后及远期生存的准确评估迫在眉睫。在本研究中,我们应用基线PET 参数对MM 的预后进行评估。
本研究中,临床变量(性别、年龄、LDH 水平、原发灶部位、转移灶部位、淋巴结转移、M分期、TNM 分期、治疗方式)的单因素分析表明,LDH 水平、淋巴结转移是MSS 的预后因素,M1分期是PFS 的预后因素。Agarwala 等[17]对1085 名受试者的大型前瞻性研究结果表明,LDH 是转移性MM 的临床预后因素,与我们的研究结果一致。2017 年美国癌症联合委员会(AJCC)第8 版[4]的MM 分期显示,M 分期和LDH 水平是MM 的预后危险因素,并将LDH 水平升高视为M1a(1)期。
本研究结果表明,SUVmax>10.86 的MM 患者的不良预后及相关病死的风险更高。在临床诊疗中,SUVmax代表肿瘤侵袭性的程度,SUVmax升高与肿瘤细胞的增殖有关。本研究的单因素分析结果表明,SUVmax是转移性MM 患者MSS 的独立预后危险因素,但不是PFS 的独立预后危险因素。Son 等[16]的研究结果表明,SUVmax是原发性MM特异性生存期的预测因子,但调整了溃疡这个因素后,SUVmax不再能预测MM 的总生存期。Schmitt等[18]研究了24 例接受抗鼠科肉瘤病毒癌基因同源物B1(BRAF)抑制剂和丝裂原活化蛋白激酶的激酶(MEK)1 抑制剂靶向治疗的MM 患者,结果发现,SUVmax能够很好地预测PFS,但并不能预测总生存期,这与我们的研究结果不一致,分析其原因,可能与Schmitt 等[18]的研究病例数较少(24例),随访时间较短(最长随访时间600 d)有关。
本研究PET 参数的单因素分析结果显示,全身MTV 和全身TLG 能够反映疾病的复发和进展,虽然多因素分析结果提示全身MTV 和全身TLG不是评估MM 预后的最佳预测因素,但其仍是评估MM 预后的重要预后因素,全身MTV 和全身TLG越高,MM 患者疾病进展或病死的概率越大,这与Son 等[16]的研究结果相似,其团队发现全身MTV和全身TLG 是原发性MM 特异性生存期的重要预测因子。Seban 等[12]的一项关于抗程序性死亡受体1(PD-1)免疫治疗PET 参数对MM预后的研究结果表明,全身MTV 和全身TLG 是不良预后的最佳预测因素,这与本研究结果不完全一致,分析其原因:(1)Seban 等[12]的研究中入组患者的治疗方法为一致的抗程序性死亡受体1(PD-1)免疫治疗,而本研究的治疗方式有多种,到目前为止,不同的治疗方式是否影响全身MTV 和全身TLG 对预后的评估尚不明确,需要进一步的研究;(2)本研究的分组方式也可能是影响因素之一,Seban等[12]是以每个参数的中位数作为临界值,对其进行再次分组,而本研究是通过ROC 曲线选择参数的临界值进行分组,PET 参数临界值的不同会引起分组差异,其对预测效能的影响有待进一步研究;(3)由于本研究是通过MEDEX 工作站进行MTV、TLG 代谢参数的测量,其准确性可能较国际认可软件有一定差距,这有待进一步验证。
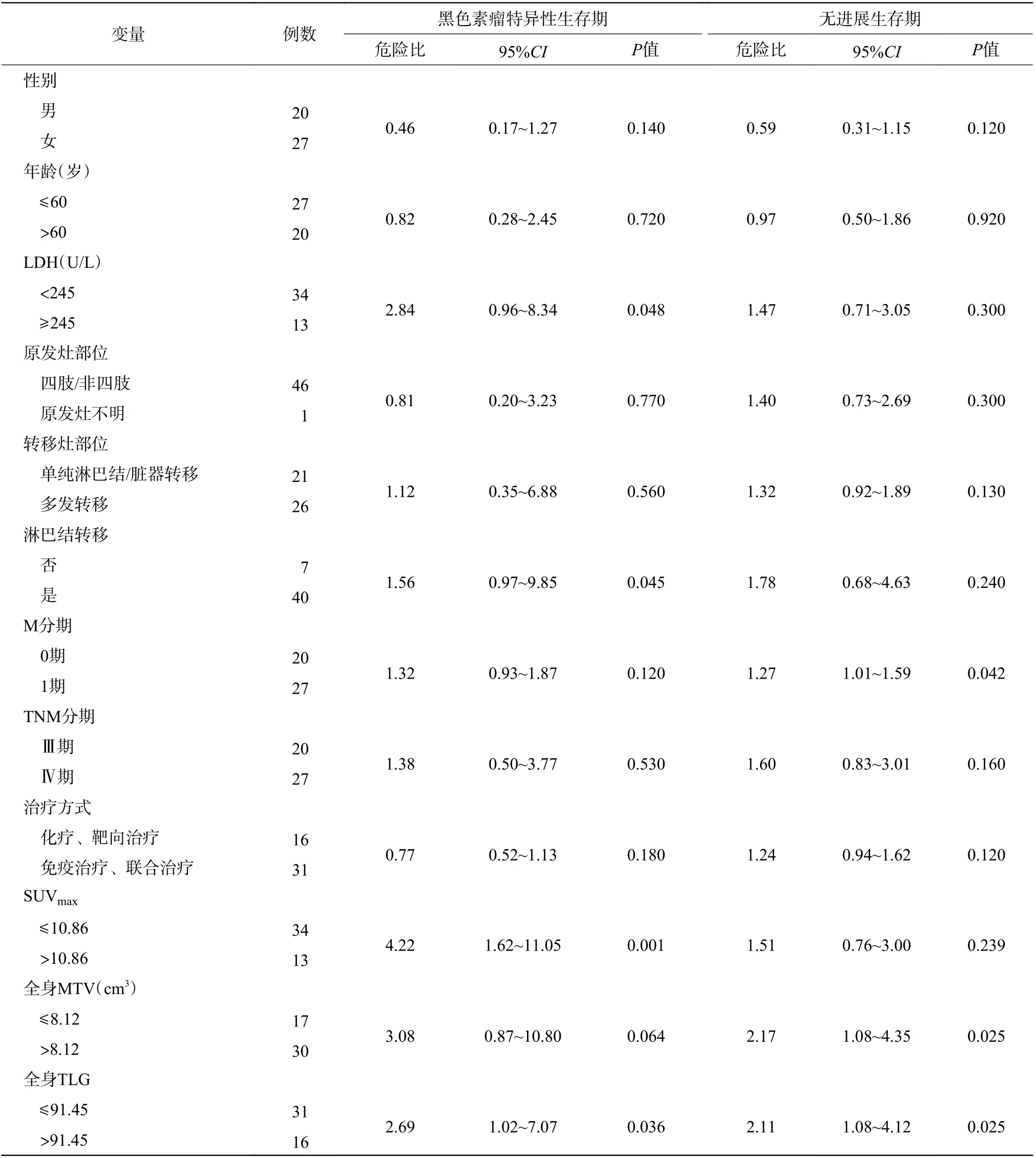
表 2 47 例转移性恶性黑色素瘤患者预后危险因素的单因素分析Table 2 Univariate analysis of prognostic risk factors in 47 patients with metastatic malignant melanoma
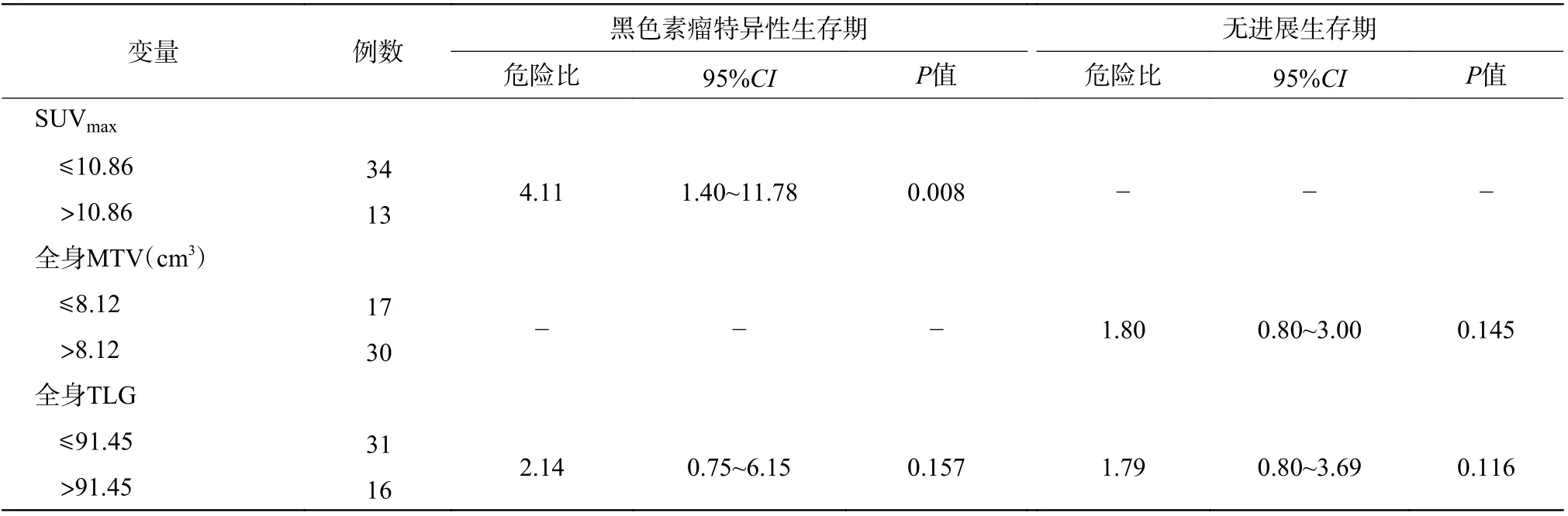
表 3 47 例转移性恶性黑色素瘤患者预后危险因素的多因素分析Table 3 Multivariate analysis of prognostic risk factors in 47 patients with metastatic malignant melanoma
本研究仍有一些局限性。本研究是单中心试验研究,患者数相对较少而且是回顾性的。因此,仍然需要进行前瞻性、大规模、多中心的研究。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明来瑞鹤负责数据的获取与分析、论文的撰写;蒋冲负责研究过程的实施、数据的分析;滕月负责数据的采集与统计分析;孙一文负责论文的审阅与修订;李爱梅负责研究命题的提出、论文的修订。

