SENPs 调控肿瘤放射敏感性的机制及其抑制剂的研究进展
罗 娜 勾文峰 吴红英 李祎亮
中国医学科学院北京协和医学院放射医学研究所,天津市放射医学与分子核医学重点实验室 300192
放疗作为治疗肿瘤最主要的方法之一,目前已能实现精准定位的高剂量辐射传送,但是放疗后的肿瘤患者仍有很大概率复发。肿瘤细胞自身产生的放射抵抗性是导致放疗失败的主要原因,因此,如何提高肿瘤细胞的放射敏感性成为当下的研究热点。小类泛素修饰因子(small ubiquitin-like modifier,SUMO)特异性蛋白酶(SUMO specific proteases,SENPs)的本质是肽酶,能水解SUMO 羧基端甘氨酸残基与靶蛋白赖氨酸残基之间形成的异肽键,还具有加工SUMO 前体蛋白的功能。近年来,关于SENPs参与调控肿瘤放射敏感性的研究越来越多,我们总结了SENPs 调控肿瘤放射敏感性的机制及其抑制剂的研究进展,旨在为后续开发SENPs 抑制剂作为放射增敏药物奠定理论基础。
1 SENPs 与小类泛素化修饰(称为SUMOylation)
翻译后修饰是一种可逆性的修饰过程,能够使被修饰的蛋白质发生构象和功能上的改变,对信号转导和生理稳态具有重要意义。经典的翻译后修饰主要包括磷酸化、乙酰化和泛素化,SUMOylation(SUMO 共价结合到底物上的过程)[1]是近年来发现的另一种重要的蛋白翻译后修饰类型。
SUMO 与泛素蛋白有18%的同源性[2],两者结构相似但是功能有所不同,泛素化通常会导致底物被蛋白酶体降解,而SUMOylation则是通过影响底物的活性、稳定性、蛋白-蛋白相互作用和核易位等间接发挥其生理功能[3]。在人体中已发现5 种SUMO,包括SUMO1~5,其中SUMO1~3 广泛存在于各种组织中,然而,SUMO4 和SUMO5 有组织特异性,SUMO4 主要位于肾脏、淋巴结和脾脏中[4],SUMO5 目前仅在睾丸和血细胞中被发现[5]。另外,SUMO2 和SUMO3 具有95%以上的同源性,可以在底物蛋白上形成多聚链状SUMO2/3 修饰标签,这些多聚链状SUMO2/3 修饰标签是一种募集泛素连接酶E3 的信号,可导致底物蛋白被修饰蛋白的泛素化和降解;而SUMO1 与SUMO2/3仅有不足50%的序列同源,通常只形成单个SUMO1修饰或聚链状SUMO2/3 修饰标签的末端修饰[6]。
SUMO 是蛋白质的修饰因子,其前体蛋白需要经过加工水解掉羧基末端的蛋白暴露出二甘氨酸序列之后才能修饰底物,这个过程由SENPs 催化完成。成熟的SUMO 再经由SUMO 激活酶E1、结合酶E2 和连接酶E3 的级联催化共价结合到底物上。SENPs 是半胱氨酸蛋白酶家族的成员,它还能催化SUMO 与底物之间的异肽键断裂导致其与底物分离,这个过程被称为去SUMOylation(deSUMOylation)。目前研究者在哺乳动物中发现了7 种SENP 肽酶,包括SENP1、SENP2、SENP3、SENP5、SENP6、SENP7 和SENP8,它们在细胞中的定位不同,而且对蛋白的亲和性也不同。SENP1和SENP2 可以在细胞核和细胞质之间穿梭,对SUMO1、SUMO2 和SUMO3 均有较高的亲和性;SENP3 和SENP5 主要位于核仁;而SENP6 和SENP7位于核质。SENP5、SENP6 和SENP7 对SUMO2 和SUMO3 的亲和性高于SUMO1。目前有研究结果发现,在所有的SENPs 中,只有SENP1、SENP2 和SENP5 具有催化SUMO 前体成熟的作用,而SENP8 比较特殊,它的底物是泛素样蛋白NEDD8而不是SUMO[7]。
2 SENPs 与肿瘤放射敏感性
近年来,关于SENPs 参与调控肿瘤放射敏感性的相关研究越来越多。Eschrich 等[8]利用数据库对48 种肿瘤细胞系的数据进行拟合,建立了一个放射敏感性的信号网络模型,研究结果表明SUMO是其中的关键枢纽,这提示SUMOylation 循环可能与肿瘤放射敏感性密切相关。Wang 等[9]用小干扰RNA 沉默肺癌细胞的SENP1,显著增强了照射引起的细胞周期阻滞和细胞凋亡。Yang 等[10]的研究结果发现,在肺癌细胞中上调微小RNA-138 能抑制SENP1 的表达,进而产生放射增敏的效果。Qian 等[11]的研究结果发现,肝癌细胞沉默SENP6以后,其增殖能力下降,而放射敏感性增强。上述证据均表明,SENPs 在肿瘤放疗抵抗的过程中发挥着重要作用,是潜在的放射增敏靶点。
3 SENPs 与肿瘤放射敏感性的作用机制
3.1 SENPs 与DNA 损伤修复
放疗通过直接或间接地损伤肿瘤细胞的DNA从而达到抑制其复制、诱导肿瘤细胞凋亡或坏死的目的,但是肿瘤细胞本身存在着DNA 损伤修复机制,放射诱导的DNA 损伤修复机制是肿瘤细胞产生放射抵抗的主要原因之一。在DNA 损伤修复的过程中,有许多蛋白通过发生SUMOylation 而改变自身的活性或功能。比如参与DNA 双链修复的Rad52 发生SUMOylation 能改变自身构象从而抑制其与DNA 的结合和退火,影响DNA 修复的效率[12];此外,复制蛋白A70 的SUMOylation 在同源重组介导的DNA 双链断裂修复中必不可少,其SUMOylation 有助于Rad51 募集到DNA 的损伤位点,以启动DNA 损伤修复[13];胸腺嘧啶DNA 糖基化酶(TDG)是碱基切除修复过程中的关键酶,它通过转移胸腺嘧啶和尿嘧啶来启动错配的G/T和G/U 修复,研究结果表明SUMOylation 可以调控TDG 的释放[14]。
总体来看,SUMOylation 的发生对DNA 损伤修复有促进作用[15],由于SENPs 可对SUMO 进行修饰从而改变其表型或者影响SUMO 从结合的底物上游离出来,所以SENPs 的功能失调也会阻碍DNA损伤的修复作用。研究结果发现,敲除除了SENP3以外的任意SENP,对同源重组修复和非同源末端连接都会产生不同程度的影响。比如SENP6 的缺失会大大增加SUMO2/3 修饰标签的比重,并增加早幼粒细胞白血病蛋白核体的SUMOylation,这表明其具有编辑SUMO2/3 修饰标签的功能[16];沉默SENP6 阻碍DNA 损伤修复的效应,可以通过加入外源的SUMO 蛋白而恢复,这又提示SENP6 在DNA 损伤修复的过程中能增加SUMO 的表达从而发挥作用;然而,沉默SENP7 对同源重组修复的影响却不能通过加入外源的SUMO 恢复,但SENP7能通过调控KRAB 相关蛋白1 发挥促进染色质松弛的作用,这也有利于DNA 损伤修复的进行[17]。Jin等[18]的研究结果发现,SENP5 对共济失调毛细血管扩张突变基因rad3 相关(ataxia telangiectasia and rad3-related,ATR)激酶的deSUMOylation 作用在ATR 信号通路应答DNA损伤修复中扮演着重要角色,突变ATR 相互作用蛋白的SUMOylation 位点会抑制ATR 信号通路的激活,SENP5 缺失的细胞DNA 损伤修复作用减弱。
3.2 SENPs 与细胞周期
细胞周期检查点是细胞周期中的一种保证DNA 复制和染色体分配质量的负反馈检查机制,研究结果表明,细胞在G0/G1 期及S 期对辐射的敏感性较低,而在G2/M 期对辐射的敏感性较高[19]。据报道,SENPs 家族的一些成员有调控细胞周期进程的功能,比如,研究结果发现,酵母中SENPs的同源物Ubl 特异性蛋白酶1 是参与细胞周期调控的重要因子[20]。Kuo 等[21]的研究结果发现,SENP3通过对核磷蛋白等细胞周期蛋白的deSUMOylation作用抑制了原癌基因的产生。Klein 等[22]的实验结果表明,SENP3 和结合酶E2 RanBP2 在有丝分裂过程中参与染色体的排列和纺锤体的形成。Wei等[23]的研究结果发现,SENP3 的磷酸化抑制其对拓扑异构酶Ⅱ等蛋白的deSUMOylation 活性,导致细胞周期阻滞,同时也降低了染色体的稳定性。Di Bacco 等[24]的研究结果发现,敲降SENP5 会导致细胞核形态缺陷,阻碍细胞增殖。Wang 等[9]用小干扰RNA 沉默人肺癌细胞A549 中的SENP1,使细胞发生了G0/G1 期阻滞。Xu 等[25]在人结直肠腺癌细胞DLD1 中敲降SENP1,使周期蛋白依赖性激酶抑制因子p16、p19、p21 和p27 的表达增加,这些抑制因子进一步促使细胞发生G1 期阻滞。这些证据均表明,SENPs 参与肿瘤细胞的放射敏感性调控可能与其改变细胞周期的分布有关。
3.3 SENPs 与乏氧诱导因子(hypoxia induced factor,HIF)1 蛋白
细胞对辐射的敏感性与其氧含量密切相关,乏氧条件下培养的细胞与常氧条件下培养的细胞相比放射抵抗性提高了3 倍。乏氧诱导因子HIF 是促进肿瘤在乏氧微环境下维持自身生长、代谢、浸润和转移的关键转录因子[26],其诱导细胞产生放射抵抗性已有多篇文献报道,研究结果表明,HIF1 可通过促进细胞增殖[27]、增强细胞干性[28]以及提高细胞对活性氧的耐受力等多种途径减弱肿瘤的放射敏感性[29]。
乏氧条件下SENP1 是HIF1 表达的关键调控分子。Cheng 等[30]的研究结果表明,SENP1 通过deSUMOylation 作用稳定HIF1α 的表达,敲除小鼠的SENP1 基因使HIF1 下游基因的表达减少。Ao等[31]的研究结果发现,SENP1 通过上调HIF1α 使卵巢癌细胞对顺铂产生耐药性。Wang 等[32]的研究结果发现,SENP1 和HIF1α 之间的正反馈循环有利于骨肉瘤细胞在乏氧状态下的增殖、侵袭和转化。Cui 等[33]的研究结果表明,HIF1α 高表达将增强肝癌细胞的细胞干性及其迁移能力,SENP1 与HIF1α 之间形成正反馈循环,抑制SENP1 能有效减弱肝癌细胞的细胞干性。这些研究结果为SENP1调控肿瘤细胞的放射敏感性提供了有力的理论依据。
4 SENPs 抑制剂的研究进展
综上所述,SENPs 作为放射增敏的新靶点,其抑制剂经过改良和优化后可作为新型放射增敏药物。目前SENPs 抑制剂,尤其是SENP1 抑制剂,已经有一部分正处于临床研究阶段。根据结构特征和发现来源可以把SENP 的抑制剂分为如下几类:短发卡RNA(short hairpin RNA,shRNA)类、肽类和拟肽类、合成小分子类、虚拟筛选类及天然产物来源类。
4.1 shRNA
shRNA 中含有两个短反向重复序列,通过中间茎环序列分隔,组成发卡结构。王立生等[34]设计并制备了靶向SENP1 mRNA 的shRNA,该shRNA( 5 ′-CCGGGCGCCAGAUUGAAGAACAGAACUC GAGUUCUGUUCUUCAAUCUGGCGCUUUUU-3′)能够从转录水平上抑制SENP1 的表达。
4.2 肽类和拟肽类
对SUMO 结构进行模拟构建得到的拟肽分子能与SUMO 竞争性地结合SENPs,这种肽类和拟肽类抑制剂是研究最早的抑制剂类型。Hemelaar等[35]将乙烯基砜引入SUMO1 蛋白的羧基末端,得到修饰后的SUMO1 蛋白(表1 中序号1),SENP2(靶点为cSENP2)催化中心的半胱氨酸的巯基可与其发生迈克尔加成反应,实现不可逆的抑制效果。Dobrotă等[36]合成了靶向SENP1(靶点为rSENP1)和SENP2(靶点为rSENP2)肽基活性位点的探针(表1中序号2),该化合物的7 残基肽段结构[F(A)QQQTGG]能被SENP1 和SENP2 识别。
Ponder 等[37]以恶性疟原虫SENP1 为靶点对半胱氨酸蛋白酶抑制剂库进行筛选,结果发现,一类含有环氧基团的小分子拟肽化合物JCP-666(表1中序号3)有着较好的抑制效果(半抑制浓度IC50=17.9 μmoL),但稳定性较差;去除化合物JCP-666结构中天冬氨酸残基侧链的羧基基团后得到化合物VEA-260(表1 中序号4),该化合物的稳定性显著提高,并且保留了原有的抑制活性(IC50=16.2 μmoL);进一步研究结果表明,两种化合物对重组人SENP1(rhSENP1)和SENP2(rhSENP2)表现出优异的抑制活性,JCP-666 对人SENP1 和SENP2的IC50分别为9.0 μmoL 和4.7 μmoL,VEA-260 对人SENP1 和SENP2 的IC50则分别为7.1 μmoL 和3.7 μmoL。Albrow 等[38]在VEA-260 的基础上继续进行改造,得到芳酰氧基甲酮类化合物VEA-499(表1 中序号5),其对人SENP1 和SENP2 的IC50则分别为3.6 μmoL 和0.25 μmoL,这与其对SENP6(IC50>60 μmoL)和SENP7(IC50>100 μmoL)的抑制效果相比有着较高的选择性,该类化合物作为活性位点探针在复杂的蛋白质组中表现出高度特异性。化合物6(表1 中序号6)含有泛素序列,对人SENP6和SENP7 表现出了明显的抑制活性,IC50分别为4.2 μmoL 和4.3 μmoL[38]。
4.3 合成小分子类
虽然肽类和拟肽类表现出较好的抑制活性,但是该类化合物往往药代动力学性质较差,因此研究更具有成药性的小分子抑制剂是另一个研发方向。Qiao 等[39]设计并合成了一系列苯并二氮杂卓类SENP1 抑制剂,其中化合物7(表1 中序号7)和8(表1 中序号8)抑制SENP1 的IC50分别为15.5 μmoL和9.2 μmoL,抑制前列腺癌细胞PC3 生长的IC50分别为13.0 μmoL 和35.7 μmoL,构效关系研究结果表明,苯甲酰基侧链的取代基种类和位置对化合物的活性影响很大,C(3′)位引入苄氧基甲酰胺基(-NHCbz)时活性最佳,如果转移到C(4′)位或者替换成叔丁氧基甲酰胺基(-NHBoc)和乙酰氨基(-NHAc)时,化合物活性显著降低;进一步研究结果表明,4 位的甲酰基对化合物活性同样显著,分子对接实验结果表明,4 位甲酰基能够与SENP1催化中心的Cys603 残基发生共价结合,这可能是该类化合物产生SENP1 抑制活性的原因。Uno 等[40]合成的二苯基脲类化合物GN6767(表1 中序号9)能够有效降低HIF1α 的转录活性,经生物素标记后发现,该化合物的作用靶点为SENP1(cSENP1),其IC50>100 μmoL。在化合物GN6767 的基础上小幅度修改后得到化合物GN6860(表1 中序号10)和GN6958(表1 中序号11),两者均展现出较好的SENP1(cSENP1)抑制活性,其IC50分别为39.5 μmoL 和29.6 μmoL。
4.4 虚拟筛选类
近年来,计算机虚拟筛选在小分子抑制剂的鉴定和优化中发挥了越来越重要的作用。Chen 等[41]将来自SPECS 化合物文库的18 万种化合物与SENP1-SUMO2-RanGAP1 晶体结构中的SENP1 进行分子对接,发现苯甲酰氨基苯钾酸酯类化合物12(表1 中序号12)的抑制活性最佳,IC50为2.39 μmoL,对该化合物进行结构修饰得到化合物13 和14(表1 中 序 号13 和14),其IC50分 别 为1.18 μmoL 和1.08 μmoL。分子对接结果表明,该类化合物的酰胺氮原子和4-氯苯甲酰甲氧基上的羰基氧原子分别与SENP1 催化中心的His529 和Gln597 残基形成氢键,使化合物分子能够稳定占据SENP1 的催化位点。Zhao 等[42]采用类似的方法将SPECS 化合物文库中的化合物与SENP1-preSUMO2晶体结构中的SENP1 进行虚拟筛选,结果发现11 个化合物的IC50<50 μmoL,其中的化合物15(表1 中序号15)的IC50为15.0 μmoL,化合物16(表1 中序号16)的IC50为17.6 μmoL,选取它们作为先导化合物进行改造,得到化合物17 和18(表1 中序号17、18),对SENP1 的IC50分别为4.9 μmoL 和3.5 μmoL,分子对接结果表明,SENP1疏水腔中的His529、Val532、Leu466 和Gln597 残基参与相关氢键的形成。
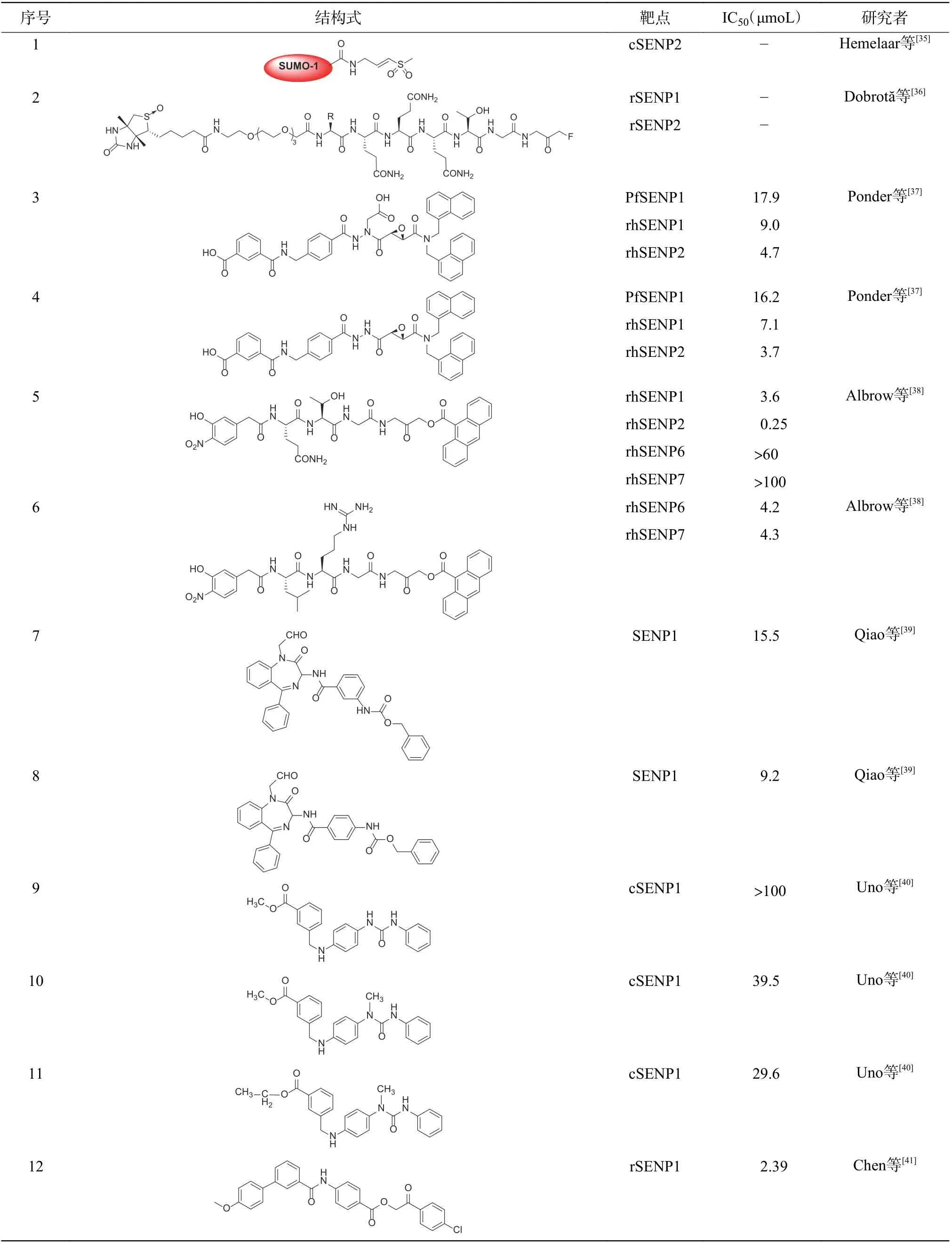
表 1 SENPs 抑制剂Table 1 Inhibitors of small ubiquitin-like modifier specific proteases inhibitors
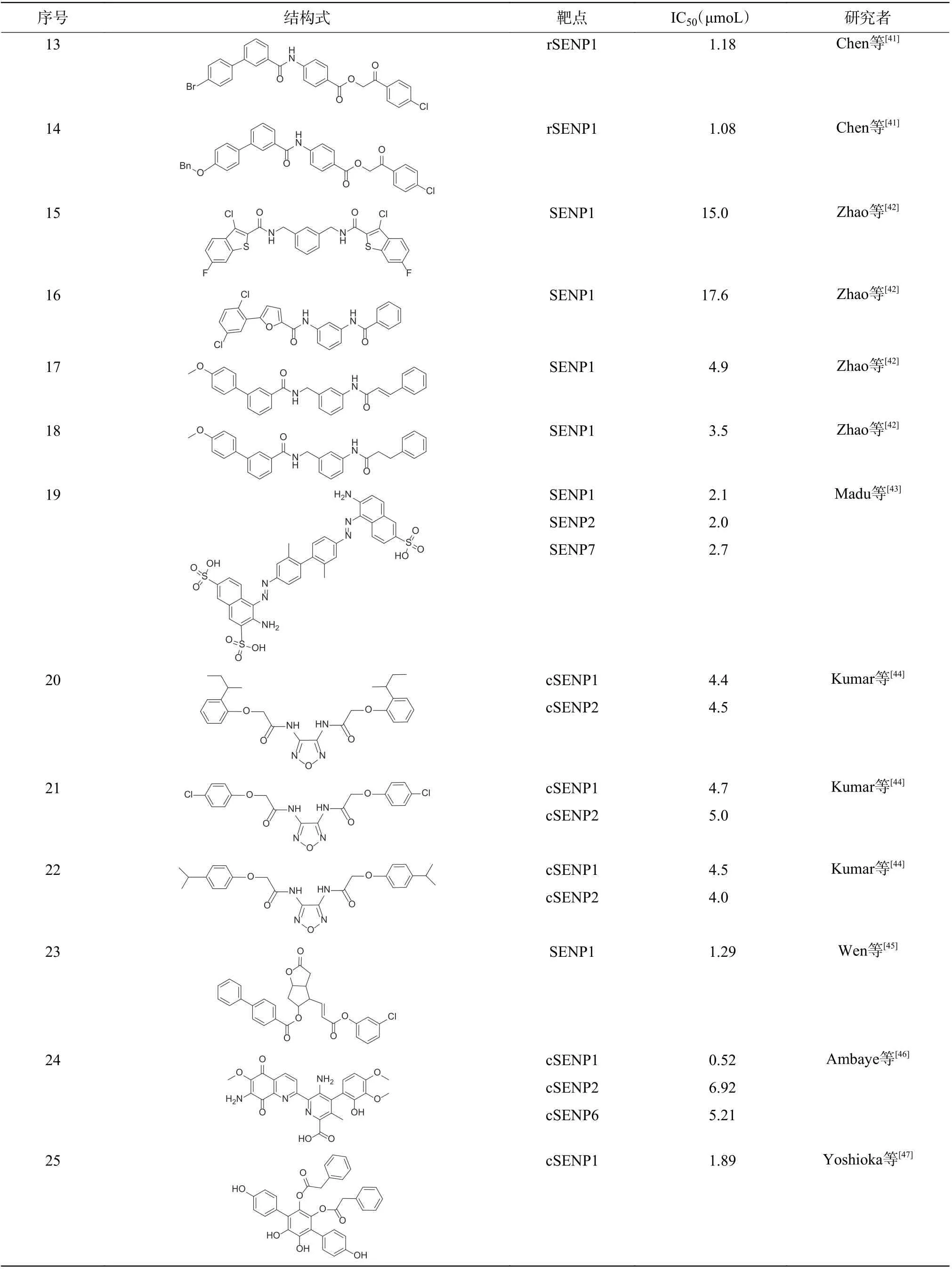
续表 1 SENPs 抑制剂Table (continued) 1 Inhibitors of small ubiquitin-like modifier specific proteases inhibitors

续表 1 SENPs 抑制剂Table (continued) 1 Inhibitors of small ubiquitin-like modifier specific proteases inhibitors
Madu 等[43]使用GLIDE 程序对25 万种化合物进行虚拟筛选,得到了40 种对SENP1、SENP2 和SENP7 表现出抑制活性的候选化合物,并提出了基于磺酰苯基的新型SENPs 抑制剂,其中化合物19(表1 中序号19)的抑制效果最优,对SENP1、SENP2 和SENP7 的IC50分别为2.1、 2.0、 2.7 μmoL,进一步的核磁共振和定量酶动力学实验结果证实了这些化合物的抑制作用属于可逆的非竞争性抑制。
Kumar 等[44]采用分层虚拟筛选和基于定量荧光共振能量转移技术相结合的方法发现了新型1,2,5-恶二唑类SENP1/2 抑制剂,即化合物20、21 和22(表1 中序号20、21、22),其抑制SENP1 的IC50分别为4.4、4.7、4.5 μmoL,同时对SENP2也表现出抑制活性。Wen 等[45]采用虚拟筛选的方法从化合物文库中筛选得到117 个含有不同骨架类型的小分子化合物,其中化合物23(表1 中序号23)表现出对SENP1 显著的抑制活性,其IC50为1.29 μmoL,分子对接实验结果表明,化合物23 占据了SUMO 蛋白羧基端二甘氨酸序列在SENP1 催化区域的位置,丙烯酸酯部分的羰基氧原子能够与SENP1 催化中心的His529 形成关键氢键,其芳香环能够与疏水腔的多个氨基酸残基形成π-π 相互作用,对化合物与SENP1 的结合起到稳定作用。
4.5 天然产物来源类
Ambaye 等[46]通过二维核磁共振和分子对接等方法发现链黑菌素(表1 中序号24)能够结合并抑制SENP1 的活性,而且对SENP1 的抑制选择性(IC50=0.52 μmoL)明显高于SENP2(IC50=6.92 μmoL)和SENP6(IC50=5.21 μmoL)。进一步的研究结果表明,链黑菌素能显著降低HIF1α 蛋白水平,这说明SENP1 在HIF1α 相关通路中起到非常重要的作用。Vialinin A(表1 中序号25)及其类似物Thelephantin G(表1 中序号26)是两种提取自可食用菌的对三联苯多酚化合物,Yoshioka 等[47]分别用人SENP1 催化结构域(cSENP1)和rhSENP1 对Vialinin A 和Thelephantin G 进行活性测试,结果发现,Vialinin A对cSENP1 和rhSENP1 的IC50分 别 为1.89 μmoL和1.64 μmoL,Thelephantin G 对cSENP1 和rhSENP1的IC50分别为1.52 μmoL 和2.48 μmoL。进一步研究结果表明,去掉结构中的苯甲(乙)酸酯或者将酚羟基氧化成醌后,化合物的活性均明显下降。Huang等[48]报道了天然产物雷公藤内酯(表1 中序号27)能在mRNA 和蛋白质水平上降低SENP1 表达。此外,Wu 等[49]确认地肤子皂苷Ic(表1 中序号28)能直接与SENP1 作用,对cSENP1 的IC50为15.37 μmoL,且能使前列腺癌PC3 细胞发生G2/M期阻滞,同时诱导其凋亡。
5 小结与展望
SENPs 影响着基因转录、细胞凋亡、细胞周期进程和DNA 修复等多个生理过程,且对肿瘤的放射敏感性具有调控作用。但SENPs 的下游靶点非常广泛,其调控放射敏感性的机制尚未阐释清楚,因此很有必要从分子生物学的角度对其开展深入研究。同时,开发SENPs 抑制剂或可为开发放射增敏药物提供新的思路。虽然目前已有部分抑制剂处于研发中,但存在着药代性质不佳和选择性差等问题,在诸多候选化合物中筛选出活性更高的SENPs 抑制剂并对其进行深入的构效关系研究也值得关注和探索。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明罗娜负责综述的撰写;勾文峰、吴红英负责综述的审阅与修订;李祎亮负责综述命题的提出、综述框架的构建。

