A型肉毒毒素对增生性瘢痕组织aFGF和bFGF因子mRNA表达的作用
武凤莲 朱东来 王嘉欣 王连英
伤口愈合的过程本身就是一个动态的、错综复杂的,同时受很多因素影响,其过程主要包括三个阶段:炎性反应阶段、肉芽组织形成阶段和基质形成或重构阶段[1]。当伤口愈合阶段发生任何变化时,就会导致个体产生病理性瘢痕[2]。这些病理性瘢痕包括增生性瘢痕和瘢痕疙瘩[3]。增生性瘢痕和瘢痕疙瘩的传统治疗包括按摩压迫治疗、硅胶治疗、激光治疗、光疗和放疗[4]。几种新兴的治疗方案包括腔内冷冻治疗,腔内注射5-氟尿嘧啶(5-Fu)、干扰素和博莱霉素[5]。尽管治疗增生性瘢痕有很多方法,但每种方法都有局限性。已有研究报道了A型肉毒毒素(BTXA)在治疗增生性瘢痕中的应用,并取得了良好效果[6,7]。 BTXA减轻早期增生性瘢痕瘙痒症状,部分抑制瘢痕萎缩,促进瘢痕软化,减少挛缩作用,也有研究观察到抑制成纤维细胞增殖和胶原分泌,但其分子机制尚不清楚[6,8]。为研究BTXA对增生性瘢痕成纤维细胞的影响,探讨BTXA对增生性瘢痕调节的分子机制,采用MTT法、罗丹明123染色、H2DCFDA荧光检测瘢痕成纤维细胞内的活性氧ROS,qPCR等方法研究不同浓度BTXA对增生性瘢痕成纤维细胞的影响。我们特别确定了BTXA对增生性瘢痕成纤维细胞生长因子aFGF和bFGF的影响,这些是影响增生性瘢痕组织中细胞异常增生和分化,胶原等细胞外基质过度分泌沉积的重要影响因素[9]。本研究为肉毒毒素的临床应用提供参考。
1 材料与方法
1.1 瘢痕组织标本 标本来源于2016至2018年我院整形烧伤外科的门诊及住院患者,患者近期激光、放射线及其他药物治疗,病程3个月~4年。瘢痕部位包括面部、上肢、胸背部,取标本前均得到患者的知情同意。
1.2 化学药品与仪器 BTXA(兰州生物制品研究所), DMEM培养基(Gibco公司 USA),Trizol 总RNA提取试剂盒美国 PROMEGA公司,逆转录试剂盒、taq酶购于日本TAKARA;染色罗丹明123、MTT、DMSO购于SIGMA US,H2DCFDA购自 Invitrogen, 新生小牛血清(杭州四季青公司),荧光显微镜,流式细胞仪,PCR 仪器。
1.3 增生性瘢痕成纤维细胞的培养 将取下的手术标本按无菌操作程序反复冲洗3次后,剪去多余皮下组织后,将只保留带表皮的瘢痕组织剪成所需大小的小组织块,缓冲液反复冲洗干净后接种于含有培养液的培养方瓶中,在特定条件的孵箱进行瘢痕成纤维细胞原代的培养,根据原代成纤维细胞的生长情况进行更换培养瓶中的培养液,待原代成纤维细胞爬满瓶底进行传代培养,细胞药物实验所用细胞为3~6代。
1.4 MTT检测瘢痕成纤维细胞的活力 取对数生长期的瘢痕成纤维细胞,用胰酶消化后的调制成为1×106/ml成纤维细胞悬浮液,以每孔200 μl的成纤维细胞密度接种于96孔培养板中。置于5% CO2,37℃培养箱培养约24 h至细胞长至单层。待细胞完全贴壁后去除培养液,用PBS洗1~2遍,加入用含血清的培养基稀释得到各组BTXA浓度的药液。每个药物浓度组(0.2、0.4、0.6、1.6 U/ml)及对照组设6个复孔,每孔加 150 μl药液,将细胞板继续置于培养箱中孵育24 h,弃上清,用PBS缓冲液溶液洗2遍,后每孔加MTT(5 mg/ml)20 μl继续孵育3 h后,弃掉上清液,每孔加200 μl DMSO振荡混匀,沉淀溶解完全后用自动酶标比色仪在波长 490 nm 处读取吸光值(A490)时测定其OD值。计算药物的抑制率 (IR)。IR=(1-试验组OD值/对照组OD值)×100%。
1.5 罗丹明123染色 用罗丹明123染色技术评估BTXA对增生性瘢痕成纤维细胞线粒体膜通透性的影响。将成纤维细胞制成1×106悬浮液接种于96孔培养板中,用浓度为0.4 U/ml、0.8 U/ml BTXA处理组细胞进行24 h培养,并与对照组细胞进行比较。培养24 h后,PBS冲洗细胞,每孔加入罗丹明123染液(10 μg/ml)10 μl,置于37.0℃、5%(体积分数)的CO2饱和温度的孵箱中继续孵育15 min。然后荧光显微镜下观察细胞,用Image软件进行评价。
1.6 H2DCFDA检测瘢痕成纤维细胞内的活性氧(ROS) 利用荧光探针H2DCFDA 检测对照组及用浓度为0.4 U/ml、0.8 U/ml BTXA处理组细胞内ROS的产生情况。将增生性瘢痕成纤维细胞制成1×106悬浮液接种于96孔培养板中,用浓度为0.4 U/ml、0.8 U/ml BTXA处理组细胞进行24 h培养,并与对照组细胞进行比较。细胞孵育培养24 h后,弃细胞培养板内细胞上清液,细胞板内用 PBS 清洗细胞后弃 PBS。然后每孔内分别加入H2DCFDA工作液(终浓度为 10 μmol/L)置 37℃、5% CO2的细胞培养箱内避光染色 15 min。经胰酶快速消化及 PBS 终止洗涤,1 500 r/min 离心 5 min 后,最后加入 200 μl PBS 重悬,后在激发波长488 nm,发射波长525 nm条件下在流式细胞仪检测各样本平均荧光强度,该值代表细胞ROS水平。
1.7 RNA提取与qPCR 总RNA是从增生性瘢痕成纤维细胞中分离出来,将含有不同浓度BXTA及对照组的培养液加入对数生长的密度为1×106个/ml的成纤维细胞混悬液中,将细胞放置于孵育箱中培养24 h,弃上清液收集细胞。按总RNA抽提试剂盒说明书,操作步骤按试剂盒的操作指南进行。采用 Trizol 法提取总 RNA,经NanoDrop ND-2000 紫外分光光度仪检测完整性后于-80℃保存备用。对所有样品取1 μg总RNA,利用Promega公司的逆转录试剂盒的操作步骤进行合成 cDNA。1 μl cDNA与1 μl 引物混合,于15 μl反应体系进行扩增。将各组样本扩增后的10 μl PCR产物进行琼脂糖凝胶电泳分析,用凝胶扫描成像分析仪处理系统扫描各条带紫外光吸收量(Vol)。以为β-actin内参,检测各组bFGF和aFGF基因的Vol与内参β-actin的Vol的比值作为目标基因的相对表达量,并比较对照组与加入不同浓度肉毒毒素作用后增生性瘢痕成纤维细胞bFGF和aFGF基因的表达的变化。引物序列如下:bFGF(303 bp):上游引物5’-AGCGGCTGTACTGCAAAAAC-3’,下游引物5’-CAGTTCGTTTCAGTGCCACA-3’,aFGF(430 bp):上游引物5’-GGAATTCCATATGGCTAATTACAAGCCCA-3’,下游引物5’-AAGAGATCTTTAATCAGAAGAGACTGGCAGG-3’,β-actin(166 bp):上游引物5’-TGACGGGGTCACCCACACTGTGCCCATCTA-3’,下游引物5’-CTAGAAGCATTTGCGGTGGACGATGGAGGG-3’。
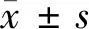
2 结果
2.1 MTT检测结果 采用MTT法测定不同浓度BTXA对成纤维细胞的抑制作用。与对照组(1.020±0.031)比较,0.2、0.4、0.8、1.6 U/ml BTXA(5.62±0.0121,15.01±0.023,32.25±0.124,51.21±0.214,72.47±0.061)处理的细胞中存活的成纤维细胞数量显著减少,且呈剂量依赖性(P<0.01)。
2.2 罗丹明123染色结果 细胞凋亡的初始事件是线粒体膜电位的降低和细胞色素C的释放,而线粒体膜电势的变化通常反映线粒体膜稳定性的状态,一旦线粒体膜稳定性变差,即线粒体膜通透性增高致使趋向发生凋亡,因此,本实验采用罗丹明123染色评估跨膜线粒体膜通透性的变化。相近细胞数目情况下,与对照组成纤维细胞比较,0.4 U/ml与0.8 U/ml A型肉毒毒素处理组的细胞绿色荧光降低,线粒体膜电位降低(P<0.01),线粒体膜通透性发生变化。提示BTXA对增生性瘢痕成纤维细胞有抑制增殖并诱导细胞凋亡的作用。见图1。

对照组0.4U/ml0.8U/ml
图1肉毒毒素对瘢痕成纤维细胞膜电位的影响
2.3 细胞内 ROS 改变 H2DCFDA作为一种活细胞染料,它在进入活细胞膜内能够被细 胞内酯酶作用并转化生成为H2DCF,而后者对细胞内各类ROS 敏感且极容易被其氧化并生成 2’,7’-dichloroflurorescein 产物(DFC)。而氧化后产物具有强荧光特性,通常结合荧光显微镜或流式细胞术检测细胞内ROS水平,根据平均荧光强度变化来表示细胞内ROS水平。由此,我们选择H2DCFDA 并结合流式细胞术检测,选择浓度为0.4 U/ml、0.8 U/ml的A型肉毒毒素预处理对增生性瘢痕成纤维细胞内ROS水平的影响。肉毒毒素处理组(0.4 U/ml时174.28%,0.8 U/ml时247.36%)与对照组100%比较,细胞内ROS水平显著升高(P<0.01),并且高浓组显著高于低浓度组(P<0.05)。见表1,图2。


组别aFGFbFGF对照组 110.2U/mlBXTA组0.890±0.211∗0.900±0.012∗0.4U/mlBXTA组0.790±0.051∗0.750±0.036∗0.8U/mlBXTA组0.615±0.027∗0.520±0.024∗1.6U/mlBXTA组0.402±0.012∗#0.491±0.142∗#
注:与对照组比较,*P<0.05;与0.2 U/ml BXTA比较,#P<0.01
2.4 qPCR结果 与对照组比较,对用浓度分别为0.2 U/ml、 0.4 U/ml 、0.8 U/ml、1.6 U/ml的A型肉毒毒素的培养液培养48 h的增生性瘢痕成纤维细胞中的bFGF和aFGF蛋白的表达量呈明显下降趋势,说明A型肉毒毒素可抑制bFGF和aFGF两种因子的表达,并且随着A型肉毒毒素浓度的增加,bFGF和aFGF两种因子蛋白表达呈剂量依赖趋势,差异均有统计学意义(P<0.05)。见表1,图3。
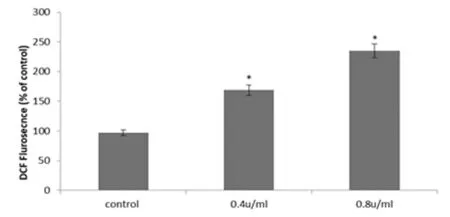
图2 肉毒毒素对增生性瘢痕成纤维细胞内活性氧的影响
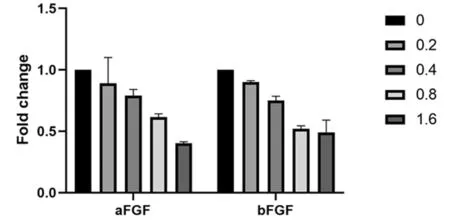
图3 不同浓度BTXA(U/ml)对aFGF及bFGF mRNA表达的影响
3 讨论
成纤维细胞生长因子(FGF)于20世纪40年代首次被发现,并于1974年人们从牛垂体中分离出来[10,11]。FGF家族的所有成员都有一定的相似之处,但都有其独特的特征。FGF家族包括这些酸性和碱性亚型,表现出广泛的生物活性。人aFGF和bFGF蛋白均由154个氨基酸组成,受体相同,序列同源性超过55%[12,13]。酸性FGF(aFGF)作为细胞分裂的促进因子,是细胞增殖和分化的有效促进因子[14]。碱性FGF(bFGF)主要作用于中胚层和神经外胚层来源的细胞,也是一种功能强大的细胞分裂因子。在大多数生物活性分析中,bFGF表现出比aFGF更强的效力[15,16]。在生理条件下,酸性FGF以阴离子形式存在,碱性FGF以阳离子形式存在,两种生长因子都没有信号肽结构,分泌方式尚不明确。aFGF和 bFGF作为重要的细胞分裂因子,能够直接作用血管内皮细胞和血管平滑肌细胞,从而促进新的毛细血管生成[17]。酸性FGF能够主动与创面边缘细胞的细胞膜上的受体特异性结合,诱导细胞分裂、增殖和迁移,促进皮肤和黏膜创面愈合。碱性FGF能够促进肉芽组织过度生长的同时,还可以诱导细胞外基质的合成,刺激结缔组织增生,从而加速创面的愈合[18]。
BTX是一种神经毒性蛋白,由肉毒杆菌及相关物种产生。它存在于各种血清型(A至G)。A型肉毒毒素(BTXA)可用于临床及各种疾病的治疗[19,20]。 近年来,在瘢痕的临床治疗中,BTXA被越来越多的人重视并开始应用,并取得了良好的临床治疗效果[21-23]。虽然BTXA广泛用于病理性瘢痕的治疗,但其分子机制尚不清楚。BTXA最初应用于瘢痕的预防和治疗,是因为它可以降低切口张力。我们都知道决定瘢痕最终外观的重要关键因素是在愈合过程中作用于伤口边缘的张力[24]。伤口边缘的张力可以直接(机械地)和间接(化学地)导致病理性瘢痕的生成。垂直于伤口边缘的张力往往会机械地拉伸伤口肌肉,从而扭曲正常的伤口愈合过程,从而导致增生性瘢痕和瘢痕疙瘩的形成[25]。当局部注入BTXA时,BTXA通过抑制神经肌肉连接部位乙酰胆碱的释放而起作用 ,会导致伤口肌肉暂时麻痹而固定,从而降低垂直张力。BTXA可以在伤口愈合过程中几乎完全消除伤口上的动态张力,从而改善伤口瘢痕愈合[26]。也有研究发现BTXA能有效抑制成纤维细胞的生长[21]。BTXA对增生性瘢痕和瘢痕疙瘩作用机制的另一理论就是其对成纤维细胞周期分布的影响。成纤维细胞过度增殖是导致增生性瘢痕重要的因素之一[27]。BTXA可能通过改变病理性瘢痕上的凋亡、迁移和纤维化通路,直接调节成纤维细胞的活性,从而改善其外观[27]。
本研究中,我们观察了不同浓度的BTXA对增生性瘢痕中成纤维细胞的影响。不同的细胞毒性信号,如活性氧,生长剥夺和死亡受体诱导细胞中的凋亡信号。对照组细胞和肉毒毒素处理组细胞的H2DCFDA染色结果清楚地描绘出A型肉毒毒素增加了活性氧(ROS)的产生。罗丹明123染色结果表明,A型肉毒毒素诱导的ROS产生并导致凋亡蛋白的活化,从而增加了增生性瘢痕成纤维细胞线粒体膜通透性。线粒体膜通透性的增加导致细胞色素C等促凋亡蛋白的释放,从而激活凋亡蛋白进而诱导细胞的凋亡[28]。本研究中我们还研究了不同浓度的A型肉毒毒素作用的增生性瘢痕成纤维细胞中aFGF和bFGF蛋白表达的变化,肉毒毒素处理组细胞与对照组细胞比较,aFGF和bFGF蛋白表达降低。本结果提示:BTXA对增生性瘢痕组织中成纤维细胞的生长有抑制并诱导其凋亡的作用,且具有浓度依赖性,与对照组比较aFGF和bFGF蛋白的表达随着BTXA浓度的增加而降低。结果提示BTXA对增生性瘢痕组织成纤维细胞增殖方面具有明显的抑制作用,其作用机制可能是通过降低aFGF和bFGF蛋白的表达,从而导致增生性瘢痕内成纤维细胞增殖的减缓,凋亡的增加,细胞外基质合成分泌降低。其具体的分子机制、aFGF和bFGF与细胞凋亡的具体作用及细胞周期及信号通路的具体调控将是我们进一步深入研究探讨的方向。

