依替福辛对术后认知功能障碍小鼠的认知保护作用及机制
马丽 张晖 郭文治 郭航 马亚群
1 材料与方法
1.1 实验材料 依替福辛(美国sigma);非那司提(finasteride,FIN)(中国TCI);兔抗TSPO抗体(美国abcam);小鼠β-actin抗体(美国abcam);小鼠四氢孕酮 ELISA试剂盒(美国Arbor Assays);小鼠TNF-α ELISA试剂盒(美国R&D);IL-1β ELISA试剂盒(美国RD);PVDF膜、蛋白上样缓冲液等(武汉Servicebio)。
1.2 实验动物及POCD模型制作 C57老年小鼠(20月龄),雄性,清洁级,斯贝福生物技术有限公司提供,许可证号:SCXK(京)2015-0015。POCD模型制作过程:无菌环境中,小鼠麻醉后于腹部做中线切口,长约2 cm,结扎血管,行肝叶切除术。逐层关腹,术后保暖。
1.3 动物分组与处理 小鼠随机分为对照组(Control组)、POCD组、POCD+EFX组、POCD+EFX+FIN组,每组24只。将所有实验小鼠水迷宫中进行连续4 d的隐蔽平台训练实验。POCD + EFX组进行水迷宫训练前先进行3 d的依替福辛(50 mg/kg,溶剂为1%吐温80+0.9%氯化钠溶液)腹腔注射;POCD+EFX+FIN组进行水迷宫训练前先注射3 d的依替福辛(50 mg/kg)和非那司提(5 mg/kg,溶剂为30%羟丙基-beta-环糊精+0.9%氯化钠溶液)。4 d的隐蔽平台试验训练完成后POCD组、EFX组、POCD+EFX+FIN组进行肝叶切除术。分别在术后第3天和第7天进行水迷宫探索实验。
1.4 Morris水迷宫
1.4.1 Morris水迷宫是一种经典的用于检测实验动物空间学习记忆能力的方法。先进行连续4 d的隐蔽平台试验训练。实验前1 d,让动物在不含平台的水池中自由游泳90 s,上午、下午各1次,使其熟悉迷宫环境。实验时平台位置固定不变,置于东北象限中央,平台中点离池壁22.5 cm。在平台对侧选两个与之距离相等的点作为入水点,训练时将动物面朝池壁轻放入水中,记录小鼠从入水至找到平台的游泳路线的长度及找到平台的时间(逃避潜伏期),然后让小鼠在平台上停留10 s。如果90 s内找不到平台,潜伏期记为90 s,并将小鼠置于平台上休息10 s。每天在2个入水点各训练1次,以2次潜伏期均值作为该天的成绩。
1.4.2 训练结束后次日进行手术。手术后在第3天、第7天进行空间探索实验。撤除平台,然后任选一相同入水点将小鼠放入水中,记录小鼠在60 s内游泳路径,对小鼠在原平台象限的停留时间、游泳距离百分数及穿越平台的次数进行统计分析。
1.5 标本采集、处理 术后第3、7天,完成空间探索实验的小鼠,每组12只,断头处死,迅速取出脑组织,用4℃ 0.9%氯化钠溶液洗去血污,滤纸吸干。在冰上分离小鼠双侧海马组织置于-80℃冰箱中贮存备用。
1.6 统计学分析 应用Prism统计软件,对Morris水迷宫所得到的逃避潜伏期数据使用重复测量方差分析,组间比较采用正态分布和方差齐性检验后选择单因素方差分析(one-way ANOVA),进一步两两比较采用Bonferroni-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Morris水迷宫结果 隐蔽平台试验训练的结果显示在4 d的训练过程中,4组小鼠寻找隐蔽平台的潜伏期、路程均呈现随时间逐渐缩短趋势,但组间差异无统计学意义(P>0.05)。4组小鼠游泳速度各组间差异也无统计学意义(P>0.05)。术后第3天空间探索实验结果显示,无论是在目标象限时间百分数还是在目标象限路程百分数组间差异均有统计学意义(F=6.349,P=0.0012;F=6.670,P=0.0009)。Bonferroni-t检验进一步两两比较显示:与Control组比较,POCD组小鼠在目标象限停留时间和游泳距离明显缩短(P<0.01);与POCD组相比,POCD+EFX组小鼠在目标象限停留时间和游泳距离明显延长(P<0.05);使用非那司提拮抗后,小鼠在目标象限游泳距离再次缩短(P<0.05),但在目标象限停留时间与POCD+EFX组虽有缩短趋势,但差异无统计学意义(P>0.05)。术后7 d时空间探索实验显示4组小鼠在目标象限时间百分数、目标象限路程百分数及穿越平台次数差异均无统计学意义(P>0.05)。见表1。


组别目标象限时间百分数(%)目标象限路程百分数(%)平台穿过次数(次)Control组 41.19±6.7341.89±6.482.27±1.56POCD组 28.00±8.11∗29.56±9.31∗1.45±1.13POCD+EFX组 38.48±9.28#39.70±8.33#2.00±1.10POCD+EFX+FIN组29.75±9.7329.61±9.38△1.33±1.10
注:与Control组比较,*P<0.01; 与POCD组比较,#P<0.05;与POCD+EFX组比较,△P<0.05
2.2 海马TSPO的表达 术后3 d海马TSPO蛋白水平组间差异有统计学意义(F=10.10,P=0.0043)。Bonferroni-t检验进一步两两比较显示:与Control组比较,POCD组小鼠海马水平显著升高(P<0.05);与POCD组比较,POCD+EFX组小鼠TSPO蛋白水平与POCD组相比显著降低(P<0.01);使用非那司提拮抗依替福辛作用后,TSPO蛋白水平虽然有所增加,但差异无统计学意义(P>0.05)。见图1。

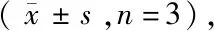
2.3 炎性因子的表达 术后3 d 4组小鼠海马组织中TNF-α、IL-1β细胞因子水平比较差异有统计学意义(F=6.941,P=0.0058;F=16.00,P=0.0002)。Bonferroni-t检验进一步两两比较显示:与Control组比较,POCD组小鼠TNF-α、IL-1β水平显著升高(P<0.05;P<0.01);与POCD组比较,依替福辛预处理可显著降低TNF-α、IL-1β水平(P<0.05);使用非那司提拮抗后,IL-1β水平显著升高(P<0.05),TNF-α蛋白水平虽有所升高,但差异无统计学意义(P>0.05)。见表2。


组别TNF-αIL-1βControl组 11.71±2.675.98±2.00POCD组 20.28±3.82∗16.90±4.16#POCD+EFX组 12.17±3.00△9.14±2.30☆POCD+EFX+FIN组20.16±4.6918.79±3.31▲
注:与Control组比较,*P<0.05,#P<0.01; 与POCD组比较,△P<0.05,☆P<0.01;与POCD+EFX组比较,▲P<0.01
2.4 四氢孕酮含量 术后第3天4组小鼠海马组织中四氢孕酮含量比较差异有统计学意义(F=8.968,P=0.0022)。Bonferroni-t检验进一步两两比较显示:与Control组比较,POCD组小鼠海马内四氢孕酮含量显著降低(P<0.05);POCD模型小鼠接受依替福辛预处理后,海马四氢孕酮含量显著升高(P<0.01);而使用四氢孕酮合成抑制剂非那司提拮抗后,海马四氢孕酮含量较POCD+EFX组又显著降低(P<0.05)。见表3。
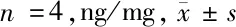

组别四氢孕酮含量Control组0.64±0.09POCD组0.38±0.04∗POCD+EFX组0.66±0.13#POCD+EFX+FIN组0.44±0.09△F值8.968P值<0.01
注:与Control组比较,*P<0.05; 与POCD组比较,#P<0.01;与POCD+EFX组比较,△P<0.01
3 讨论
POCD的发生与脑内炎症关系密切,我们的实验结果也提示POCD模型小鼠认知功能较Control组显著降低,脑内炎性因子TNF-α、IL-1β表达显著增加。此外,本实验结果还显示POCD小鼠脑内TSPO蛋白表达也显著增加。已知正常健康的大脑TSPO表达量较低,TSPO表达量上调目前普遍被认为是小胶质细胞激活的标志。在多发性硬化患者[5]、脊髓侧索硬化症[6]、阿兹海默症[7,8]等慢性神经退行性疾病中,TSPO放射性配体的结合率都明显增加,且与组织病理染色中的小胶质细胞激活程度一致,与疾病的严重程度也有很强的相关性。因此虽然关于POCD模型动物脑内TSPO如何变化,目前并未见相关报道,但可以推断POCD脑内炎症的增加伴随着小胶质细胞的激活,同时必然存在TSPO表达水平的显著升高。本研究结果证实了此推断。

在我们的实验中,依替福辛可显著增加脑内四氢孕酮的含量,非那司提作为四氢孕酮的合成抑制剂部分拮抗了依替福辛的作用,不仅降低了四氢孕酮的含量,还使得海马认知能力又有所降低,炎性因子TNF-α、IL-1β表达显著增降低。这提示依替福辛对POCD动物模型的保护作用可能与其增加了四氢孕酮的合成有关。Daugherty等[17]在多发硬化症模型中发现依替福辛的神经保护作用可能与3α-HSD的mRNA表达增加继而增加四氢孕酮的含量有关,其中3α-HSD是四氢孕酮合成的重要反应酶。虽然目前认为依替福辛与TSPO蛋白结合力较低,但其在结合部位的结合实践较长可以解释其合成甾体类激素的的高效性[20]。既往大量实验表明作为一种重要的甾体类激素,四氢孕酮具有显著的神经保护效应[21]。其中,四氢孕酮是如今明确的唯一一种既能刺激脑神经前体细胞增生又能缓解阿兹海默症病理过程的化学物质,以至于目前它被认为是治疗阿兹海默症的潜在性药物[22]。在LPS损伤模型[23]的实验研究中,外源性四氢孕酮的摄入也可产生一定的抗神经炎症及神经保护作用。但目前尚未见到使用四氢孕酮进行POCD预防及治疗的研究。
本研究也有一定的局限性,由于在水迷宫空间探索实验中,4组间小鼠行为学表现仅在术后第3天差异有统计学意义(P<0.05),在术后第7天差异无统计学意义(P>0.05),因此我们仅进行了术后第3天的实验室检测。而根据文献,炎性因子的变化可能持续至术后第7天及以后,本实验不能明确依替福辛抗炎作用的持续时间。非那司提仅表现出部分拮抗作用,可能是因为样本量不够,或者依替福辛的神经保护作用涉及多途径。此外,我们虽然检测了TSPO脑内水平的变化,但没有测定TSPO亲和力及功能变化。
综上所述,依替福辛作为TSPO配体在POCD动物模型中可显著减轻炎性反应,改善认知功能,而这种神经保护作用可能与其增加四氢孕酮的含量有关。由于依替福辛是临床已经使用的药物,加上其本身并不会对健康老年人的认知及觉醒有任何损害[24],因此具有良好的临床应用前景。

