2018年春季福建近海浮游植物群落结构变化
曾宇兰,陆斗定,王鹏斌,郭若玉,管卫兵,戴鑫烽
2018年春季福建近海浮游植物群落结构变化
曾宇兰1,2,陆斗定1,2,王鹏斌1,2,郭若玉1,2,管卫兵2,戴鑫烽1,2
(1.国家海洋局海洋生态系统与生物地球化学重点实验室, 自然资源部第二海洋研究所// 2. 卫星海洋环境动力学国家重点实验室,自然资源部第二海洋研究所,浙江 杭州 310012)
【】研究2018年春季福建近海浮游植物群落结构变化。分别于2018年4月和5月对福建近海进行综合性调查,分析福建近海春季赤潮原因种的演替、浮游植物分布情况和群落结构变化。2018年4-5月,福建附近海域从中肋骨条藻和东海原甲藻双相赤潮变为东海原甲藻单一赤潮, 赤潮数量级106~ 107cells/L;赤潮附近海域的浮游植物多样性指数较低;表中层细胞丰度变化差异大,底层丰度变化差异小。浮游植物优势种群由硅藻为主向甲藻为主演替。
有害赤潮; 赤潮原因种; 生物多样性; 演替
中国首次文件记载的有害赤潮是1933年浙江沿海发生的夜光藻和中肋骨条藻赤潮[1]。近几十年统计显示浙江和福建近海发生的有害赤潮频率最高,面积最大[2-4]。东海赤潮的发生存在季节性变化,中肋骨条藻赤潮在1-9月都有发生,东海原甲藻赤潮通常在5月爆发[3,5]。福建宁德福鼎海域主要为东海原甲藻赤潮,霞浦附近海域的赤潮原因种主要有角毛藻、夜光藻、凯伦藻、中肋骨条藻、菱形藻和东海原甲藻,厦门附近海域曾发现的赤潮原因种有角毛藻、中肋骨条藻、血红哈卡藻、夜光藻[3]。除此之外,福建近海也曾发生有毒赤潮,以甲藻为主,如米氏凯伦藻、短凯伦藻、微小原甲藻等[3]。水体富营养化可能是诱导浮游植物赤潮的基础原因,如长江口、杭州湾过量营养盐的输入[6];此外,上升流也与赤潮有关,如浙江和福建沿海的上升流区与赤潮高发区重叠[7-9]。
福建沿海地区附近海域频繁爆发赤潮,如中肋骨条藻和东海原甲藻赤潮,长期大规模的有害赤潮可导致底层水体缺氧的恶性生态灾害[10];而有毒的米氏凯伦藻产生溶血毒素和鱼毒素能溶解鱼鳃组织[11-12],还会通过抑制纹盘鲍鳃和肝胰组织的某些酶活性,损伤其免疫系统,影响贝类幼体的早期发育,从而导致大量鱼贝死亡,造成严重的水产经济损失[13-14],如2012年爆发的米氏凯伦藻赤潮造成鲍农20多亿元经济损失[15]。目前对该区域赤潮发生机制了解甚少。笔者于2018年4-5月对福建近海浮游植物群落结构演变情况进行现场调查与分析,以期为本区域赤潮预警与危害缓解奠定科学基础。
1 材料与方法
1.1 研究区域和时间
本调查主要在福建近海区域,位于25° N-28° N之间,断面站位分布见图1。于2018年进行2个航次调查(4月26日至4月29日,5月19日至5月22日),以南部断面I、II、III、IV为主,共设25个站位。
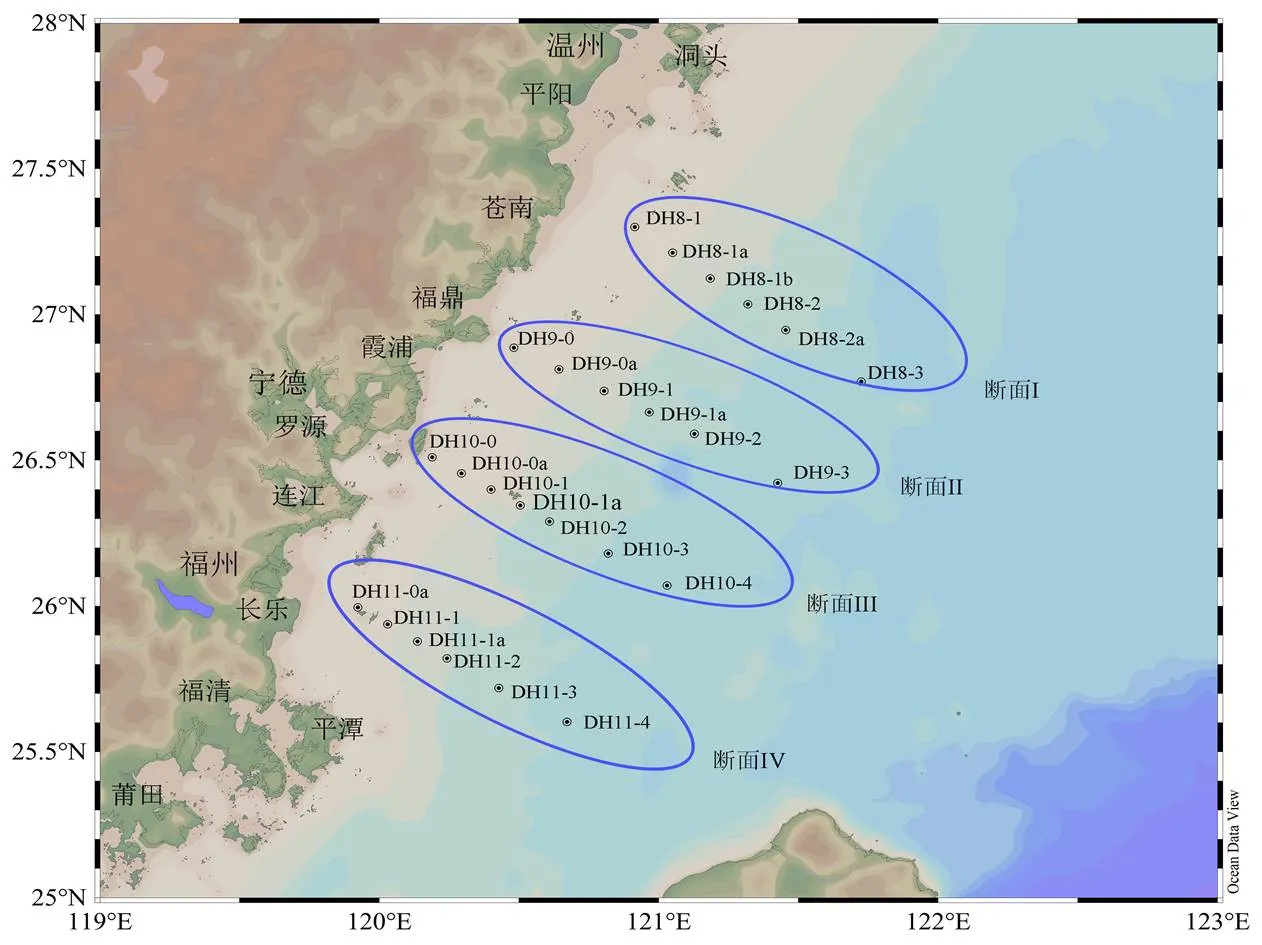
图1 2018年2次航次调查站位
1.2 样品采集
利用CTD多参数探头(SBE 19plus, Sea-Bird Electronics, Inc. USA)来采集水深、温盐、pH等参数。严格按海洋调查规范对调查数据进行整理分析。采水前,把CTD连续测定的叶绿素最大值的水层定为采水中层,然后用30 L Niskin瓶采集表中底层海水样品。采集1 L海水至1 L PET瓶中并用鲁格试剂固定(鲁格试剂体积分数终浓度为1%),避光保存且带回实验室。虹吸法浓缩样品(赤潮样品不浓缩),在实验室静置样品24 h后,舍弃上清液至50 mL,转置棕色小瓶中,4℃保存。对样品进行定性定量分析,摇匀并吸取1 mL样品至1 mL记数框(Sedgewick Rafter, PYSER-SGI, UK),置于倒置光学显微镜(Olympus CKX41, Japan)下观察,观察倍数为100、400倍,记录浮游植物的种类和个数。
用香农-维纳多样性指数(′)、优势指数()和种类更替率()对浮游植物进行分析,计算公式如下:
=(×1)/(2×V),
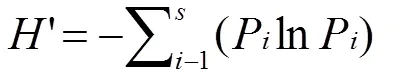
=(N/N)×f,
=[(+-2)/(+-)],
为某个样品中细胞丰度 (cells/L),为取样计数个数 (cells),1为某水样浓缩后的体积 (mL),2为某个样品采水量 (L),i为某样品取样计数的体积(mL);N为某个水层全部样品中细胞丰度总数(cells/L),为某个水层全部样品中物种数目,N为某个水层某样品中某种的个数 (cells/L);P=N/N,f为某种藻在某个水层各站点出现的频率;为种类更替率(%),和分别是4月和5月调查的浮游植物种类数,是2次调查共同的浮游植物种类数。
1.3 数据处理
采用 Ocean Data View 2015软件绘制浮游植物丰度、生物多样性平面分布图和温盐剖面分布图,采用Origin 8软件绘制群落结构图,用Canoco 5软件制作温盐与浮游植物优势种群的限制性排序分析图表。
2 结果
2.1 浮游植物的种类
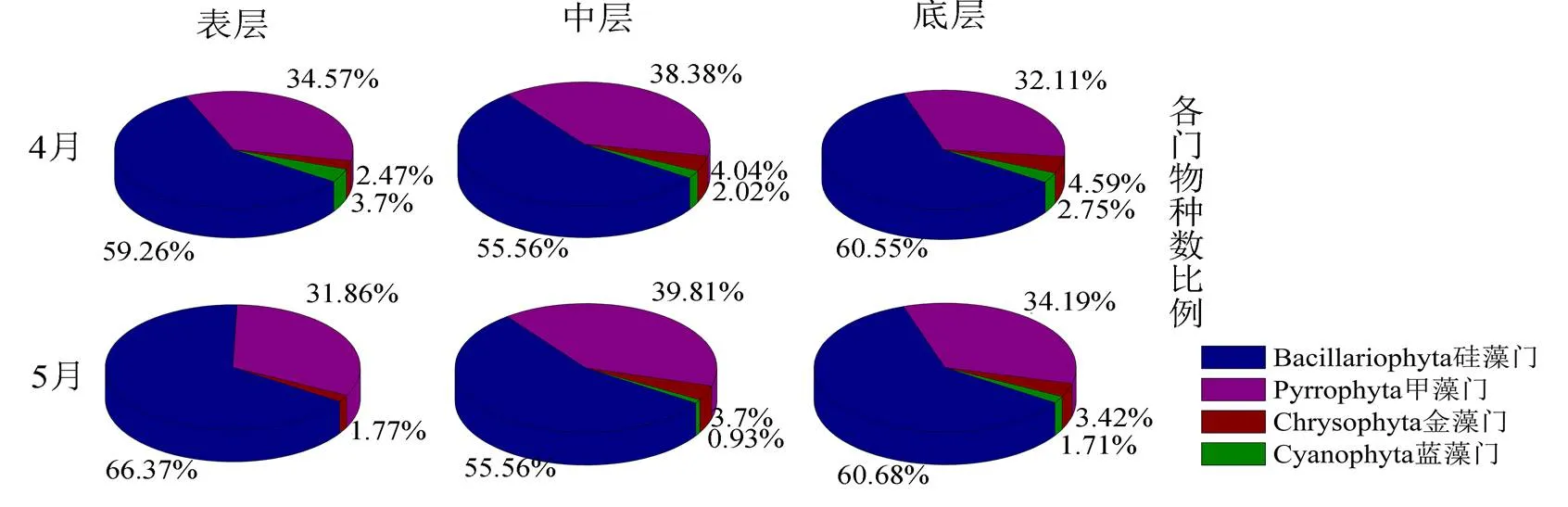
结果显示,2018年春季福建近海的两次调查共鉴定出硅藻门、甲藻门、金藻门和蓝藻门,共85个属,208种浮游植物。其中硅藻门115种,甲藻门80种,金藻门7种,蓝藻门6种。4月表层主要有骨条藻属、原甲藻属、菱形藻、角毛藻属等;4月中层主要有骨条藻属、原甲藻属、海链藻属、菱形藻属、角毛藻属、细柱藻属等;4月底层物种丰富,主要有原甲藻属、海链藻属、菱形藻属、辐裥藻属、帕拉藻属、角毛藻属等;5月表层主要有原甲藻属、骨条藻属、列博藻属、角毛藻属、异甲藻属、几内亚藻属等;5月中层主要有原甲藻属、骨条藻属、异甲藻属、角毛藻属、辐裥藻属等;5月底层主要有原甲藻属、菱形藻属、角毛藻属、辐裥藻属、异甲藻属等(图2)。4-5月,表中底层的浮游植物种群更替率分别是46.03%、38.28%、37.41%。
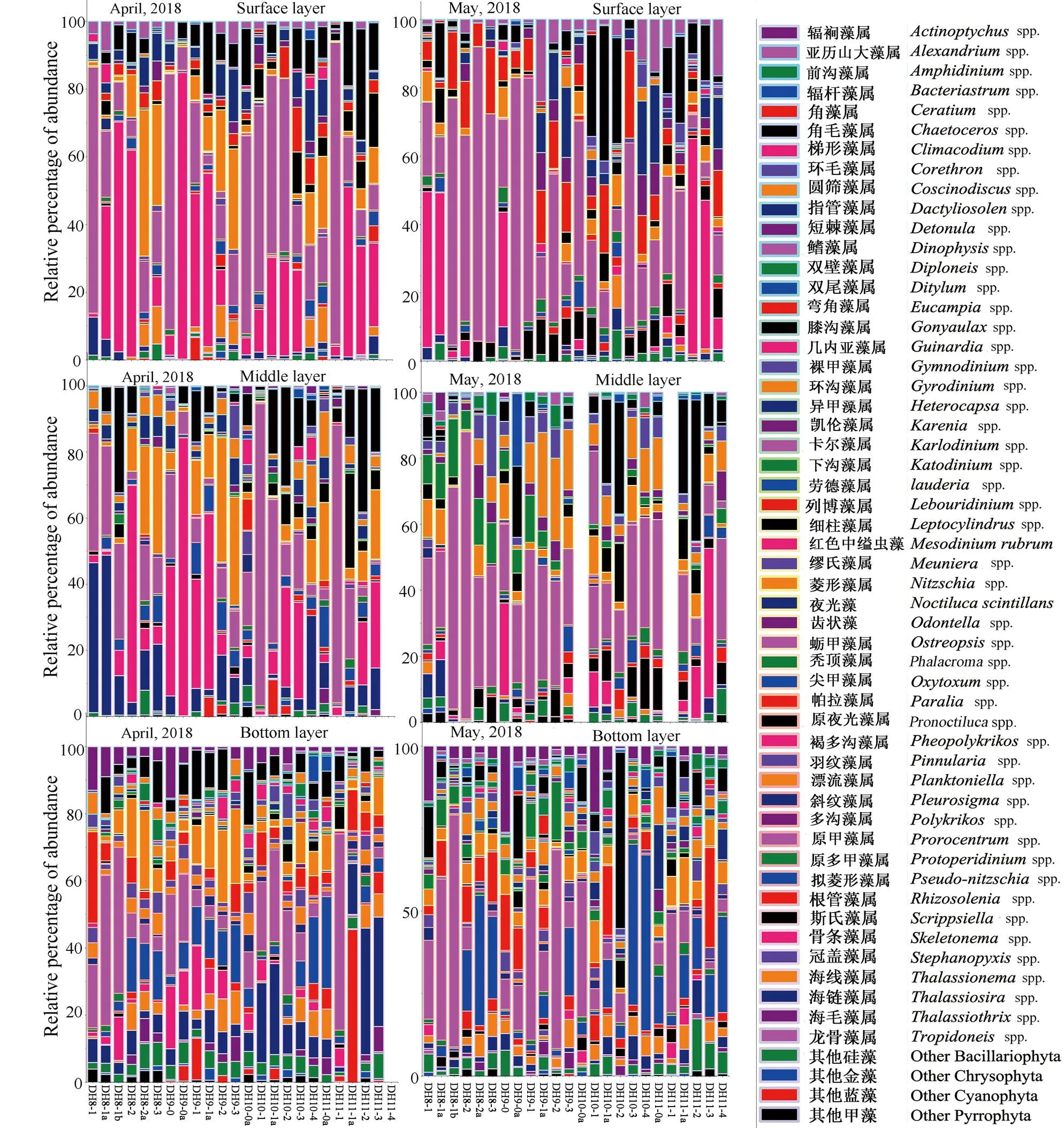
图2 2018年2次调查的浮游植物群落组成结构
2.2 浮游植物时空分布
2018年福建近海海域的2次调查发现,4月和5月的赤潮原因种发生了改变。4月赤潮原因种是中肋骨条藻和东海原甲藻;DH9-0a站位发生了中肋骨条藻赤潮,影响范围在0 ~ 10 m等深线,中肋骨条藻表层丰度约9.4×106cells/L,中层丰度约5.87×106cells/L;站位DH9-0表层发生了东海原甲藻赤潮,其丰度约1.17×106cells/L。5月赤潮原因种只有东海原甲藻,赤潮站位主要是DH8-1b和DH9-0a的表层,东海原甲藻丰度分别是1.11×106、3.87×107cells/L(图3)。
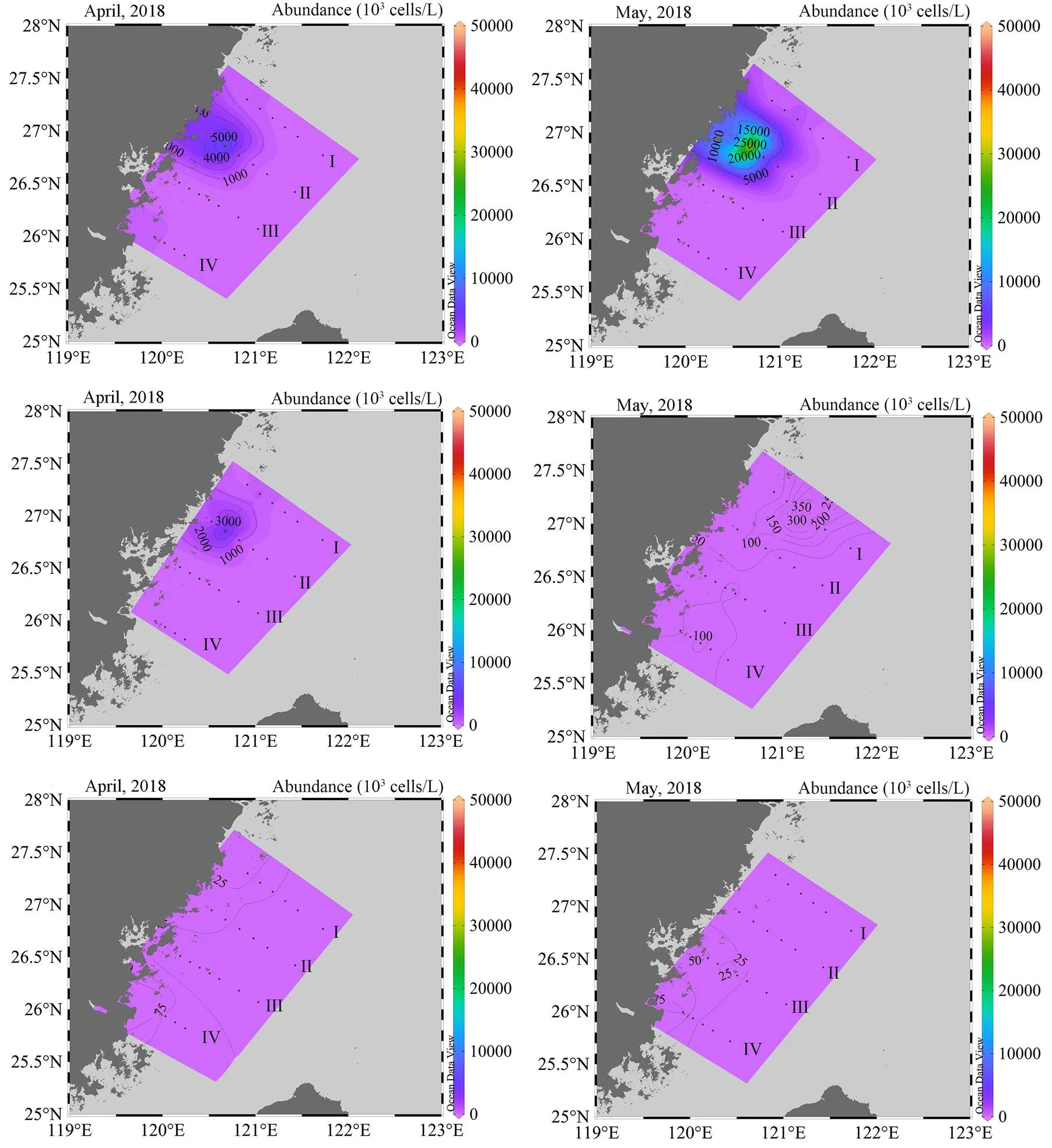
图3 2018年2次调查的浮游植物细胞丰度平面分布
浮游植物不同门类的时空变化显示:4-5月,主要浮游植物种类为硅藻门、甲藻门、金藻门和蓝藻门,各门物种数比例在表中底层差异不大,硅藻和甲藻为主,细胞丰度则从硅藻为主演变为甲藻为主(图4)。4月,在表中底层,依次有81、99、109个物种,硅藻物种数占比依次是59.26%、55.56%、60.55%,细胞丰度占比依次是71.78%、79.34%、56.51%;甲藻物种数占比依次是34.57%、38.38%、32.11%,细胞丰度占比依次是27.79%、20.34%、40.98%。5月,在表中底层,依次有112、108、117个物种,硅藻物种数占比依次是66.37%、55.56%、60.58%,细胞丰度占比依次是13.66%、30.82%、57.41%;甲藻物种数占比依次是31.86%、39.81%、34.19%,细胞丰度占比依次是86.33%、68.99%、42.12%(图4)。
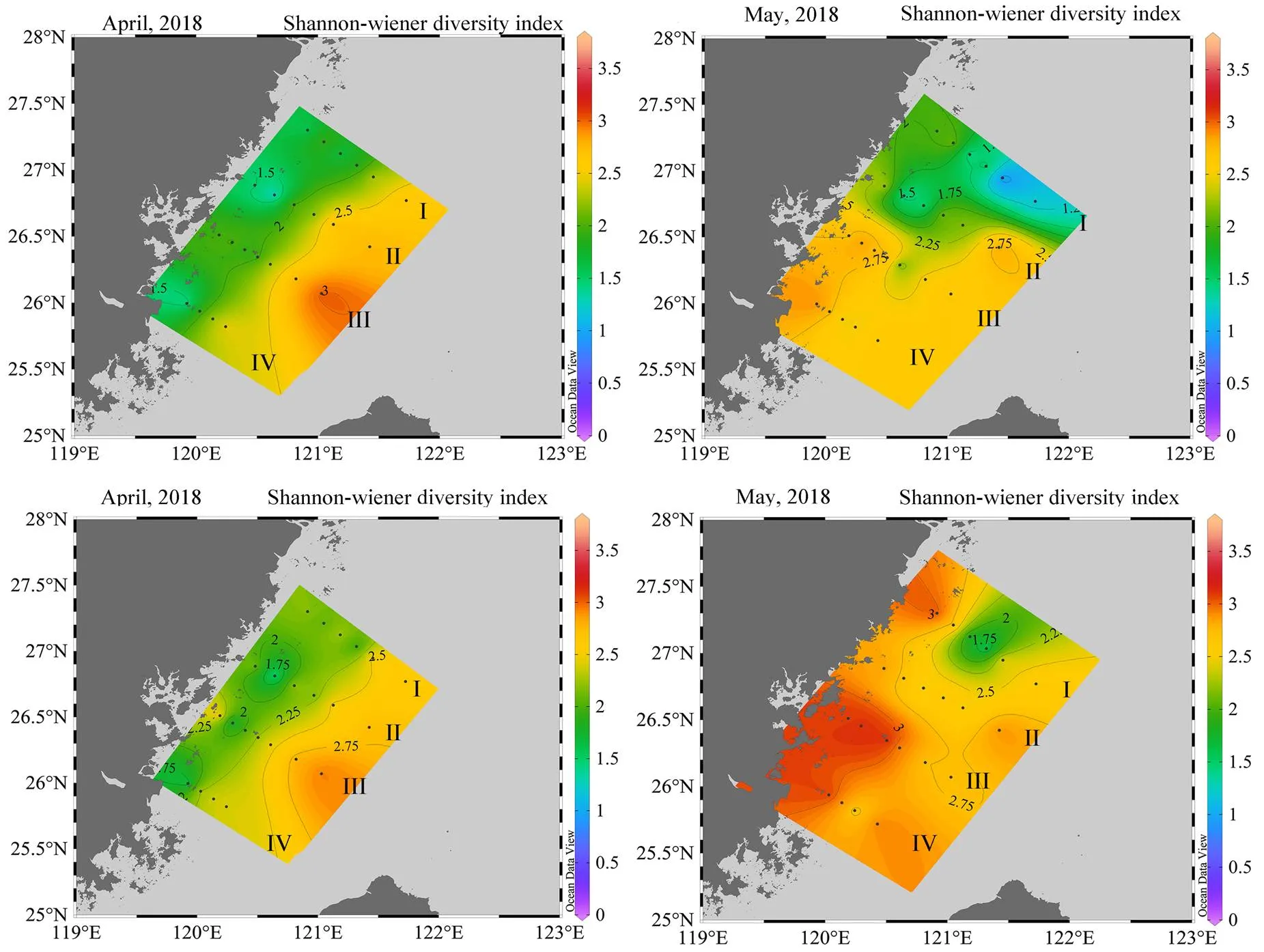
香农-维纳多样性指数(′)分布图显示,4月,表中底层平均′值依次是2.117 2、2.288 7、2.933 9,赤潮附近海域的多样性指数低,表中层′值靠岸低、离岸高,底层′值总体较高;5月表中底层的平均′值依次是2.222 0、2.498 6、2.767 7,赤潮附近海域的H′值较低,表层′值在断面I、II分布低、断面III、IV分布高,中层′值普遍变高,底层′值在断面I、II、III都有所降低(图5)。
2次调查共发现22个优势种,从4月到5月,优势种群从硅藻为主演变成甲藻为主:4月优势种,表层有中肋骨条藻(= 0.500 4)、东海原甲藻(= 0.192 3)、心形原甲藻(= 0.041 2)、并基角毛藻(= 0.028 2),中层有中肋骨条藻(= 0.535 6)、东海原甲藻(= 0.127 5)、海链藻(= 0.060 3)、并基角毛藻(= 0.031 6),底层有东海原甲藻(= 0.228 2)、细弱海链藻(= 0.082 3)、中肋骨条藻(= 0.040 1)、辐裥藻(= 0.036 7)、长菱形藻(= 0.025 4)等。5月优势种,表层有东海原甲藻(= 0.773 9)、灰白列博藻(= 0.053 0),中层有东海原甲藻(= 0.374 2)、下沟藻(= 0.088 7)、裸甲藻(= 0.030 4)、环沟藻(= 0.026 7)、中肋骨条藻(= 0.023 1)等,底层有柔弱拟菱形藻(= 0.073 3)、角毛藻(= 0.037 1)、长菱形藻(0.034 6)、辐裥藻(0.034 6)、环沟藻(= 0.025 1)、东海原甲藻(= 0.206 5)、中肋骨条藻(= 0.020 6)等(表1和图2)。
2次调查都鉴出了凯伦藻,其最高丰度约4×104cells/L,未达到凯伦藻赤潮的基准线(图6)。较高凯伦藻丰度主要出现在DH9-0a、0 ~ 10 m等深线附近海域,4月较高值区在120.4°E-120.8°E附近海域,5月往外海稍微扩散。
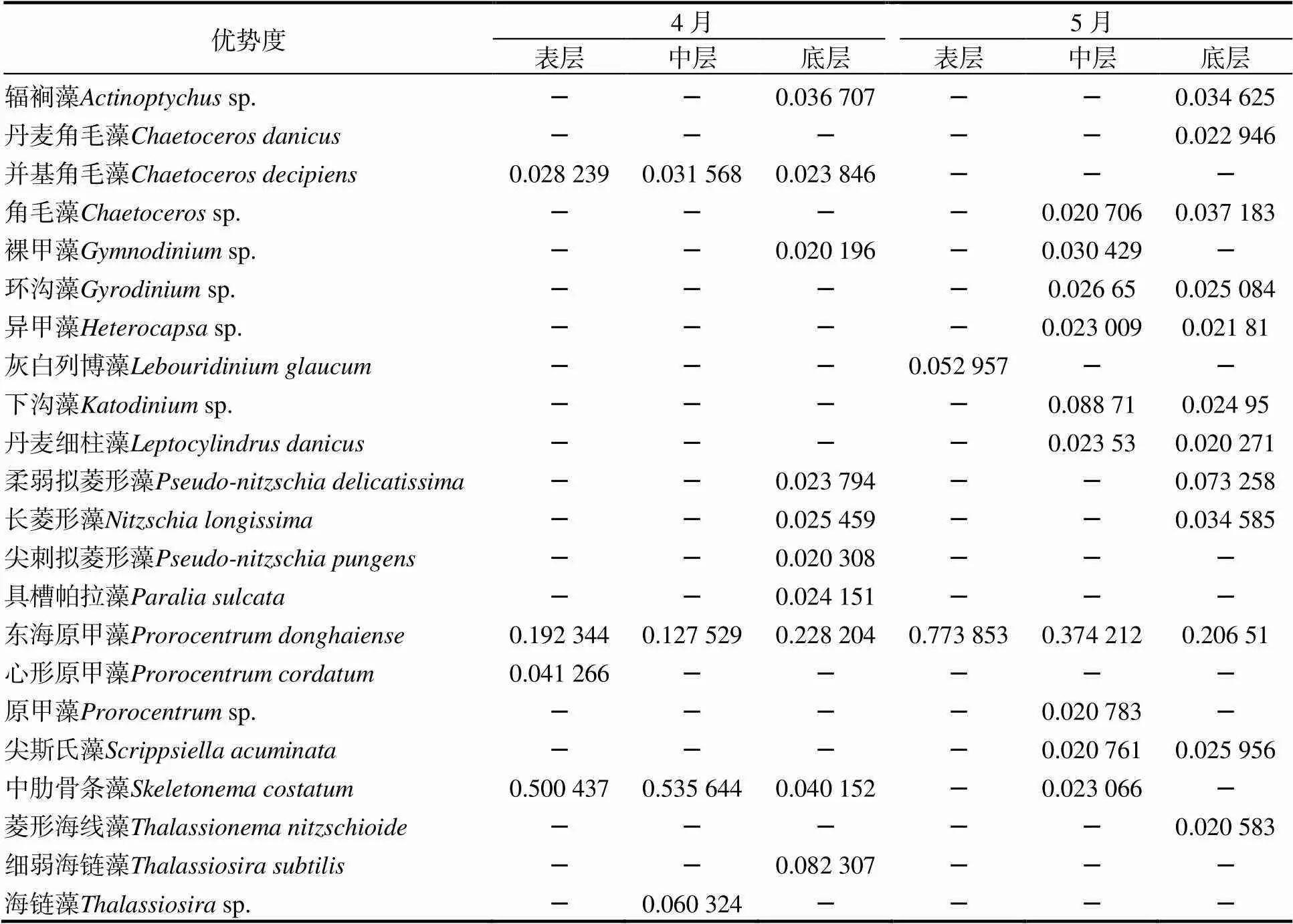
表1 2018年2次调查的浮游植物优势种情况
注:表格只显示优势种(优势指数≥0.02为优势种)
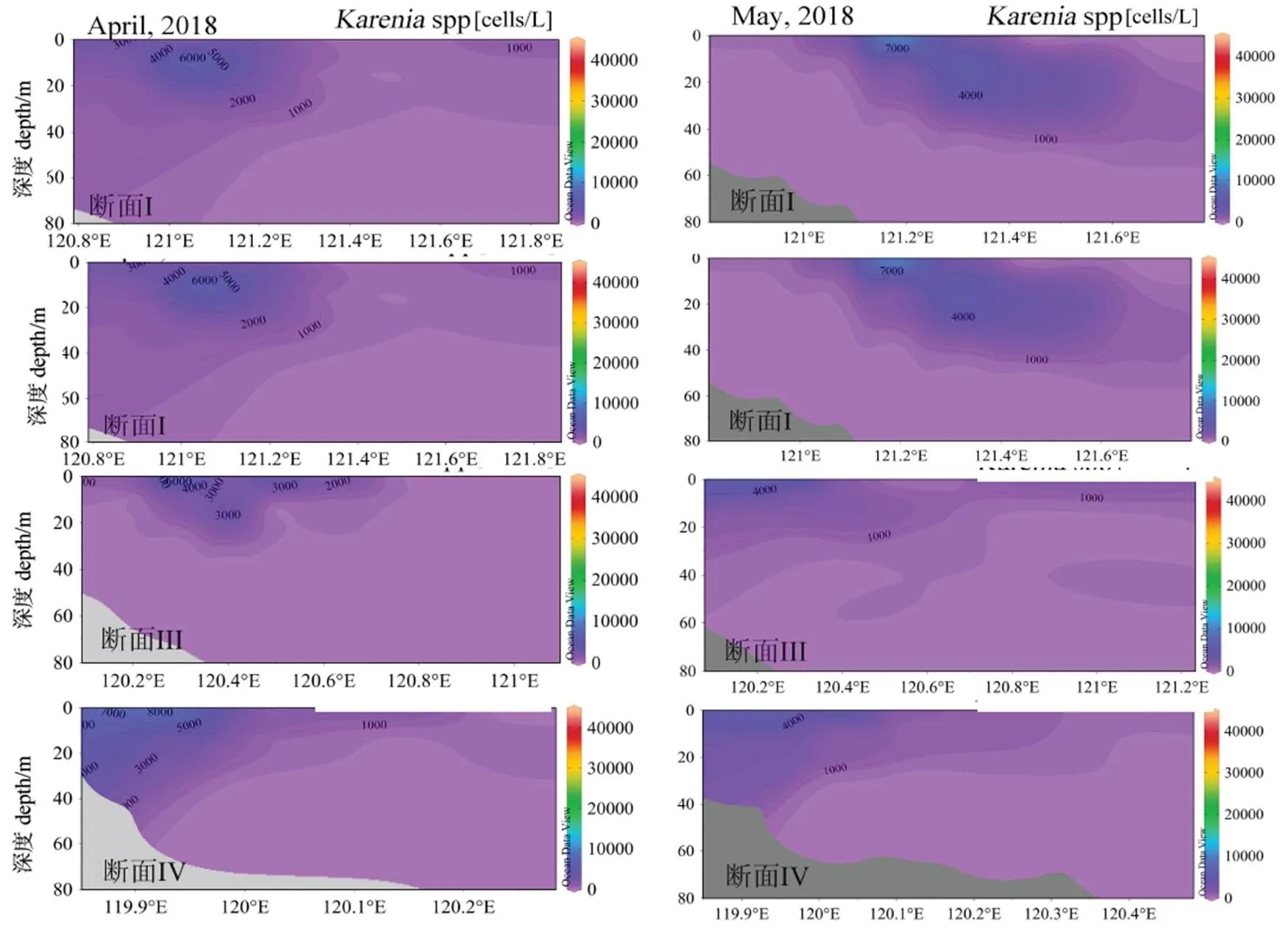
图6 2018年2次调查的凯伦藻丰度剖面
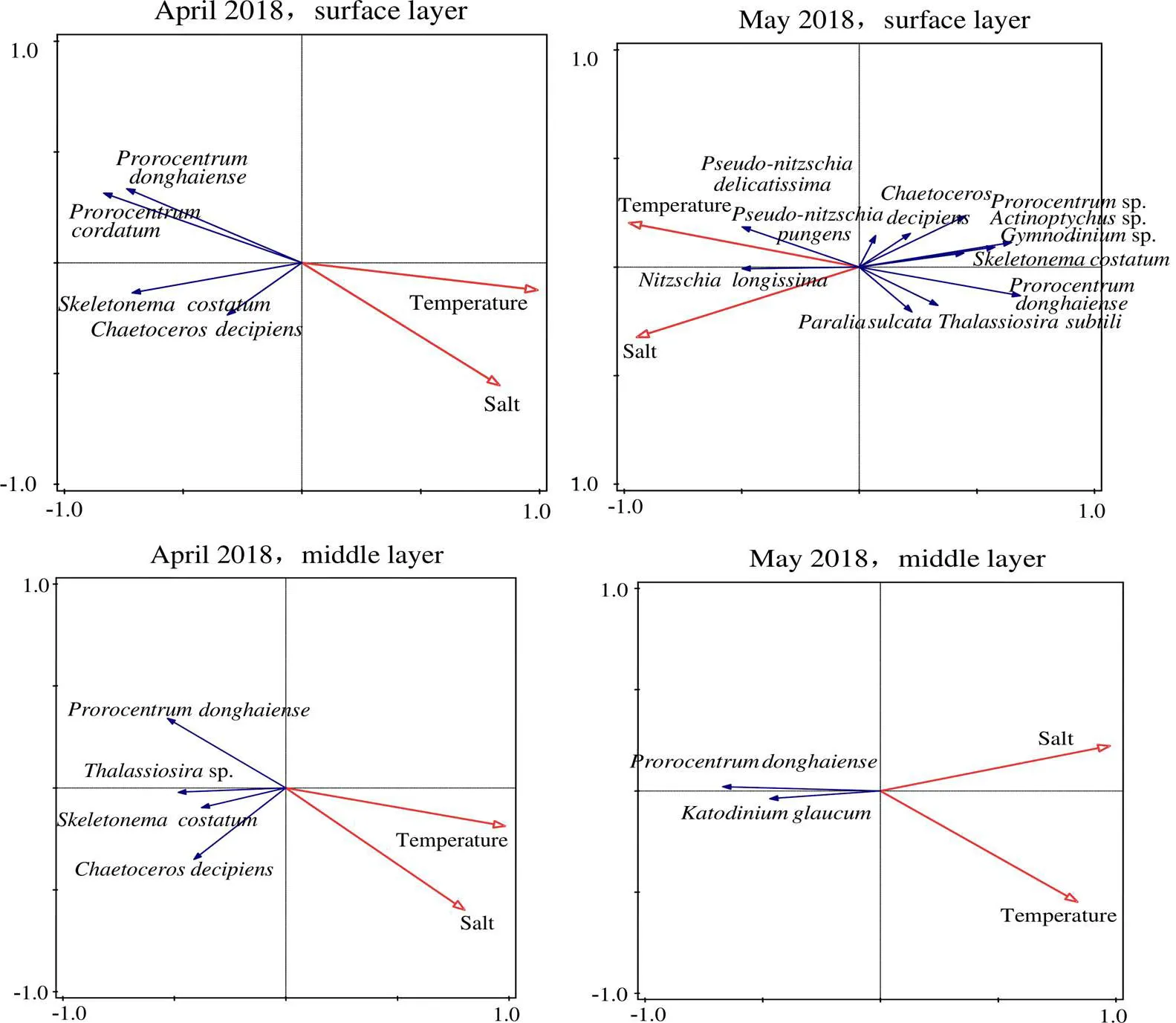
对不同水层浮游植物的优势种和温盐组成数据进行Redundancy analysis(RDA)排序分析(表2,图7),发现在2018年4月温度对优势种具有显著性影响;5月盐度对表底层的浮游植物优势种具有显著性影响。4-5月(图8),各水层温度普遍增高,特别是表层最高温度达26℃;调查海域水体层化现象明显,119.5°E -121°E海域的表层盐度增加至34( psu)。

表2 2018年2次调查的浮游植物与温盐相关性分析
注:Explains为解释值,< 0.05,显著性影响。
3 讨论
3.1 福建近海赤潮原因种的演替和分布
福建近海全年都有发生赤潮(12月除外)[3],4-6月是赤潮灾害的高发期[16-17]。2001-2008年在福建近海中肋骨条藻赤潮引发36起赤潮,高发期是5-7月,主要发生在闽江、罗源、黄岐、平潭、定海等海域;2001-2010年在福建近海东海原甲藻引发41起赤潮,主要发生于4-6月(高发期5月)平潭、黄岐、闽东等沿海海域[3-4, 18-19]。2018年调查研究显示(图2和4),4月发生了中肋骨条藻和东海原甲藻赤潮,赤潮数量级是106cells/L,影响范围在0 ~ 10 m等深线,发生赤潮海域为120.482°E-120.644°E/26.812°N -26.8858°N。5月只有表层发生了东海原甲藻赤潮,赤潮数量级是107cells/L,赤潮站位主要是DH8-1b(121.185°E/ 27.1233°N)和DH9-0a(120.644°E/26.812°N),赤潮呈从福鼎近海往苍南近海的东北方向移动趋势。
温度和水体稳定性是影响赤潮发生的2个重要因子[20]。中肋骨条藻和东海原甲藻最适增殖的温盐范围是20 ~ 27℃和25 ~ 35 psu、22 ~ 28℃和18 ~ 35.7 psu[21-25],本研究显示温盐变化趋势:4月至5月,水温上升,4月高温(≥24℃)海域主要在120.7°E-121.5°E,5月整个调查海域温度都大于20℃,特别是120.0°E -122°E海域温度大于24℃;2次调查的较高温盐海域都在中肋骨条藻和东海原甲藻最适增殖范围内,适合这2种藻的生长繁殖。同时,5月水体层化现象明显,稳定的水体促进了赤潮发生[20, 26](图8)。通过温度、盐度比较中肋骨条藻和东海原甲藻的生长,发现盐度对中肋骨条藻的影响较小,在同等条件下,中肋骨条藻的生长率高于东海原甲藻的生长率,但是中肋骨条藻具有达到饱和生长度后快速衰败的特点;而东海原甲藻在缺少营养盐条件下依然可维持较高的细胞丰度[24]。
据往年调查可知,该海域赤潮高发的主要原因有:东北季风衰退、西南季风逐渐强盛,沿海海风、海浪较弱;水温迅速上升;内陆气旋入海和雨季增加沿海湿度;向岸流推动营养物质聚集在沿海等[16,27]。这些研究显示该区域赤潮的根本影响因子还是温度和水体稳定性。季风影响水流,降雨影响水体盐度,两者都会进而影响水体层化,所以我们的结果和以往的研究较为一致。
3.2 福建近海赤潮期浮游植物优势种群结构变化
本研究显示春季福建近岸优势种群从硅藻为主演变为甲藻为主,与以往研究结果一致:东海赤潮过程中,存在硅藻-甲藻-硅藻演替的趋势,4、9月和10月的优势种主要是硅藻,甲藻成为优势种则是在5月和6月[28]。1997-2000年,在23.5°N - 33°N/118.5°E -128°E海域调查显示春季主要优势种是洛氏角毛藻和夜光藻[29]。2010年5月在宁德沿岸海域东海原甲藻占绝对优势[30]。2011年5月在莆田沿岸海域主要优势种是旋链角毛藻、丹麦细柱藻、笔尖根管藻、中肋骨条藻[30]。本研究着重分析在119.5°E- 122.5°E /25° N - 28° N海域各水层浮游植物种群结构变化,4月表中层优势种比较单一,主要优势种有中肋骨条藻、东海原甲藻、并基角毛藻等;底层优势种主要是东海原甲藻、细弱海链藻、中肋骨条藻、辐裥藻等。5月表层优势种只有东海原甲藻和灰白列博藻;中层优势种较4月有所增加,且有7个甲藻优势种,主要优势种是东海原甲藻、下沟藻、裸甲藻、丹麦细柱藻、异甲藻等;底层优势种群丰富,硅藻物种数最多,但增加了甲藻优势种数,主要优势种是东海原甲藻、柔弱拟菱形藻、角毛藻、辐裥藻、长菱形藻、尖斯氏藻等。赤潮的发生会降低浮游植物生物多样性,还会影响浮游植物优势种群大小,虽然底层依然是硅藻优势种最多,但从甲藻优势种增加趋势看,可推测底层也有硅藻向甲藻演替的趋势。
温度常常被认为是海洋浮游植物群落演替的主要影响因子[4,31],如1997-2000年,对东海23.5°N-33°N/118.5°E -128°E海域调查显示水温是影响浮游植物数量的主要因子,秋季盐度对浮游植物数量有较显著的影响[29]。本研究分析结果显示4月温度对浮游植物有显著性影响,5月各水层温度普遍增高;5月盐度对表底层浮游植物有显著性影响,但4-5月除119.5°E -121°E海域的表层盐度上升至34 psu,整体盐度值变化不大(图8),断面I、II盐跃层与0 ~ 20 m等深线平行,水体层化现象明显,所以5月盐度主要作为水体层化的表征[24-25]。层化具有引起浮游植物积累效应[32],也能通过影响营养盐的分布来影响浮游植物的分布[33],与硅藻和甲藻藻华演替以及优势种的演替趋势有关[34-35],如2010-2011年东海藻华高发区水体层化促进东海原甲藻藻华的发生[26];2011年春季长江口邻近海域硅藻和甲藻藻华与水体层化的关系,甲藻藻华出现在温、盐跃层相对较弱的近岸海域,表层海水温度明显上升[35],相比之下,本次调查5月甲藻藻华出现在盐跃层相对较强的近岸海域(图8)。
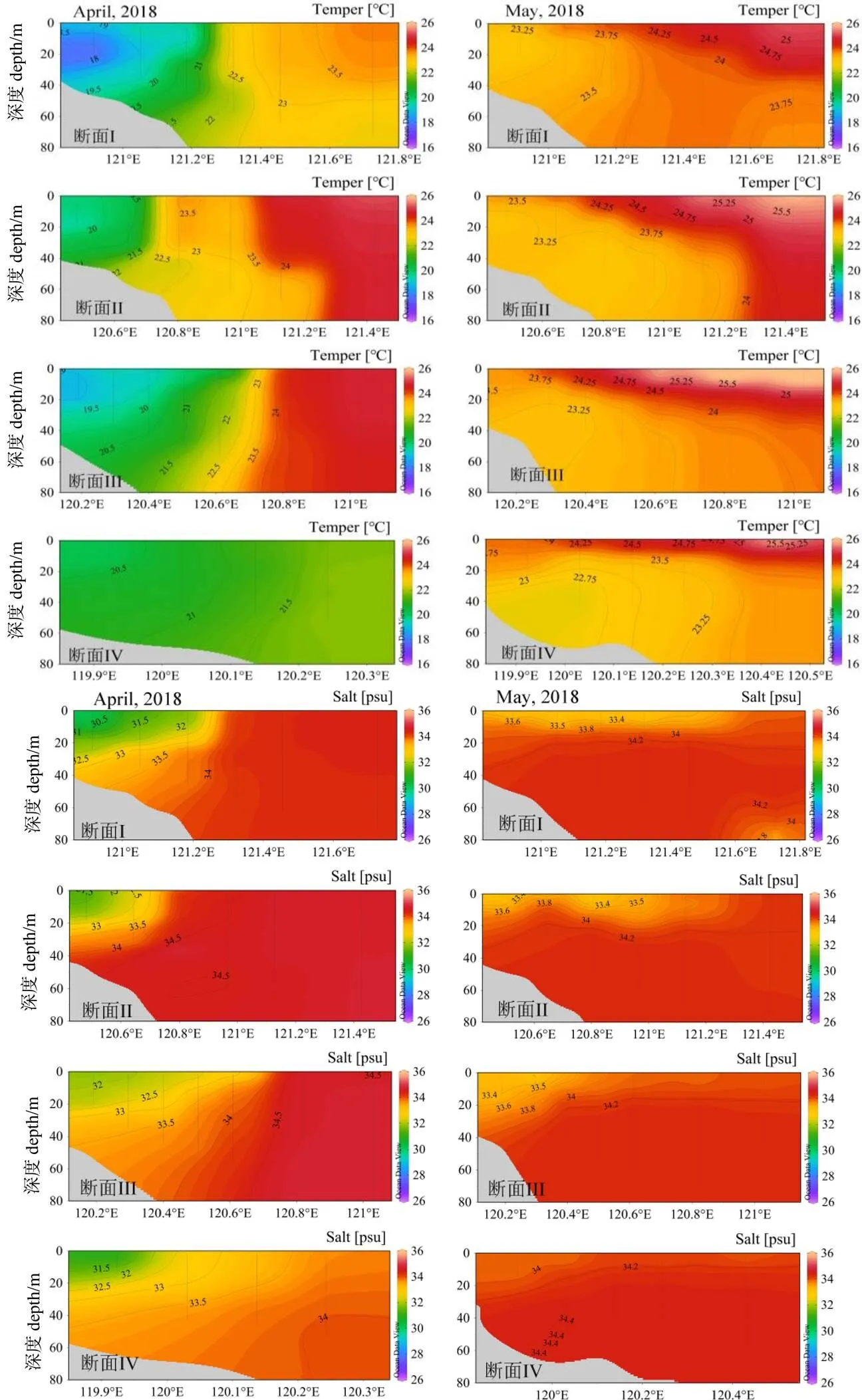
图8 2018年2次调查的海水温盐剖面
4月至5月,温度普遍升高、东高西低趋势,在断面III、IV处温跃层与0 ~ 20 m等深线平行,在断面II 120.4°-120.8°E海域的丰度变化最大——硅藻丰度和优势种数降低,甲藻丰度和优势种数大幅度增加,与2015-2016年长江口邻近海域甲藻群落调查结果相似——随着温度上升,甲藻丰度和多样性增大[36]。
结合温盐分析,推测4-5月该海域浮游植物群落结构变化的主要原因是温度和水体层化。
4 结论
2018年福建附近海域2次调查得出以下结论:
(1)4月至5月,福建附近海域从中肋骨条藻和东海原甲藻双相赤潮变为东海原甲藻单一赤潮。
(2)4月至5月,福建附近海域浮游植物优势种群由硅藻为主转为甲藻为主。
(3)4月至5月,表中层细胞丰度从硅藻占优逐渐演变成甲藻占优,底层丰度变化差异小。
(4)4月至5月,推测该海域浮游植物群落结构变化的主要原因是温度和水体层化。
感谢“创新一号”全体船员对采样的大力帮助!
[1] 费鸿年. 发生赤潮的原因[J]. 学艺, 1952, 22(1): 1-3.
[2] TANG D L, DI B P, WEI G, et al. Spatial, seasonal and species variations of harmful algal blooms in the South Yellow Sea and East China Sea[J]. Hydrobiologia, 2006, 568(1): 245-253.
[3] 李雪丁. 福建沿海近10a赤潮基本特征分析[J]. 环境科学, 2012, 33(7):2210-2216.
[4] 许翠娅, 黄美珍, 杜琦. 福建沿岸海域主要赤潮生物的生态学特征[J]. 台湾海峡, 2010, 29(3): 434-441.
[5] PAERL H W. Coastal eutrophication and harmful algal blooms: Importance of atmospheric deposition and groundwater as “new” nitrogen and other nutrient sources[J]. Limnology & Oceanography, 1997, 42(5 part 2): 1154-1165.
[6] TANG D L, KESTER D R, Ni I, et al. In situ and satellite observations of a harmful algal bloom and water condition at the Pearl River estuary in late autumn 1998. Harmful Algae, 2003, 2(2): 89-99.
[7] TANG D L, NI I H , F.E. Müller-Karger, et al. Monthly variation of pigment concentrations and seasonal winds in China's marginal seas[J]. Hydrobiologia, 2004, 511(1): 1-15.
[8] 许建平. 浙江近海上升流区冬季水文结构的初步分析[J]. 东海海洋, 1986, 4(3): 22-28.
[9] 赵保仁. 长江口外的上升流现象[J]. 海洋学报, 1993, 15(2): 108-114.
[10] 亢振军. 东海赤潮区沉积物中有机质来源及其与浮游植物群落关系初探[D]. 中国科学院研究生院(海洋研究所), 2013.
[11] 欧祥亚. 米氏凯伦藻赤潮对东海养殖鱼类鳃组织结构损害作用的研究[D]. 广州:暨南大学, 2006.
[12] 王朝晖, 尹伊伟, 齐雨藻, 等. 珠海桂山岛米氏裸甲藻赤潮对鱼鳃损伤的病理学组织观察[J]. 海洋学报(中文版), 2001, 23(1): 133-138.
[13] 吕颂辉, 岑竞仪, 王建艳, 等. 我国米氏凯伦藻()藻华发生概况、危害及其生态学机制[J]. 海洋与湖沼, 2019, 50(3): 487-494.
[14] 张腾飞, 颜天, 张清春, 等. 几种典型有害藻对皱纹盘鲍急性毒性及其抗氧化酶活性的影响[J]. 海洋环境科学, 2018, 37(2): 207-214.
[15] 陈宝红, 谢尔艺, 高亚辉, 等. 米氏凯伦藻对海洋生物致毒作用的研究进展[J]. 福建水产, 2015, 37(3): 241-249.
[16] 谢欣, 陶爱峰, 张尧, 等. 福建省典型海洋灾害时空分布特性研究[J]. 海洋湖沼通报, 2018, 163(4): 23-32.
[17] 许珠华, 侯建军. 福建沿岸海域赤潮发生特点及防治措施[J]. 台湾海峡, 2006, 25(1): 143-150.
[18] 郑炳锋, 刘炜明. 福州近海海域赤潮灾害及预警管理[J]. 中国水产, 2010, 28(5): 113-117.
[19] 李荣茂. 福建省沿岸赤潮生物——东海原甲藻生态探讨[J]. 海洋环境科学, 2009, 28(S1): 65-69.
[20] 戴鑫烽, 陆斗定, 夏平, 等. 2010-2011年东海藻华高发区水体层化对东海原甲藻(Lu)藻华的影响[J]. 海洋与湖沼, 2014, 45(2): 217-224.
[21] 李金涛, 赵卫红, 杨登峰, 等. 长江口海水盐度和悬浮体对中肋骨条藻生长的影响[J]. 海洋科学, 2005, 29(1): 34-37.
[22] 霍文毅, 俞志明, 邹景忠, 等. 胶州湾中肋骨条藻赤潮与环境因子的关系[J]. 海洋与湖沼, 2001, 32(3): 311-318.
[23] XU N, DUAN S S, LI A F, et al. Effects of temperature, salinity and irradiance on the growth of the harmful dinoflagellateLu[J]. Harmful Algae, 2010, 9(1): 13-17.
[24] 陈炳章, 王宗灵, 朱明远, 等. 温度、盐度对具齿原甲藻生长的影响及其与中肋骨条藻的比较[J]. 海洋科学进展, 2005, 23(1): 60-64.
[25] 霍文毅, 俞志明, 邹景忠, 等. 胶州湾中肋骨条藻赤潮与环境因子的关系[J]. 海洋与湖沼, 2001, 32(3): 311-318.
[26] SMAYDA T J. Turbulence, watermass stratification and harmful algal blooms: an alternative view and frontal zones as “pelagic seed banks”[J]. Harmful Algae, 2002, 1(1): 95-112.
[27] HELLERMAN S, ROSENSTEIN M. Normal monthly wind stress over the world ocean with error estimates. Journal of Physical Oceanography, 1983, 13(7): 1093-1104.
[28] 丁东生, 石晓勇, 李京, 等. 东海赤潮高发区营养盐结构月际变化分析[C]. 中国环境科学学会学术年会, 2009: 498-503.
[29] 罗民波, 陆健健, 王云龙, 等. 东海浮游植物数量分布与优势种[J]. 生态学报, 2007, 27(12): 5076-5085.
[30] 叶又茵. 福建沿岸港湾浮游植物的多样性[D]. 厦门:国家海洋局第三海洋研究所, 2013.
[31] 林更铭, 项鹏, 杨清良, 等. 厦门海域水华期间浮游植物群落演替及其与环境因子的关系[J]. 应用与环境生物学报, 2013, 19(1): 126-133.
[32] MENA C, REQLERO P, HIDALQO M, et al. Phytoplankton community structure is driven by stratification in the Oligotrophic Mediterranean Sea[J]. Frontiers in Microbiology, 2019, 10: 1698.
[33] 朱建荣. 长江口外海区叶绿素a浓度分布及其动力成因分析[J]. 中国科学:地球科学, 2004, 34(8): 757-762.
[34] YIN K. Influence of monsoons and oceanographic processes on red tides in Hong Kong waters[J]. Marine Ecology Progress Series, 2003, 262: 27-41.
[35] 周正熙, 于仁成, 吕颂辉, 等. 长江口邻近海域春季藻华与水体层化的关系[J]. 海洋与湖沼, 2016(6): 1166-1175.
[36] 陈田田, 宋书群, 刘云, 等. 2015-2016年长江口及其邻近海域甲藻群落与阿米巴藻感染的周年变化[J]. 海洋与湖沼, 2019, 50(1): 143-152.
Variation of Phytoplankton Community Structure in the Coastal Water of Fujian in Spring 2018
ZENG Yu-lan1,2, LU Dou-ding1,2, WANG Peng-bin1,2, GUO Ruo-yu1,2, GUAN Wei-bing2, DAI Xin-feng1,2
(1.,,// 2.,,, 310012,)
Study the variation of phytoplankton community structure in the Coastal water of Fujian in spring 2018.We conducted two comprehensive surveys in the coastal water of Fujian in April and May,2018, respectively. And then we analyzed the succession of the red tides, the distribution of phytoplankton and the variation of the community structure.Results showed that red tides causative species varied fromandtofrom April to May. Bloom density ranged from 106to 107cells/L. Shannon-wiener diversity index of phytoplankton was lower in the waters around red tides. The variation of abundance in surface and middle layers was large, while that in bottom layer was small. Meanwhile, the main dominant phytoplankton populations succeeded from diatoms to dinoflagellates.
HABs; red tidescausative species; biodiversity; succession
Q948.8
A
1673-9159(2020)02-0053-11
10.3969/j.issn.1673-9159.2020.02.008
2019-07-29
自然资源部第二海洋研究所英才计划项目(QNYC201502);浙江省自然科学基金(LY19D060007);国家自然科学基金(41406173;41876139;41706191);海洋公益性行业专项(201505001);自然资源部第二海洋研究所所长专项团队项目(JT1803);自然资源部“赤道东印度洋和孟加拉湾海洋与生态研究计划”
曾宇兰(1994-),女,硕士研究生,主要从事浮游植物生态研究。E-mail:1823677998@qq.com
戴鑫烽(1982-),男,副研究员,主要从事海洋生态研究。E-mail:xinfengdai@sio.org.cn
曾宇兰,陆斗定,王鹏斌,等. 2018年春季福建近海浮游植物群落结构变化[J]. 广东海洋大学学报,2020,40(2):53-63.
(责任编辑:刘岭)

