基于NLRP3/caspase-1通路研究丹参提取物对系膜增生性肾小球肾炎大鼠的保护作用
邱鹏 倪晓娜
271100 济南,济南市人民医院肾病风湿科
系膜增生性肾小球肾炎(mesangial proliferative glomerulonephritis,MsPGN)是临床上一种最常见的原发性肾小球疾病,约占所有原发性肾小球肾炎病理类型的50%,多见于青壮年,其高发年龄为20~39岁[1]。MsPGN发病机制复杂,临床难以治愈,是引起肾小球硬化的主要原因之一,严重时会导致肾衰竭,给患者带来很大的心理压力及经济负担[2]。
中医认为脏腑虚损为本虚,湿热毒疲为标实是MsPGN的基本病机,治疗关键是活血化瘀、清热解毒、补益脾肾[3]。丹参具有清热化瘀、消炎抗菌、抗氧化等药理作用,在临床中较为广泛地用于治疗肾脏疾病[4],可治疗早期糖尿病肾病,改善患者的临床症状[5]。丹参注射液可降低MsPGN患儿血清中肿瘤坏死因子-α、Ⅳ型胶原水平,对治疗小儿MsPGN具有较好的疗效[6],但其作用机制目前还不完全清楚。
核苷酸结合寡聚结构域受体3[nucleotide-binding oligomerization domain(Nod)-like receptor 3,NLRP3]炎性小体参与介导机体多种炎症反应,当其激活时,可使半胱天冬蛋白酶-1前体(pro-caspase-1)裂解为半胱天冬蛋白酶-1(caspase-1),在肾脏炎症反应中发挥着重要作用,下调NLRP3/caspase-1通路,可抑制炎症引起的细胞凋亡,保护肾组织[7-8]。曹澜澜等[9]在对短暂性脑缺血大鼠的研究中发现,复方丹参滴丸可通过抑制NLRP3/caspase-1通路减轻大鼠脑组织炎症,降低脑损伤,表明NLRP3/caspase-1信号可能是丹参治疗MsPGN的作用机制。本文通过使用NLRP3炎性小体抑制剂处理MsPGN大鼠,探讨丹参提取物对MsPGN大鼠肾脏的保护作用及其作用机制。
材料与方法
一、实验材料
1.实验动物 雄性SD大鼠(SPF级)购自河南省实验动物中心,许可证号:SCXK(豫)2015-0004,质量合格证号:41003100003162。在清洁安静的环境中饲养大鼠,自然光照,自由饮食、饮水,温度为25 ℃左右,相对湿度为50%左右,噪音小于80分贝,保持饲养环境通风良好,定时更换垫料及清理、消毒鼠笼。
2.主要试剂与仪器 丹参饮片购自北京同仁堂(货号:A29400170363);VX-765(NLRP3炎性小体抑制剂)购自美国Selleck生物科技有限公司(货号:S2228);GAPDH、NLRP3、caspase-1引物由上海生工生物工程股份有限公司合成;弗氏完全佐剂(complete Freund’s adjuvant,CFA)、牛血清白蛋白(bovine serum albumin,BSA)购自美国simga公司(货号分别为:9007-81-2、738328);尿蛋白定量试剂盒、尿素氮(BUN)试剂盒、血肌酐(Scr)试剂盒购自南京建成生物工程研究所(货号分别为:20090512、20090619、20090618);白细胞介素(interleukin,IL)-18及IL-1β ELISA试剂盒、兔源GAPDH、NLRP3、caspase-1一抗、羊抗兔二抗购自美国Abcam公司(货号分别为:ab213909、ab100768、ab181602、ab232401、ab179515、ab150077);SDS-PAGE凝胶制备试剂盒、TBST缓冲液购自北京索莱宝公司(货号分别为:P1200、T1081、L8880);RNAiso Plus、逆转录试剂盒、荧光定量PCR试剂盒购自日本Takara公司(货号分别为:9108、RR037Q/A/B、639519);RIPA裂解液、BCA试剂盒、HE染色试剂盒购自上海碧云天公司(货号分别为:P0013K、P0011、C0105)。
酶标仪购自美国Perkin Elmer公司(型号:Elx800);蛋白电泳仪、转膜仪、荧光定量PCR仪购自美国Bio-Rad公司(型号分别为:1659001、Trans-Blot SD、CFX96 Touch Deep Well);高通量DNA合成仪购自美国应用生物系统公司(型号:3900);低温高速离心机购自德国Eppendorf股份公司(型号:Centrifuge 5424R);轮转切片机、包埋机、烤片机购自德国Leica公司(型号分别为:RM2035、EG1160、HI1220);生物显微镜购自日本尼康公司(型号:YS-100);凝胶成像系统购自上海天能公司(型号:2500)。
二、方法
1.动物模型的建立及分组给药 参照文献[10]的方法制备大鼠模型:SD大鼠以30 mg/kg的剂量腹腔注射2%戊巴比妥钠麻醉,消毒后切除左侧肾脏后缝合,1周后将3 mg BSA与0.1 mL CFA混匀后足垫皮下注射,每周1次,持续3周;第3周末,每只大鼠连续4次腹腔注射BSA,剂量分别为0.5、1.0、1.5、3.0 mg,次日早晨重新注射一次,剂量为0.5 mg/只。之后每日腹腔注射BSA,剂量从0.5 mg开始,每日增加0.5 mg至5 mg,以5 mg/只的剂量每日腹腔注射1周后,以6 mg/只的剂量每日再腹腔注射1周,依此每周增加1 mg至10 mg。共造模48只,分为模型组、丹参提取物组、VX-765组、丹参提取物+VX-765组,每组12只。另取12只大鼠作为假手术组,只暴露左肾不摘除,并以相同方法经足垫皮下、腹腔注射相应量的生理盐水。
10倍质量75%乙醇浸泡丹参饮片1 h,利用回流装置加热回流30 min,过滤后收集溶液,重复3次。将3次溶液合并后减压干燥,得到的丹参提取物浸膏纯化水洗涤5次,然后喷雾干燥即可得固态丹参提取物,以高效液相色谱法检测丹参酮ⅡA含量为2.396%[11],参照文献进行剂量换算,加生理盐水配制成浓度为0.15 g/mL的丹参提取物溶液。VX-765溶于二甲基亚砜(dimethyl sulfoxide,DMSO)中制成溶液。丹参提取物+VX-765组每日给予丹参提取物(10 mL/kg)灌胃,并给予VX-765(50 mg/kg)腹腔注射[12-13];丹参提取物组每日给予丹参提取物(10 mL/kg)灌胃,并腹腔注射等剂量DMSO;VX-765组每日给予VX-765(50 mg/kg)腹腔注射,并灌胃等剂量生理盐水;模型组和假手术组每日腹腔注射等剂量DMSO并灌胃等剂量生理盐水,各组均持续给药28 d。
2.标本采集及大鼠肾组织损伤情况检测 末次给药结束24 h后,各组大鼠单独置于代谢笼中,分别收集24 h尿液储存在-20 ℃冰箱中备用;分别经尾静脉取血1.5 mL,3 000 r/min,4 ℃离心15 min,取上清(血清)储存在-20 ℃冰箱中备用。各组大鼠麻醉后处死,解剖取出肾组织,剪取约1 g储存于-80 ℃中备用,其余肾组织以生理盐水漂洗干净,以4%多聚甲醛固定、从低浓度至高浓度的梯度酒精脱水、二甲苯透明后,浸蜡进行石蜡包埋,以切片机做病理切片,将可用的切片经脱蜡、梯度酒精(从高到低)处理后,浸泡在纯化水中,按照说明书的步骤,以苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒进行染色,然后再次脱水、透明,最后以中性树胶封片,采用光学显微镜观察肾组织病理改变情况并任选5个视野拍照,根据肾小球系膜细胞增殖程度、肾小管-间质病变程度进行评分。
肾小球系膜细胞增殖程度评分标准[14]:无增殖(每系膜区系膜细胞<3个)记为0分;局灶节段轻度增殖(<50%肾小球,每系膜区系膜细胞3~5个)记为1分;弥漫轻度增殖(>50%肾小球,每系膜区系膜细胞3~5个)记为2分;弥漫轻度增殖的基础上出现局灶节段显著增殖(>50%肾小球,每系膜区系膜细胞>5个)记为3分;弥漫显著增殖(>50%肾小球,每系膜区系膜细胞>5个)记为4分。肾小管-间质病变程度评分标准[14]:无病变记为0分;轻度局灶变性记为1分;中度局灶或轻度弥漫变性记为2分;弥漫中度以上变性记为3分。
3.尿蛋白含量、血清BUN、Scr、IL-1β及IL-18水平测定 取各组大鼠尿液、血清在4 ℃下解冻,采用各自的试剂盒测定尿蛋白含量、血清BUN、Scr、IL-1β及IL-18水平,具体操作步骤按照试剂盒说明书进行。
4.肾组织中NLRP3、caspase-1 mRNA水平的检测 取各组大鼠冻存的肾组织约0.5 g剪碎,使用RNAiso Plus提取总RNA,逆转录试剂盒将其逆转录成cDNA后,以荧光定量PCR试剂盒后进行荧光定量PCR反应,具体操作步骤、反映体系的配制、反应条件的设定按照说明书进行,使用GADPH作为内参基因,数据以2-ΔΔCt算法进行分析处理,qRT-PCR引物序列见表1。
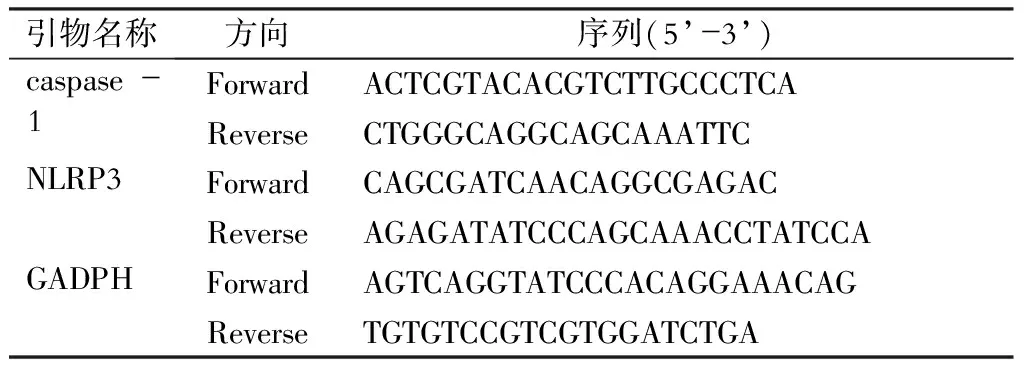
表1 qRT-PCR引物序列
5.肾组织中NLRP3、caspase-1蛋白水平的检测 取各组大鼠冻存的肾组织约0.5 g剪碎,加入预冷的蛋白裂解液(添加蛋白酶抑制剂),匀浆机制备为匀浆液,3 000 r/min,4 ℃离心20 min,取上清液(总蛋白)转移至做好标记的Ep管中,按照说明书的步骤,以BCA试剂盒测定各组样品总蛋白浓度,根据测定结果各组分别取含有相同质量总蛋白的样品液进行SDS-PAGE电泳,采用转膜仪转移全部蛋白至聚偏二氟乙烯膜上,浸泡在5%的脱脂奶粉中,室温封闭2 h,根据目的蛋白分子量截取蛋白条带,将其置于小盒中,分别加入相应一抗,4 ℃孵育过夜,TBST漂洗后,加入羊抗兔二抗,室温孵育2 h,TBST漂洗后,使用化学发光试剂显色,以凝胶成像系统拍摄图像并使用Tanon软件分析各组蛋白的相对表达量。
三、统计学处理

结 果
一、各组大鼠24 h尿蛋白含量、血清中Scr及BUN水平比较
与假手术组相比,模型组大鼠24 h尿蛋白含量、血清中Scr及BUN水平显著升高(P<0.05);与模型组比较,丹参提取物组、VX-765组、丹参提取物组+VX-765组大鼠24 h尿蛋白含量、血清中Scr及BUN水平均显著降低(P<0.05);与丹参提取物组及VX-765组分别比较,丹参提取物+VX-765组大鼠24 h尿蛋白含量、血清中Scr及BUN水平均显著降低(P<0.05)。(表2)

表2 各组大鼠24 h尿蛋白含量、血清中Scr及BUN水平比较
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与丹参提取物组比较,cP<0.05;与VX-765组比较,dP<0.05
二、各组大鼠肾组织损伤情况比较
假手术组大鼠肾组织结构清晰正常。与假手术组比较,模型组大鼠肾脏呈现肾小球体积变大、内部细胞数量增多,系膜细胞弥漫性增生、细胞基质增多、肾间质有炎性细胞浸润等病理损伤,肾小球系膜细胞增殖程度评分、肾小管-间质病理评分显著升高(P<0.05)。与模型组比较,丹参提取物组、VX-765组、丹参提取物组+VX-765组大鼠上述病理损伤减轻,肾小球系膜细胞增殖程度评分、肾小管-间质病理评分显著降低(P<0.05);与丹参提取物组及VX-765组分别比较,丹参提取物+VX-765组大鼠上述病理损伤进一步减轻,肾小球系膜细胞增殖程度评分、肾小管-间质病理评分显著降低(P<0.05)。(图1、表3)
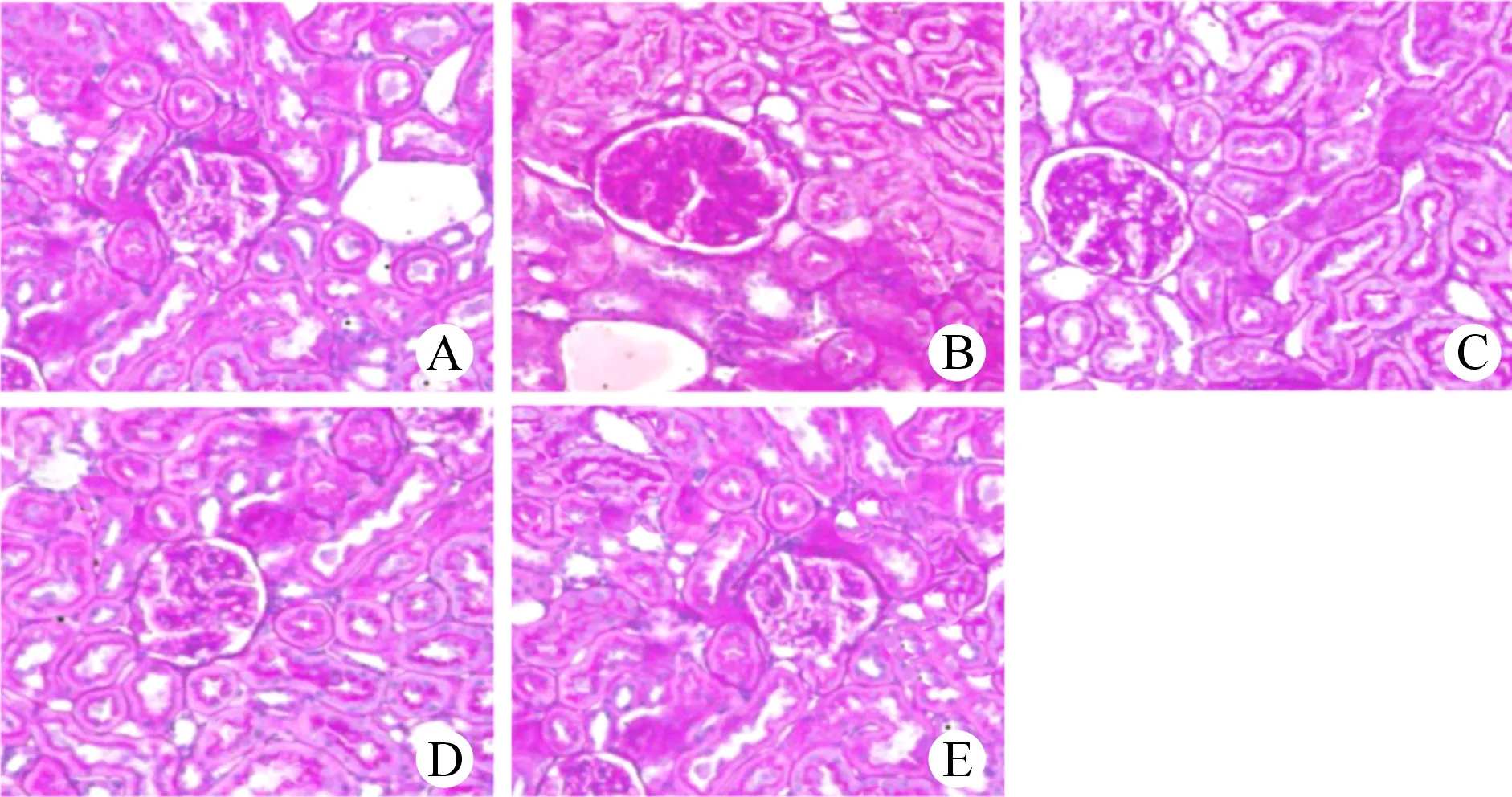
图1 各组大鼠肾组织病理形态学变化情况(HE,×400) A.假手术组;B.模型组;C.丹参提取物组;D.VX-765组;E.丹参提取物+VX-765组
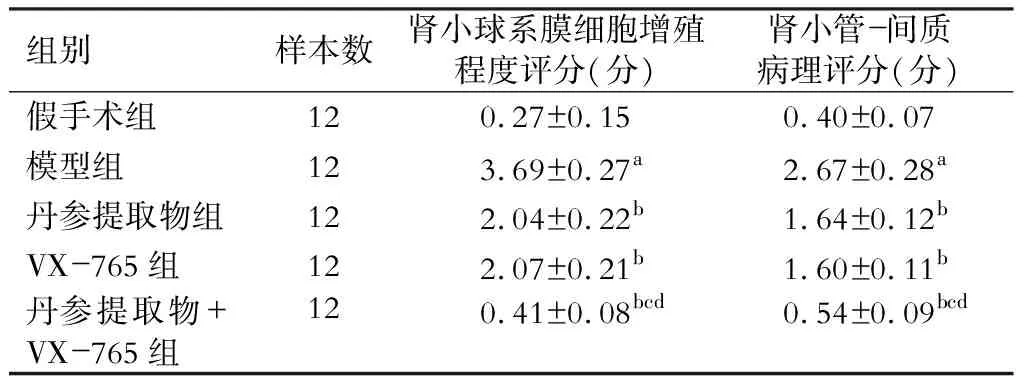
表3 各组大鼠肾小球系膜细胞增殖程度评分、肾小管-间质病理评分比较
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与丹参提取物组比较,cP<0.05;与VX-765组比较,dP<0.05
三、各组大鼠血清中IL-18、IL-1β水平比较
与假手术组相比,模型组大鼠血清中IL-18、IL-1β水平显著升高(P<0.05);与模型组比较,丹参提取物组、VX-765组、丹参提取物组+VX-765组大鼠血清中IL-18、IL-1β水平均显著降低(P<0.05);与丹参提取物组及VX-765组分别比较,丹参提取物+VX-765组大鼠血清中IL-18、IL-1β水平均显著降低(P<0.05)。(表4)
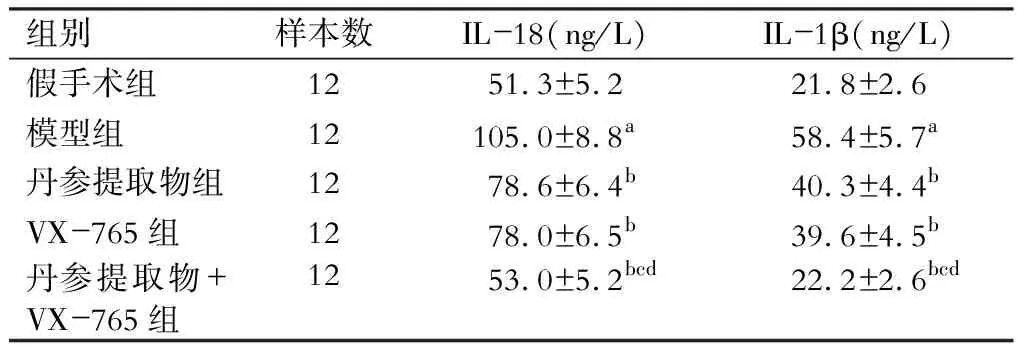
表4 各组大鼠血清中IL-18、IL-1β水平
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与丹参提取物组比较,cP<0.05;与VX-765组比较,dP<0.05
四、各组大鼠肾组织NLRP3、caspase-1 mRNA水平比较
与假手术组相比,模型组大鼠肾组织NLRP3、caspase-1 mRNA水平显著升高(P<0.05);与模型组比较,丹参提取物组、VX-765组、丹参提取物组+VX-765组大鼠肾组织NLRP3、caspase-1 mRNA水平均显著降低(P<0.05);与丹参提取物组及VX-765组分别比较,丹参提取物组+VX-765组大鼠肾组织NLRP3、caspase-1 mRNA水平均显著降低(P<0.05)。(表5)
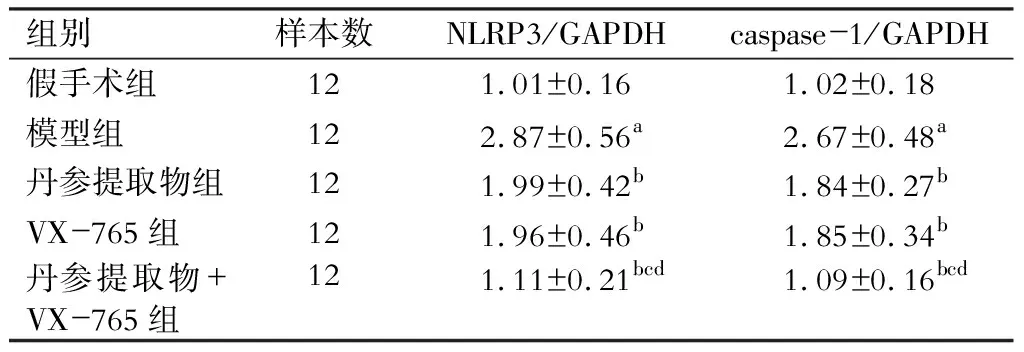
表5 各组大鼠肾组织NLRP3、caspase-1 mRNA相对表达量比较
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与丹参提取物组比较,cP<0.05;与VX-765组比较,dP<0.05
五、各组大鼠肾组织NLRP3、caspase-1蛋白表达比较
与假手术组相比,模型组大鼠肾组织NLRP3、caspase-1蛋白相对表达量显著升高(P<0.05);与模型组比较,丹参提取物组、VX-765组、丹参提取物组+VX-765组大鼠肾组织NLRP3、caspase-1蛋白相对表达量均显著降低(P<0.05);与丹参提取物组及VX-765组分别比较,丹参提取物组+VX-765组大鼠肾组织NLRP3、caspase-1蛋白相对表达量均显著降低(P<0.05)。(图2、表6)
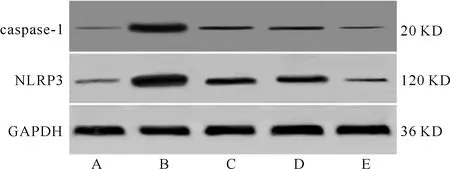
图2 各组大鼠肾组织NLRP3、caspase-1蛋白免疫印迹检测结果 A.假手术组;B.模型组;C.丹参提取物组;D.VX-765组;E.丹参提取物+VX-765组
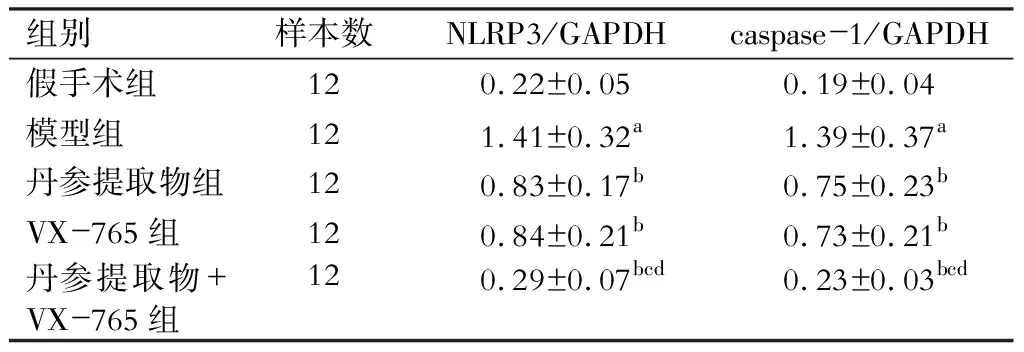
表6 各组大鼠肾组织NLRP3、caspase-1蛋白相对表达量比较
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与丹参提取物组比较,cP<0.05;与VX-765组比较,dP<0.05
讨 论
MsPGN是一种以肾小球弥漫性系膜细胞增生、不同程度的系膜基质增多为主要病理形态学特征的原发性肾小球肾炎,会引起肾间质纤维化、肾小球硬化,进而导致蛋白尿、血尿、肾病综合征、水肿、肾功能不全等多种临床症状,甚至导致慢性肾衰竭,严重威胁患者的生命健康[15],目前临床上治疗MsPGN以糖皮质激素、免疫抑制剂为主,但二者均疗程长、不良反应大[16],因此寻找更安全有效的药物是当前的临床研究热点之一。
中医理论认为,MsPGN的发病由肾虚湿癖引起,肾虚为本,湿热、癖血贯穿始终,癖去方能生新,故活血化癖,有利于气机条达,亦有助于肾阴、肾阳化生,是对MsPGN有效的中医治疗手段。研究发现丹参具有活血化瘀的功效,其活性成分主要有丹参酮、丹参酸、丹参乙醇等,其中丹参酮具有去纤、抗凝、降血脂及溶栓等作用,能修复肾组织病理损伤,可治疗MsPGN,改善患者临床症状,恢复肾功能[6,17],但其药理机制目前尚不清楚。本文通过建立MsPGN模型对此进行了初步研究,结果显示模型组大鼠肾组织出现肾小球体积变大、内部细胞数量增多,系膜细胞弥漫性增生、细胞基质增多,炎性细胞浸润肾间质等病理损伤症状,表明模型组大鼠肾组织发生严重炎症反应,显示系膜细胞及基质增生等典型的MsPGN病理特征。肾脏因炎症等出现功能损伤时,尿蛋白含量、血清BUN及Scr水平均会升高,其含量水平高低已成为判断肾功能受损程度的指标[18]。IL-1β、IL-18为机体细胞合成分泌的促炎因子,可与其受体IL-1R及IL-18R相结合,触发下游NF-κB依赖的一系列信号,导致机体严重的炎症反应[19]。本文结果显示模型组大鼠尿蛋白含量、血清BUN、Scr、IL-1β及IL-18水平明显升高,表明MsPGN大鼠血清促炎因子水平升高,引起大鼠炎症反应,肾功能受损,模型建立成功。
有研究表明激活NLRP3/caspase-1信号可促进炎症因子IL-1β、IL-18的合成分泌,并参与调节狼疮肾炎的发生和发展,通过抑制NLRP3/caspase-1信号,可减轻狼疮肾炎小鼠的炎症反应,改善其肾功能损伤症状[20]。而杨天然等[21]在对痤疮患者的临床研究中发现,丹参酮胶囊可降低患者NLRP3、caspase-1的表达,改善患者皮损情况,因而推测下调NLRP3/caspase-1信号可能是丹参提取物治疗MsPGN的药理机制。本文结果显示,经过丹参提取物或VX-765处理的大鼠肾组织病理损伤症状均减轻,24 h尿蛋白含量、血清BUN、Scr、IL-1β、IL-18、肾组织NLRP3及caspase-1表达均降低,表明下调NLRP3/caspase-1信号,可减轻肾脏炎症反应,修复肾损伤,改善肾功能,丹参提取物和VX-765处理作用相同,揭示NLRP3/caspase-1信号是治疗MsPGN的一个作用靶点。联合应用丹参提取物和VX-765处理大鼠后,大鼠肾组织病理损伤症状均减轻,24 h尿蛋白含量、血清BUN、Scr、IL-1β、IL-18、肾组织NLRP3及caspase-1表达均降低,表明丹参提取物和VX-765合用具有协同作用,可抑制NLRP3/caspase-1通路,减轻肾脏炎症反应,修复肾损伤,改善肾功能,对MsPGN大鼠的疗效更好,揭示下调NLRP3/caspase-1信号可能是丹参提取物治疗MsPGN的分子机制之一。
总之,丹参提取物可减轻肾脏炎症反应,修复肾损伤,改善肾功能,抑制NLRP3/caspase-1通路可能是其药理机制之一。但本文未上调NLRP3/caspase-1信号进行对照验证,证据不充分,存在不足,还需后续的进一步研究加以验证。

