生物样品中天麻素测定方法及药代动力学研究进展*
姜 丽,张启云,涂 珺,陈 雨,王玮玮,李 艳,徐国良**
(1. 江西中医药大学 中医基础理论分化发展研究中心 南昌 330004;2. 江西省中医病因生物学重点实验室 南昌 330004;3. 江西省中药药理学重点实验室 南昌 330004)
二十世纪七十年代,中科院周俊院士首次从兰科植物天麻中分离提取并确定了天麻素(gastrodin)化学结构(结构式见图1);二十世纪八十年代,昆明制药成功开发出人工合成天麻素,天麻素片和天麻素注射液相继上市,标志着我国第一个具有规模生产的结构合成天然药物的诞生。现代研究表明[1-8],天麻素具有镇痛、镇静安眠、保护神经元、降血压、抗惊厥、抗癫痫、抗氧化、抗衰老、改善微循环、改善记忆等多种药理作用。近年来,天麻素用于单独或辅助治疗心血管疾病(如高血压[9-10]、冠心病[11]等)、脑血管疾病(如脑卒中[12]、脑梗死[13]、脑瘫[14]、头痛[15]等)及神经精神系统疾病[16](如眩晕症[17]、突发性耳聋[18]、抑郁症[19]、神经衰弱[20]、帕金森病[21]、阿尔兹海默病[22]、认知障碍[23]和癫痫[24]等)。上述临床应用主要得益于其具有扩张血管、改善微循环、抑制炎症因子表达、抗氧化、保护神经元等作用[25-28]。考虑到临床上天麻素治疗上述疾病常与其他药物或治疗方法联用,故其体内过程及其药代动力学性质不容忽视。因此,本研究针对天麻素药代动力学相关内容做一简要梳理,为天麻素相关制剂药代动力学及临床应用提供依据。
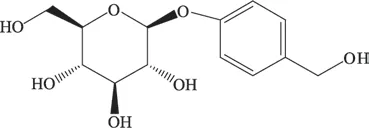
图1 天麻素的化学结构式
1 生物样品前处理
生物样品是指来自于生物机体的血液(全血、血浆、血清)、尿液、粪便、胆汁、唾液和组织脏器等。其与一般的样品含量测定不同之处在于药物浓度低、干扰物质多、取样量少及个体差异大。生物样品前处理的目的:一方面在于分离出待测物。药物的体内过程包括吸收、分布、代谢和排泄。生物样品中药物的存在形式有游离型(原型)药物、药物的代谢物、药物与蛋白质形成的缀合物及内源性物质,如与葡萄糖醛酸、硫酸形成的葡萄糖醛酸苷、硫酸酯缀合物等多种形式,这就需要分离出待测物。前处理的目的另一方面是为了保护仪器和延长色谱柱使用期限,提高待测样品可测定性(如成分富集)和选择性(如排除杂质干扰),保证检测结果的准确性和可靠性。药代动力学研究中,除去生物样品中蛋白质的目的,主要是为了使结合的药物释放出来,同时保护仪器性能。常用的去除蛋白质方法一般有:①蛋白质沉淀法(Protein precipitation,PP),使蛋白质从溶液中析出的方法。此法又包含等电点沉淀法、盐析法、有机溶剂沉淀法等。1)等电点沉淀法通常采用高氯酸、硝酸等酸类和硫酸铜、硫酸锌等重金属盐类,使蛋白质生成不溶性盐;2)盐析法是指采用亲水性比蛋白质强、高浓度的中性盐,如硫酸钠、氯化钠等,与蛋白质胶粒竞争水化膜,降低蛋白质溶解度而析出;3)有机溶剂沉淀法一般采用能与水混溶的有机溶剂如甲醇、乙醇、乙腈等,当它们过量时,可使蛋白质的分子氢键发生变化而沉淀。②液-液萃取法(Liquid-liquid extraction,LLE)。药物与蛋白质形成的缀合物及内源性物质大多为强极性物质,药物在体内吸收需经跨膜转运因而具有一定的脂溶性,因此可以根据二者之间极性的差异,使用适当的有机溶剂提取药物并进行分离。有机溶剂提取可一次除去大部分杂质,待测物也可从样品中被富集用于分析,此法是应用较多的分离、净化技术。③固相萃取法(Solid-phase extraction,SPE),主要采用固相填料如C18对样品组分的分配系数不同,实现对样品的分离,纯化和富集。此法避免了溶剂提取时蛋白质沉淀引起的乳化和药物损失。④酶解法主要用于测定一些酸不稳定及蛋白结合牢的药物或尿中的药物。⑤高速离心法一般用于血浆蛋白结合率的测定和血清分离实验。
由于天麻素水溶性好,采用简单的有机溶剂沉淀即可达到回收率要求,且操作简单、重复性好,故绝大多数生物样品前处理方法以有机溶剂沉淀法为主,包括乙醇、甲醇、乙腈及其复合溶剂等。有机溶剂与生物样本的比例一般为1∶2~1∶4,极少使用液-液萃取法和固相萃取法。
1.1 有机溶剂沉淀法
有机溶剂沉淀法通常取50~200 µL 生物样品,加入2~4 倍量有机溶剂沉淀,高速离心,取上清液,若待测成分浓度较高或测定仪器方法灵敏度高,可不挥干直接进样测定。由于中药成分复杂、含量较低、提取测定干扰因素多,故通常沉淀完的上清液需浓缩挥干,再用流动相复溶用于后续测定。
1.1.1 乙醇沉淀法
刘克辛等[29-30]最早开始研究天麻素在家兔体内的药代动力学,包括其代谢物天麻苷元在血浆、胆汁、肝脏、尿液及粪便中的分布等,随后又研究了天麻素在大鼠、狗血浆中的生理处置过程[31-32],样品前处理均为乙醇沉淀蛋白法。
1.1.2 甲醇沉淀法
何文等[33]研究天麻素鼻腔温敏凝胶在血浆与脑组织内的药动学特征,Jia 等[34]首次研究了天麻素和天麻苷元在比格犬体内的药动学性质,其均采用2 倍量甲醇沉淀血浆样品中的蛋白,上清液直接进样测定。Tang等[35]比较了灌胃天麻素和天麻提取物在大鼠血浆中的药动学差异,用3 倍量冰甲醇沉淀蛋白。Guan[36]等测定了天舒胶囊中天麻素和阿魏酸在正常和偏头痛大鼠血浆中的含量,Zhao 和Jiang 等[37-38]相继测定了大鼠体内天麻素和巴利森苷的相对生物利用度、组织分布和排泄情况,其亦是采用3倍量甲醇沉淀处理,只不过还添加了一定量的1%甲酸。程刚等[39]和Jiang等[40]研究天麻素在大鼠体内的药动学特点,均采用了4 倍量的甲醇沉淀蛋白,亦有研究采用6 倍量的甲醇[41-42]。
1.1.3 乙腈沉淀法
罗军等[43]研究静脉注射天麻素在健康受试者体内的药动学,精密吸取400µL 血浆,采用800µL 乙腈涡旋振荡提取。Jia 等[44]研究了天麻素在大鼠血浆中的代谢情况,Hu 等[45-46]比较了大川芎方和天麻提取物中天麻素在大鼠血浆中的药动学差异,血浆样品均采用4 倍量乙腈前处理。刘建存等[47]同样采用乙腈沉淀法处理大鼠血浆样品,操作简便、绝对回收率高、干扰杂质少等,可用于快速测定天麻首乌片中天麻素的浓度及相关药动学研究。
1.1.4 其他方法
除甲醇、乙醇、乙腈等常用于沉淀蛋白外,亦有用正丁醇进行沉淀的[48],血浆内源性成分和其他杂质不会影响待测成分的检测,方法学均符合生物样品测定要求。
一般有机溶剂沉淀法选取单一溶剂较多,但因测定条件或待测成分性质差异较大时,可根据实验需求采用复合溶剂沉淀法。Song 等[49]和杨园等[50-51]均采用甲醇-乙腈混合液沉淀血浆样品,只不过前者采用2倍量甲醇-乙腈(1∶3),后者采用5倍量甲醇-乙腈(1∶4),后续操作类似,离心,上清液浓缩挥干,流动相复溶残渣,再次离心取上清液进样测定。孙成春等[52]测定了天麻素在人体内的相对生物利用度,考虑到人与动物种属差异及天麻素在人体内含量甚微、干扰因素较多,则采用相对复杂的乙醇-二氯甲烷两步法提取天麻素,先用4倍量乙醇初步沉淀蛋白,上清液N2流吹干后用水复溶,因天麻素水溶性很好,故再加入二氯甲烷,取上层水相即可达到进一步纯化的目的。
1.2 酸处理法
王俏[53-55]研究了天麻素及其代谢物天麻苷元的体内外代谢,并比较了二者的脑靶向性(包括脑脊液及脑微透析液),采用两倍6%的高氯酸沉淀血浆中的蛋白并高速(9000 rpm)离心,可获得较高的绝对回收率。门金玉等[56]测定天麻头风灵胶囊灌胃后大鼠血浆中天麻素的浓度,血浆前处理方法也是采用6%的高氯酸。
2 测定方法
二十世纪九十年代,由于检测仪器的限制,天麻素的体内含量测定为间接测定法,即测定天麻素的相对含量,如用硅胶薄板层析法结合放射性探测法,但此法探测效率仅为45%,故后续研究绝大多数采用的是高效液相色谱法。随着现代分析仪器的进步,仪器的分离效率得以提高,尤其是一些质量检测器联用的发展,使检测的分辨率和灵敏度大大提高,如液相色谱与质谱联用仪(LC-MS/MS,UPLC-Q-TOF)等为天麻素体内过程分析提供了准确、灵敏的手段。
2.1 硅胶薄板层析法结合放射性探测法
利用化学还原法可制备3H-天麻素,收集制备不同组织的生物样品,将对三联苯溶于甲苯,作为闪烁液,根据放射性3H-天麻素每分钟衰变数间接计算出天麻素的含量。陆光伟等[57]研究大鼠口服3H-天麻素后,分析了胃肠道、血、及组织中放射性成分,说明天麻素胃肠道放射性消失很快,很快入血,并结合硅胶薄板层析法,将各组织提取液与天麻素和天麻苷元标准品在同一硅胶薄板上对照,表明天麻素在体内主要代谢物是苷元。游金辉等[58]同样采用上述方法,通过静脉给药探测3H-天麻素和3H-天麻苷元在小鼠体内的分布和代谢过程。
2.2 高效液相色谱法(HPLC)
天麻素体内生物利用度较高,生物样品中含量也较高,故一般HPLC 法即可用于其体内含量测定。王俏等[53-55]采用HPLC 法较为系统地研究了天麻素在大鼠体内外的代谢情况,并主要针对其脑靶向性进行了研究。由于制剂工艺和给药途径不同,往往影响药物的体内过程。四川大学Li 等[59]和Cai 等[60]分别考察了天芎胶囊及冰片对天麻素体内含量的影响,采用HPLC法测定了狗的血浆和小鼠脑中的含量。
2.3 液质联用法(LC-MS)
为测定生物样品中更低含量的天麻素或其代谢物,较多研究者采用了灵敏度更高的液质联用法,包括液相色谱串联三重四级杆质谱及液相色谱串联四极杆-飞行时间质谱等。
2.3.1 高效液相色谱串联三重四级杆质谱(LC-MS/MS)
高效液相色谱串联三重四极杆LC-MS/MS系统具有很宽的定量线性范围和较高的灵敏度,特别适合做最复杂基质样品中超低浓度组分的定量分析,可满足生物样品药代动力学中ADME 研究要求,为小分子化合物定量分析提供数据的准确性和重现性。
贵州师范大学Zhao 和Jiang 等[37-38]采用LC-MS/MS测定天麻素在大鼠体内的相对生物利用度、组织分布及排泄情况。台北阳明大学的Lin 等[61]利用微透析技术收集血、脑及胆汁透析液,同样采用LC-MS/MS测定了天麻素和天麻苷元在大鼠体内的药动学特征。华雯妍等[62]采用LC-MS/MS 建立了天麻素在人血浆中浓度测定法,并评价了天麻素胶囊在健康受试者体内的药动学。此法最低定量限(LOQ)达3 ng/mL,灵敏度较高,可以满足人体口服天麻素制剂的药动学需要。
2.3.2 高效液相色谱串联四极杆-飞行时间质谱(LCQ-TOF/MS)
高效液相色谱串联四极杆-飞行时间质谱速度快,适合于生命科学中大分子量复杂样品超快速精确质量同时定性定量分析。一些研究者[63-64]采用LC-Q-TOF/MS 技术对含天麻素的复方制剂在动物体内(如家兔、大鼠血浆中代谢物和血中移行成分进行了分析。
3 天麻素体内过程
3.1 天麻素在体内的吸收
天麻素在体内的吸收很好,绝对生物利用度超过80%[39],血浆蛋白结合率为4.3%,其苷元为69.3%[43]。静脉注射天麻素,在大鼠[39,65]和健康人体内[43,66]血药浓度-时间曲线符合二室模型,而灌胃给药符合单室一级吸收模型。Cai等[67]针对天麻素水溶性极好、脂溶性差的特点,研究了谷氨酸转运体(GLTs)对天麻素吸收的影响,发现钠依赖性的谷氨酸转运体-1(SGLT1)有助于天麻素的吸收。
3.2 天麻素在体内的分布
天麻素分布迅速,表观分布容积(Vd)为6.57~10.28 L,表明组织分布较少[41]。二十世纪八十年代,陆光伟等[57]率先采用硅胶层析法结合放射性元素测定法对大鼠口服3H-天麻素后胃肠道、血及组织中放射性成分进行分析,说明天麻素胃肠道放射性消失很快,并很快入血,组织放射性以肾最高,肝、肺、子宫次之,脑中放射性较低。随后大连医科大学刘克辛等[31]采用当时较为先进的HPLC 法先后研究了家兔及大鼠体内天麻素的药动学和生理处置过程,结果与陆光伟等人基本一致,也说明了天麻素吸收迅速且较完全,几乎不被胃肠道破坏。静脉注射2 min 后,组织药物分布为肾> 血浆、肺> 心脏,肝、肌肉、脾、脂肪等含量很低,脑组织中未测到,推测天麻素未能透过血脑屏障,而游金辉等[58]采用陆光伟的方法,在随后几年研究了3H-天麻素在小鼠体内的分布和代谢,其结果表明,天麻素能透过血脑屏障进入脑内,后续的研究者[53,65,68]也证实了这点,但其入脑量不高,主要以苷元的形式存在。Jiang 等[37]测定了天麻素在大鼠心、肝、脾、肺、肾、大脑和尿液等组织分布和排泄情况,结果表明,天麻素在体内主要分布于肾、肝和肺中。
3.3 天麻素在体内的代谢
天麻素在体内代谢很快,其主要代谢物为天麻苷元(对羟基苯甲醇)[29,34,44,53-55,61,69]。天麻素可透过血脑屏障进入脑内,并在脑、血及肝中迅速分解为天麻苷元,以天麻苷元的形式存留在脑组织内,发挥中枢镇静作用。有研究[53,70]较系统地研究了天麻素的体内外代谢和脑药动学,表明天麻素进入脑的速度很快,在脑、肝匀浆中代谢较慢,在肾匀浆中能被迅速代谢,在脑和血浆中代谢生成天麻苷元,但含量很低,浓度下降很快。对于天麻素的代谢产物研究,2010 年以前多集中于天麻苷元,随后也有一些其他代谢物报道。。倪书茂等[63]采用高分辨液相色谱-质谱联用仪对大川芎方中天麻素在家兔血浆中的代谢物进行初步研究,得到了包括脱烃基、脱甲氧基的两个Ⅰ相代谢产物和乙酰化、氨基酸给合的两个Ⅱ相代谢产物。近五年,对天麻素的代谢研究有了新的认识。Jia 等[44]对天麻素的代谢产物进行了较为细致的研究,除天麻苷元外,首次在大鼠血浆中鉴定出对甲苯基-d-葡糖苷、对羟基苯磺酸、对甲苯基-d-葡葡萄糖苷、对羟基苯甲醛这4个代谢产物。Tang[35]、Jiang 等[37]和Liu 等[71]研究表明天麻素可在体内与天麻药材中的另一成分巴利森苷相互转化。近年来,热门的肠道微生物研究也有涉及对药物代谢影响方面,如Nepal等[72]利用抗生素处理后的大鼠,研究肠道微生物对天麻素在体内外转化为天麻苷元的影响,明确了肠道微生物在天麻素吸收入血发挥药效的作用。
3.4 天麻素在体内的排泄
天麻素排泄途径主要以原型药从尿液排泄[37],少量从胆汁排出,粪便中几乎没有[57],在小鼠体内可能存在肠肝循环[58],在大鼠中无肝肠循环现象[39]。
综上可知,天麻素在体内的吸收很快、生物利用度高,分布迅速,主要分布于肾、肝和肺中,代谢较快,不易蓄积,主要从肾脏以尿液形式排出。
4 天麻素体内过程影响因素
4.1 动物种性
刘克辛等[32]最早采用HPLC 法测定了兔、大鼠、狗
体内天麻素及其代谢产物天麻苷元的含量,比较了其在不同动物体内的药动学差异,相同之处在于静脉注射天麻素后的药-时曲线均为二室模型、消除较快、组织中分布较小,但天麻素在兔十二指肠给药和大鼠灌胃给药的生物利用度差异巨大,分别为2.9%、79.4%,且在兔体内天麻素可少量转化为天麻苷元,进一步说明天麻素在此3种动物体内药动学存在明显的特异性。

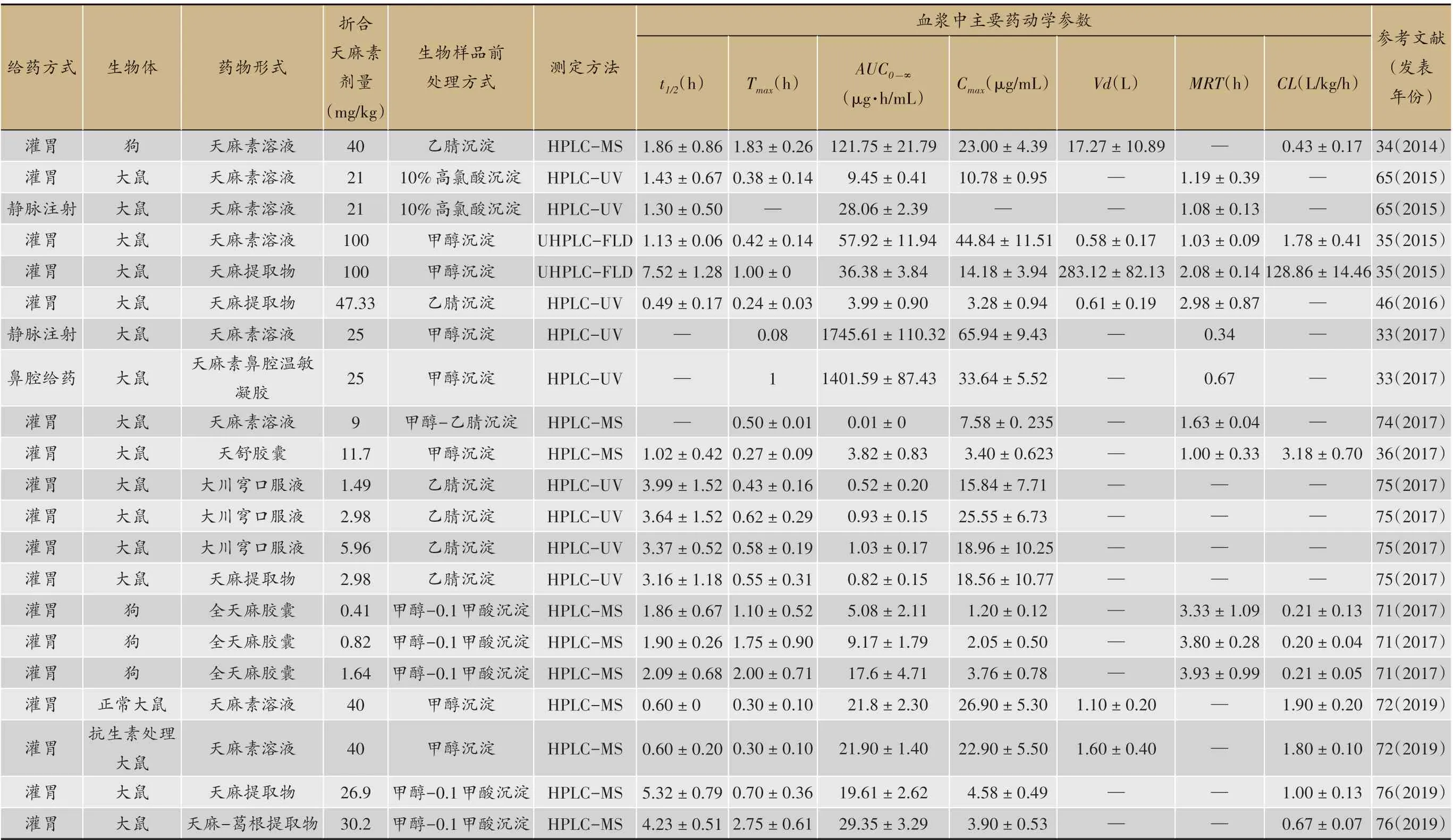
表1 天麻素在正常生物体内血浆中的主要药动学参数
续表
4.2 给药剂量
灌胃不同剂量天麻制剂,其天麻素的药动学参数存在一定的差异,如杨园等[50-51]研究了不同剂量复方天麻颗粒及提取物灌胃给大鼠后,低(50 mg/kg)、中剂量组(100 mg/kg)天麻素的半衰期、平均滞留时间、清除率等无明显改变,曲线下面积呈剂量依赖性;与中剂量组相比,高剂量组(200 mg/kg)表观分布体积、清除率显著增大,半衰期、平均滞留时间、曲线下面积随给药剂量增加无显著变化。因此,推测天麻素在50~100 mg/kg剂量时在大鼠体内为线性动力学过程,剂量在200 mg/kg以上时则为非线性动力学过程。
4.3 给药时间
陆光伟等[73]针对时辰药动学,研究了不同给药时间对3H-天麻素大鼠体内过程的影响,发现不同时间给药3H-天麻素,如早上8:00、晚上20:00、凌晨2:00,大鼠体内的药动学参数出现明显差异。
Cai 等[60]研究了灌胃冰片0 min、20 min、40 min 后再灌胃天麻素,考察冰片给药时间间隔对天麻素在血浆中及天麻苷元在脑中的药动学影响,结果表明,给大鼠灌胃冰片20 min 后再给予天麻素组,与同时灌胃冰片和天麻素组比较,前者的天麻素及天麻苷元达峰浓度(Cmax)显著高于后者,且天麻素的生物利用度增加16%。
4.4 药物配伍
Jiang 等[40]研究单用和合用天麻素及葛根素,二者在大鼠体内药代动力差异,结果表明,天麻素和葛根素合用后能相互促进吸收,降低消除速率,增加体内滞留时间。Zheng 等[45]研究了大川芎方中天麻与不同比例的川芎配伍后天麻素含量变化,表明川芎中的成分会显著影响天麻素AUC 和Cmax。而同一课题组的Hu 等[46]进一步研究了川芎中的川芎嗪、阿魏酸、总酚酸、总生物碱成分对天麻提取物中天麻素的吸收影响,结果表明川芎嗪对天麻素药动参数无影响,其他成分可显著增加天麻素AUC0-∞。Cai 等[60]研究了不同剂量冰片对血浆中天麻素的药动学影响,说明冰片可促进天麻素在胃肠道的吸收、缩短血浆中的达峰时间,且可提高生物利用度和脑靶向性。Ge 等[69]研究了大鼠灌胃不同配方益智片后天麻素、天麻苷元、钩藤碱的药动学差异,从药动学角度阐明天麻钩藤药对配伍的合理性。吴丽红等[74]研究天麻钩藤药对配伍后对天麻素和钩藤碱体内药动学行为的影响,亦从药动学特征,以中医视角阐明天麻、钩藤配伍实现对“肝阳上亢”整体施治目的。类似研究还有天麻复方和天麻提取物比较[75-76]、天麻提取物和单独天麻素的比较[77]等,均从不同层面表明复方配伍对天麻素的吸收、分布、消除有一定程度的影响。
下表统计了近二十年有关天麻素在生物体内(主要为大鼠、小鼠、人等)经不同给药途径的药动学参数。为便于参考和比较,仅整理了正常生物体血浆中的药动学参数。
5 展望
天麻素对神经系统、心血管系统及免疫系统药理作用明显,可治疗眩晕、后循环缺血性眩晕、缺血性脑卒中、血管性状头痛等疾病,具有较大的临床应用价值。
天麻素主要治疗心脑血管疾病,但其是否能通过血脑屏障报道不一[31,58],且其口服给药的生物利用度报道也不一致,种属差异大[32,39]。到目前为止,对天麻素的体内代谢研究大多局限于外周循环系统,对其进入脑的研究也主要集中在脑组织分布方面[33,53-55,60-61],且较少考虑药物联用尤其是中西药配伍对其药代动力学的影响,故天麻素体内药代动力学研究仍具有较大的空间。

