肾茶黄酮对急性肾衰中肾小管上皮细胞保护作用的研究*
郭银雪,胡茂蓉,葛平玉
(贵州中医药大学第一附属医院 贵阳 550001)
急性肾衰是常见的急危重症,发生率占ICU 的3-16%,肾衰导致肾器官无法完成正常活动而影响机体功能正常进行,病情严重但目前尚无有效的治疗方法方法,且尚不能预防高危病人急性肾衰的发生[1],及早治疗急性肾衰对于机体健康意义重大。治疗急性肾衰中采取有效措施防止肾小球上皮细胞损害是救治的关键,可避免进一步器官衰竭从而达到缓解疾病目的[2]。肾茶作为草药,用于治疗急、慢性肾炎等疾病,其提取物在肾炎利尿、排毒等方面具有功效[3]。肾茶黄酮作为肾茶提取物之一,可抑制氧化应激从而缓解大鼠慢性细菌性前列腺炎[4]。另外研究发现,急性肾衰中肾小管上皮细胞凋亡严重,从而加速疾病进程[5],肾茶黄酮是否可缓解细胞凋亡从而实现对急性肾衰中肾小管上皮细胞保护,目前尚不明确。因此,本研究立项贵州省科学技术基金项目,建立急性肾衰模型,提取肾小管上皮细胞,肾茶黄酮处理,检测肾茶黄酮对急性肾衰中肾小管上皮细胞的影响,以期为临床上急性肾衰的治疗提供一定的理论依据。
1 材料与方法
1.1 药物、试剂及仪器
肾茶(豪州市常福药业销售有限公司),黄酮本实验室自行提纯,肾茶取25 mg,加乙醇后超声处理溶解,准确称量本品,自“加水至6 mL”法测吸光度,绘制标准品,参照《中国药典》(2015年版一部)[6]收集“山楂叶”中总黄酮含量测定方法测定波长500 nm 处光密度(optic density,OD)。
甘油(麦克林,货号:56-81-5);CCK-8 试剂盒、Annexin V-PE 细胞凋亡检测试剂盒、超氧化物歧化酶(Superoxide Dismutase,SOD)活性检测试剂盒、丙二醛(Malondialdehyde,MDA)检测试剂盒(碧云天生物科技有 限 公 司,货 号 分 别 为:C0037、C1065L、S0116、S1031);一抗半胱氨酸天冬氨酸蛋白酶(Cysteinasparate protease,caspase)3、caspase9、B 淋巴细胞瘤-2基因(B-cell lymphoma-2,BCL2)、Bcl-2 相关X 蛋白(Bcl-2 Associated X Protein,BAX)(抗兔)、TGF-β1、smad3(美国abcam,货号分别为:ab13847、ab202068、ab182858、ab32503、ab92486、ab40854)。酶标仪(美国Awareness,型号4700);流式细胞仪(美国贝克曼库尔特公司,型号:CytoFLEX);蛋白凝胶成像仪(上海Tanon公司,型号4800)。
1.2 实验动物模型建立并验证
1.2.1 实验动物
清洁级健康SD 大鼠购自贵州医科大学实验动物中心,许可证号:SCXK(黔)2015 0001,重量(220±20)g,60 日龄,所有大鼠均在温度(22 ± 2)℃、湿度(55 ±2)%、12 h/12 h(光照/黑暗)实验动物中心常规饲养。标准大鼠颗粒饲料,购自贵州医科大学实验动物中心。本实验经本院伦理协会审核并通过。
1.2.2 实验动物建立急性肾衰模型
根据参考文献[7]建立6 只大鼠急性肾衰模型,10 mL·kg-150%甘油生理盐水注射大鼠两后肢,24 h后急性肾衰组大鼠血清中BUN、Cr 水平升高;肾衰组肾间质血管坏死、炎性细胞浸润,模型建立成功。对照组大鼠用生理盐水代替。
1.3 分离急性肾衰中肾小管上皮细胞并经肾茶黄酮处理
1.3.1 肾小管上皮细胞的分离及鉴定
1.2.2 模型组和对照组大鼠取部分肾组织,放入表面有胶原的培养瓶中,添加DMEM 培养基和F-12 培养基培养,直至融合传代培养,参考文献[8]观察肾小管上皮细胞结构。
1.3.2 肾茶黄酮对急性肾衰中肾小管上皮细胞的处理
急性肾衰中肾小管上皮细胞分为模型组、(100、200、300、400)µg·mL-1肾茶黄酮组。肾小管上皮细胞均匀接种于6 孔板和96 孔板中,待细胞密度达60%时,(100、200、300、400)µg·mL-1肾茶黄酮组根据文献[9]添加对应剂量肾茶黄酮;对照组和模型组培养基正常培养。
1.3.3 CCK-8法检测细胞增殖能力
1.3.2 中96 孔板各组细胞分别在处理(0、3、6、12、24、36)h 加CCK-8 试剂,培养箱中继续培养2 h,酶标仪检测450 nm处各孔细胞OD值。
1.3.4 流式细胞术检测细胞凋亡能力
1.3.2中6孔板细胞处理24 h,每孔取2×105个,按照Annexin V-FITC 试剂盒说明书,使用流式细胞仪检测细胞凋亡率。
1.3.5 试剂盒检测SOD、MDA水平
1.3.2 中6 孔板细胞处理24 h,严格按照SOD 活性检测试剂盒、MDA检测试剂盒步骤酶标仪检测SOD活性、MDA水平。
1.3.6 蛋白免疫印迹检测细胞中caspase3、caspase9、BCL2、BAX、TGF-β1、Smad3蛋白水平
1.3.2 中6 孔板细胞处理24h 提取细胞总蛋白,每孔上样25 ng,分离胶分离蛋白质,转膜后5%脱脂奶粉室温封闭2 h;对应加入一抗caspase3(1:500)、caspase9(1:2000)、BCL2(1:2000)、BAX(1:1000)、TGFβ1(1:500)、Smad3(1:1000)、GADPH(1:5000),4℃孵育过夜;对应加入二抗,室温孵育1 h。DAB 显色试剂盒显色,蛋白凝胶成像仪拍照和定量分析。
1.4 统计分析
统计学软件SPSS 22.0进行数据分析,计量数据以平均数±标准差(±s)描述,组内比较用单因素方差分析,组间两两比较采用SNK-q法。当P<0.05时,差异有统计学意义。
2 结果
2.1 肾茶黄酮对急性肾衰中肾小管上皮细胞增殖的影响
与对照组相比,在细胞培养(3、6、12、24、36)h,模型组OD450(0.92 ± 0.12 VS 0.36 ± 0.06、1.64 ± 0.11 VS 0.46 ± 0.11、1.86 ± 0.09 VS 0.58 ± 0.06、2.06 ± 0.12 VS 0.61 ± 0.06、2.42 ± 0.15 VS 0.64 ± 0.15)降 低(P <0.05)。与模型组相比,在细胞培养6h,(200、300、400)µg·mL-1肾茶黄酮组OD450(0.46± 0.11 VS 0.49 ± 0.01、0.53 ± 0.03、0.62 ± 0.01)升高(P < 0.05);在细胞培养(12、24、36)h,(300、400)µg·mL-1肾茶黄酮组OD450(0.58±0.06 VS1.36±0.16、1.43±0.01,0.61±0.06 VS 1.76 ± 0.06、1.81 ± 0.06,0.64 ± 0.15 VS 1.89 ± 0.06、2.13 ± 0.15)升高(P < 0.05)。随肾茶黄酮剂量增加,OD450水平随时间延长逐渐升高(P < 0.05),呈剂量依赖性。详见图1。
2.2 肾茶黄酮对急性肾衰中肾小管上皮细胞凋亡的影响
与对照组相比,模型组、(100、200、300)µg·mL-1肾茶黄酮组细胞凋亡率(5.11 ± 0.69 VS 31.26 ± 4.18、19.39±2.06、8.63±1.23、6.22±0.68)升高(P<0.05)。与模型组相比,(100、200、300、400)µg·mL-1肾茶黄酮组细胞凋亡率(31.26 ± 4.18 VS 19.39 ± 2.06、8.63 ±1.23、6.22 ± 0.68、5.69 ± 1.20)降低(P < 0.05),呈剂量依赖效应。见图2、表1。
2.3 肾茶黄酮对急性肾衰中肾小管上皮细胞MDA、SOD活性的影响
与对照组相比,模型组、(100、200、300、400)µg·mL-1肾茶黄酮组SOD 活性(669.61±81.02 VS 1659.52±395.16、1342.03 ± 286.51、1156.19 ± 199.65、923.51 ±52.06、747.62 ± 36.88)升高;模型组、(100、200)µg·mL-1肾茶黄酮组MDA活性(543.16±62.35 VS 225.51±43.41、394.13±54.69、456.47±69.87)降低(P<0.05)。与模型组相比,(100、200、300、400)µg·mL-1肾茶黄酮组细胞MDA 水平(225.51 ± 43.41 VS 394.13 ± 54.69、456.47 ± 69.87、498.68 ± 56.52、526.16 ± 48.77)升高(P < 0.05);(200、300、400)µg·mL-1肾茶黄酮组细胞SOD 水 平(1659.52 ± 395.16 VS 1156.19 ± 199.65、923.51 ± 52.06、747.62 ± 36.88)降低(P < 0.05),呈剂量依赖效应。见表2。
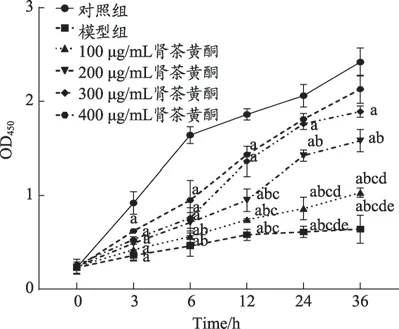
图1 肾茶黄酮对急性肾衰中肾小管上皮细胞增殖的影响
2.4 肾茶黄酮对急性肾衰中肾小管上皮细胞凋亡蛋白caspase3、caspase9、BCL2、BAX蛋白水平的影响
与对照组相比,模型组caspase3、caspase9、BAX(0.12 ± 0.06 VS 0.86 ± 0.21,0.21 ± 0.03 VS 0.94 ±0.19,0.31 ± 0.01 VS 1.02 ± 0.21),(100、200、300)µg·mL-1肾茶黄酮组caspase3、BAX 水平(0.12 ± 0.06 VS 0.87 ± 0.17、0.34 ± 0.09、0.38 ± 0.04,0.31 ± 0.01 VS 1.05 ± 0.17、0.46 ± 0.06、0.42 ± 0.09)升高(P < 0.05),模型组、(100、200、300、400)µg·mL-1肾茶黄酮组BCL2水平(1.02 ± 0.11 VS 0.06 ± 0.03、0.05 ± 0.02、0.15 ±0.06、0.21±0.02、0.33±0.04)降低(P<0.05)。与模型组相比,(200、300、400)µg·mL-1肾茶黄酮组caspase3、caspase9、BAX(0.86±0.21 VS 0.34±0.09、0.38±0.04、0.11 ± 0.03,0.94 ± 0.19 VS 0.15 ± 0.04、0.05 ± 0.01、0.06 ± 0.02,1.02 ± 0.21 VS 0.46 ± 0.06、0.42 ± 0.09、0.20 ± 0.04),BCL2 水平(0.06 ± 0.03 VS 0.15 ± 0.06、0.21 ± 0.02、0.33 ± 0.04)升高(P < 0.05),100 µg·mL-1肾茶黄酮组caspase9 水平(0.94±0.19 VS 0.13±0.03)降低(P<0.05),呈剂量依赖效应。详见图3、表3。
2.5 肾茶黄酮对急性肾衰中肾小管上皮细胞TGF-β 1/Smad3通路的影响
与对照组相比,模型组、(100、200)µg·mL-1肾茶黄酮组TGF-β1、Smad3(0.23 ± 0.03 VS 0.76 ± 0.13、0.62 ± 0.06、0.31 ± 0.02,0.06 ± 0.01 VS 0.48 ± 0.05、0.32 ± 0.06、0.24 ± 0.01),300 µg·mL-1肾 茶 黄 酮 组Smad3(0.06±0.01 VS 0.11±0.03)水平升高(P<0.05)。与模型组相比,(0、100、200、300、400)µg·mL-1肾茶黄酮组TGF-β1、Smad3 水平(0.76±0.13 VS 0.62±0.06、0.31 ± 0.02、0.21 ± 0.02、0.11 ± 0.01,0.48 ± 0.05 VS 0.32 ± 0.06、0.24 ± 0.01、0.11 ± 0.03、0.06 ± 0.02)降低(P<0.05),呈剂量依赖效应。详见图4、表4。

图2 肾茶黄酮对急性肾衰中肾小管上皮细胞凋亡的影响
表1 肾茶黄酮对急性肾衰中肾小管上皮细胞凋亡率的影响(n = 6,± s)
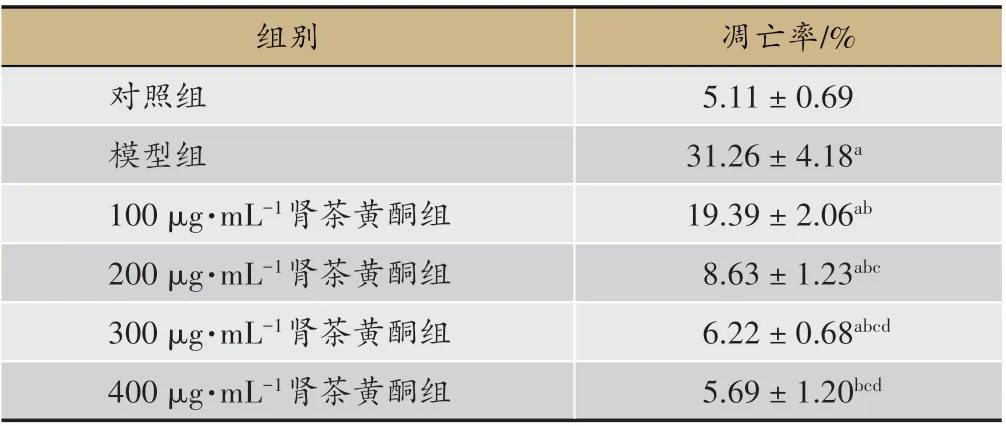
表1 肾茶黄酮对急性肾衰中肾小管上皮细胞凋亡率的影响(n = 6,± s)
注:与对照组相比,aP < 0.05;与模型组相比,bP < 0.05;与100 µg·mL-1肾茶黄酮组相比,cP<0.05;与200µg·mL-1肾茶黄酮组相比,dP<0.05。
组别对照组模型组100µg·mL-1肾茶黄酮组200µg·mL-1肾茶黄酮组300µg·mL-1肾茶黄酮组400µg·mL-1肾茶黄酮组凋亡率/%5.11±0.69 31.26±4.18a 19.39±2.06ab 8.63±1.23abc 6.22±0.68abcd 5.69±1.20bcd
3 讨论
急性肾衰是导致死亡的主要原因之一,肾小球滤过能力下降,使BUN、Cr等在体内积累诱发酸碱、电解质平衡破坏,研究表明BUN、Cr 水平越高则机体越紊乱[10];与中医祖国医学称“关格”、“瘾毕”、“溺毒”、“肾劳”、“水肿”、“消咳”之证候相吻合[11],是中医内科急症之一,温补心肾、化瘀利水可使病机扭转,病情缓解。肾茶又称“猫须草”或“猫须公”,其成分黄酮有利尿、抗氧化之功效[12],毒性小且安全性高。肾茶在治疗慢性肾衰竭时可缓解BUN、Cr 等水平,对慢性肾衰有一定治疗作用[13],但肾茶中黄酮对急性肾衰中肾小管上皮细胞是否发挥作用尚不明确。急性肾衰中肾小管上皮细胞细胞损伤严重、出现凋亡症状,炎症反应、氧化应激严重造成机体损害[14-15]。肾茶黄酮处理急性肾衰肾小管上皮细胞是否可缓解的细胞损伤状态,对急性肾衰肾小管上皮细胞保护作用。
表2 肾茶黄酮对急性肾衰中肾小管上皮细胞MDA、SOD活性的影响(n = 6,±s)

表2 肾茶黄酮对急性肾衰中肾小管上皮细胞MDA、SOD活性的影响(n = 6,±s)
注:与对照组相比,aP < 0.05;与模型组相比,bP < 0.05;与100 µg·mL-1肾茶黄酮组相比,cP<0.05;与200µg·mL-1肾茶黄酮组相比,dP<0.05;与300µg·mL-1肾茶黄酮组相比,eP<0.05。
组别对照组模型组100µg·mL-1肾茶黄酮组200µg·mL-1肾茶黄酮组300µg·mL-1肾茶黄酮组400µg·mL-1肾茶黄酮组MDA(nmol·g-1蛋白)543.16±62.35 225.51±43.41a 394.13±54.69ab 456.47±69.87ab 498.68±56.52bc 526.16±48.77bc SOD(U·g-1蛋白)669.61±81.02 1659.52±395.16a 1342.03±286.51a 1156.19±199.65ab 923.51±52.06abc 747.62±36.88abcde
表3 肾茶黄酮对急性肾衰中肾小管上皮细胞凋亡蛋白caspase3、caspase9、BCL2、BAX的影响(n = 6,±s)

表3 肾茶黄酮对急性肾衰中肾小管上皮细胞凋亡蛋白caspase3、caspase9、BCL2、BAX的影响(n = 6,±s)
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与100µg·mL-1肾茶黄酮组相比,cP<0.05;与200µg·mL-1肾茶黄酮组相比,dP<0.05;与300µg·mL-1肾茶黄酮组相比,eP<0.05。
组别对照组模型组100µg·mL-1肾茶黄酮组200µg·mL-1肾茶黄酮组300µg·mL-1肾茶黄酮组400µg·mL-1肾茶黄酮组caspase3 0.12±0.06 0.86±0.21a 0.87±0.17a 0.34±0.09abc 0.38±0.04abc 0.11±0.03bcde caspase9 0.21±0.03 0.94±0.19a 0.13±0.03b 0.15±0.04b 0.05±0.01bcd 0.06±0.02bcd BCL2 1.02±0.11 0.06±0.03a 0.05±0.02a 0.15±0.06abc 0.21±0.02abcd 0.33±0.04abcde BAX 0.31±0.01 1.02±0.21a 1.05±0.17a 0.46±0.06abc 0.42±0.09abc 0.20±0.04bcde
本研究发现,与对照组相比,模型组OD450降低,凋亡率增加,SOD 活性升高,MDA 水平降低;提示急性肾衰导致肾小管上皮细胞增殖降低、细胞凋亡现象明显,氧化应激加重。与模型组相比,细胞培养(6、12、24、36)h(300、400)µg·mL-1肾茶黄酮组OD450升高,(100、200、300、400)µg·mL-1肾茶黄酮组细胞凋亡率降低,SOD 活性降低,MDA 水平升高;提示肾茶黄酮可缓解急性肾衰导致肾小管上皮细胞增殖降低、凋亡现象明显,氧化应激加重现象,且随着剂量的增加,该缓解效果越明显。推测可能是肾茶黄酮具有促进细胞增殖、抗凋亡、抑制氧化应激从而减缓细胞损伤状态,从而恢复肾小球滤过功能,实现对急性肾衰肾小管上皮细胞保护。
BAX与BCL2都为BCL2家族成员,其中BAX作为促凋亡基因、BCL2 作为抗凋亡基因,二者相互作用影响细胞凋亡[16-17]。在肾小管上皮细胞损伤中,凋亡蛋白caspase-3[18]、caspase-9[19]水平升高可促进细胞凋亡;caspase3、caspase9、BCL2、BAX 作为凋亡蛋白,水平均可反映肾小管上皮细胞凋亡状态[20]。TGF-β1/Smad3通路TGF-β1 可以活化下游Smad3 诱导细胞死亡,同时可介导凋亡相关蛋白诱导细胞凋亡影响疾病,在高糖诱导的肾小管上皮细胞中表达升高可加重疾病进程[21];可抑制氧化应激保护大鼠糖尿病心脏组织从而实现对糖尿病的缓解作用[22]。本研究发现,与对照组相比,模型组caspase3、caspase9、BAX、TGF-β1、Smad3水平升高,BCL2 水平降低;提示肾衰竭中肾小管上皮细胞中促凋亡蛋白水平升高、抗凋亡蛋白水平升高,TGF-β1/Smad3 通路蛋白水平升高从而加速肾小管上皮细胞凋亡,加重病情。与模型组相比,肾茶黄酮各剂量组随着剂量的增加,caspase3、caspase9、BAX、TGF-β1、Smad3 水平降低,BCL2 水平升高,可能肾茶黄酮通过抑制TGF-β1 表达从而抑制Smad3 活化从而抑制凋亡蛋白表达、促进抗凋亡蛋白表达,实现抑制细胞凋亡、降低细胞氧化应激,同时促进细胞增殖可能从而缓解BUN、Cr水平、使电解质平衡逐渐恢复,实现对急性肾衰肾小管上皮细胞的保护。

图3 肾茶黄酮对急性肾衰中肾小管上皮细胞凋亡蛋白caspase3、caspase9、BCL2、BAX的影响
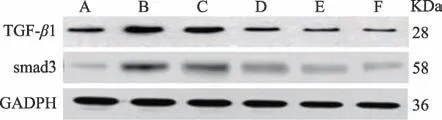
图4 肾茶黄酮对急性肾衰中肾小管上皮细胞TGF-β1/Smad3通路的影响
表4 肾茶黄酮对急性肾衰中肾小管上皮细胞TGF-β1、Smad3的影响(n = 6,±s)

表4 肾茶黄酮对急性肾衰中肾小管上皮细胞TGF-β1、Smad3的影响(n = 6,±s)
注:与对照组相比,aP < 0.05;与模型组相比,bP < 0.05;与100 µg·mL-1肾茶黄酮组相比,cP<0.05;与200µg·mL-1肾茶黄酮组相比,dP<0.05;与300µg·mL-1肾茶黄酮组相比,eP<0.05。
组别对照组模型组100µg·mL-1肾茶黄酮组200µg·mL-1肾茶黄酮组300µg·mL-1肾茶黄酮组400µg·mL-1L肾茶黄酮组TGF-β1 0.23±0.03 0.76±0.13a 0.62±0.06ab 0.31±0.02abc 0.21±0.02bcd 0.11±0.01bcde Smad3 0.06±0.01 0.48±0.05a 0.32±0.06ab 0.24±0.01abc 0.11±0.03abcd 0.06±0.02bcde
综上所述,肾茶黄酮可实现对急性肾衰肾小球上皮细胞的保护作用,可能是通过抑制TGF-β1/Smad3通路促进肾小管上皮细胞增殖、抑制凋亡,抑制氧化应激实现的。但具体对细胞增殖、凋亡的影响却不清楚。本文只初步探讨了肾茶黄酮对急性肾衰中肾小管上皮细胞的研究,且体外实验结果尚需在体内试验加以验证。

