右归丸对激素抵抗型肾病综合征大鼠肾脏组织中JNK/p38信号通路的影响*
王新斌,戴恩来,薛国忠,吕 娟,陈威辛
(甘肃中医药大学中西医结合学院 兰州 730000)
激素抵抗型肾病综合征(steroid- resistant nephrotic syndrome,SRNS)是指经规范化激素治疗无效的肾病综合征,属于难治性肾病综合征(refractory nephrotic syndrome,RNS)的一种类型[1],是临床慢性肾脏病中治疗最为棘手,预后较差的病种。尽管对SRNS 从B 淋巴细胞抑制、抑制纤维化、基因突变等角度的治疗有了一定的进展,但临床疗效仍不尽如人意,且副作用堪忧,故进一步探究SRNS 发病机制,寻找新型药物治疗具有重要的临床意义。JNK、p38为丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)家族成员,研究显示,激活JNK/p38 信号通路后,可诱导肾组织纤维细胞增生,加重肾间质损伤,导致肾间质纤维化、肾衰竭,提示JNK/p38信号通路可能为SRNS 潜在治疗靶点[2-3]。右归丸是由炮附片、熟地黄、肉桂、酒萸肉和山药等中药组成,具有填精止遗、温补肾阳之功效,临床用于治疗慢性肾衰、肾病综合症等肾病[4]。本研究通过建立SRNS 动物模型,给予右归丸干预,旨在探究右归丸对SRNS 大鼠肾组织的保护作用及可能的作用机制。
1 材料与方法
1.1 实验动物
SPF 级Wisar 大鼠60 只,雄性,8 周龄,体重(200±10)g,由甘肃中医药大学科研实验中心提供,动物合格证号:6200100000025,许可证号:SCXK(甘)2015-0002。动物饲养于SPF实验中心,室温22℃,辐照灭菌SPF级大鼠饲料喂养,给药前禁食12 h,自由饮水。
1.2 药物
阿霉素(AD,Solarbio,批号17C024,规格:25 mg/支);醋酸泼尼松片(浙江仙据制药股份有限公司,批号170146,规格:5 mg/片);右归丸(北京同仁堂股份有限公司同仁堂制药厂,批号170528规格:9 g/丸),药物成分:绿原酸、莫诺苷松、脂醇二葡萄糖苷、马钱苷、阿魏酸、肉桂酸(见图1)。
1.3 主要试剂及仪器
肌酐检测试剂盒(批号:YZB/GER2659-2018);尿素氮检测试剂盒(批号:YZB/GER0315-2018);总蛋白检测试剂盒(批号:YZB/GER3253-2018);白蛋白检测试剂盒(批号:YZB/GER1029-2018);甘油三酯检测试剂盒(批号:YZB/GER5264-2018);胆固醇检测试剂盒(批号:YZB/GER1324-2018)均购自Roche Diagnostics GmbH 公司;Masson 染色试剂盒(货号:G1340)购于美国Solarbio 公司;PAS 染色试剂盒(货号:DG0007)购自北京雷根生物技术有限公司;HE 染色试剂盒(货号:C0105)购自碧云天生物技术公司;兔抗鼠Caspase-3(ab179517)、Bcl-2(ab185002)、Bax(ab53154)、β-actin(ab179467)、转化生长因子-β1(transforming growth factor-β,TGF-β1)(ab92486)、结 缔 组 织 生 长 因 子(connective tissue growth factor,CTGF)(ab231824)单 抗抗体购于英国Abcam 公司;p-JNK(AF1205)、JNK(MAB1387)、p-p38(AF8691)、p38(MAB8691)、HRP标记二抗(HAF007)购于美国R&D 公司;光学显微镜(日本Olympus 公司,型号CX41);全自动生化仪(上海科华卓越生物工程股份有限公司,型号:450);凝胶成像仪(美国Bio-Rad公司,型号:Gel Doc XR+)。

图1 HPLC色谱图
1.4 实验分组与给药
1.4.1 模型制备
将60 只雄性SPF 级Wisar 大鼠适应性饲养1 周,随机分为正常组(10 只)和造模组(50 只)。参照文献法[5],建立激素抵抗型肾病综合征大鼠模型,造模组大鼠一次性尾静脉注射阿霉素(6 mg·kg-1)建立激素抵抗型肾病综合征大鼠模型,大鼠尾部未发生肿胀、迂曲,表明注射成功;正常组(Control)大鼠注射等剂量生理盐水。
1.4.2 动物给药
造模成功后采用随机数字表法分为模型组、激素治疗组(泼尼松片,Prednisone)、激素联合右归丸低、中、高组(TL、TM、TH),每组10 只大鼠。依据人与大鼠体表面积换算法计算用药量。Control 组和Model组:给予等体积生理盐水灌胃;Prednisone 组:给予泼尼松片混悬液灌胃,剂量为6.3 mg·kg-1·d-1;Prednisone联合右归丸低、中、高剂量组:给予泼尼松混合右归丸的混悬液灌胃,剂量分别为6.3/11600mg·kg-1·d-1、6.3/5600 mg·kg-1·d-1、6.3/2800 mg·kg-1·d-1,连续6周。
1.5 样本采集、处理
给药2周、4周、6周,收集大鼠24 h尿液,3000 g离心5 min 后,收集上清液,用于检测24 h 尿蛋白量。末次治疗结束后,将大鼠麻醉处死,收集血液5000 g,离心5 min,收集上清,在-80℃中保存;收集肾组织,平均分为2 部分,一部分置于4%多聚甲醛中固定,常规制备石蜡切片,用于病理观察以及免疫组化检测;一部分保存于-80℃用于蛋白检测。
1.6 检测指标与方法
1.6.1 大鼠一般状态
给药期间,观察大鼠毛发、进食量、精神、大便、体重情况等。
1.6.2 血清中血脂、肾功能相关指标检测
参照试剂盒检测血清中肌酐(Serum creatinine,Scr)、尿素氮(Blood urea nitrogen,BUN)、总蛋白(Total protein,TP)、白 蛋 白(Albumin,ALB)、甘 油 三 酯(Triglyceride,TG)、胆固醇(Total Cholesterol,TC)水平,具体参考试剂盒说明书进行操作,于自动生化检测仪进行测定。24 h 尿蛋白量采用邻苯三酚红/钼酸盐比色法检测。
1.6.3 肾组织病理形态学检测
肾组织经洗涤、脱水、透明、浸蜡、包埋、切片后行HE、PAS、Masson 染色,光学显微镜下观察肾脏的病理形态学变化。采用半定量积分法对肾组织损伤情况进行评定,主要从肾小球硬化程度、肾小管间质损伤程度方面进行评分,每个大鼠至少评价20 个肾小球(皮质区域),每项评分为0 ~4 分,评分越高代表损伤越严重。Masson 染色:胶原纤维染色为蓝色,肌纤维染色为暗红色,采用IPP6.0 分析Masson 染色胶原纤维面积比,胶原纤维比例=染蓝区域面积/总面积×100%。
1.6.4 TUNEL原位凋亡检测肾组织细胞凋亡情况
制备肾组织冷冻切片,50 µL 蛋白酶K,37℃孵育20 min,加入Tunel反应液,于37°C的加湿室中孵育1 h,PBS 缓冲液清洗后,添加过氧化物酶结合抗体在37°C孵育1 h,DAB 染色后用苏木精复染,脱水、封片后,在显微镜下观察细胞凋亡情况,凋亡细胞核染色呈棕色。用Image-J 软件定量分析细胞凋亡率,细胞凋亡率(%)=棕色细胞数/细胞总数×100%。
1.6.5 免疫印迹法检测肾组织中JNK/p38 信号通路、凋亡蛋白表达
取适量肾组织,添加RIPA裂解液冰上反应30 min,提取肾组织总蛋白,BCA 检测蛋白含量,取50ug 蛋白样品进行SDS-PAGE 电泳,转移至PVDF 膜上,封闭后加入兔抗鼠TGF-β1、CTGF、Caspase-3、Bcl-2、Bax、βactin、p-JNK、JNK、p-p38、p38 一抗(1:500),4℃摇床孵育过夜,PBS 缓冲液清洗后,,加入HRP 标记二抗孵育膜(1:5000),清洗后,于膜上加入ECL 反应液5 min后进行曝光、显影,用凝胶成像仪采集、保存图像,以β-actin 为内参,采用Image-J 软件定量分析各蛋白相对表达量。
1.7 统计学分析
本研究数据采用SPSS 22.0软件进行分析,计量资料以平均数±标准差(±s)描述,多组间比较行单因素方差分析,进一步两两对比采用SNK-q 检验,当P<0.05时,则差异具有统计学意义。
表1 各组大鼠体重变化情况比较(±s,g)
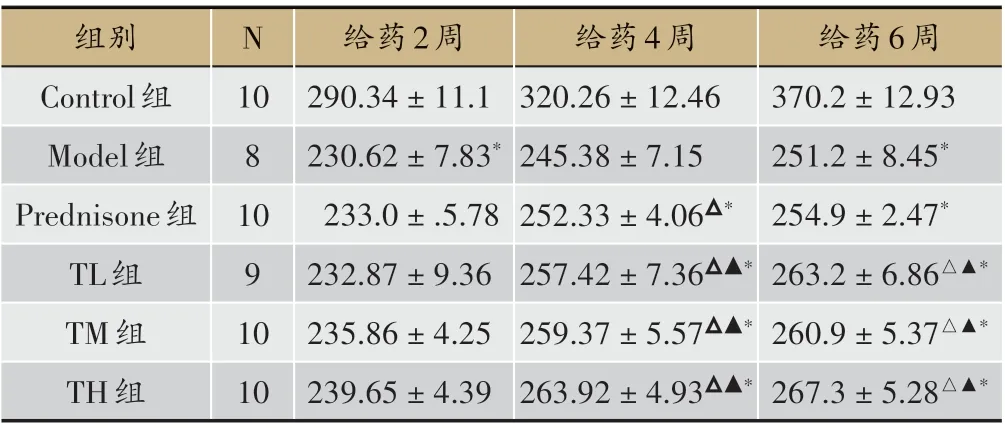
表1 各组大鼠体重变化情况比较(±s,g)
注:与Control 组比较,*P < 0.05;与Model 组比较,△P < 0.05;与Predni‑sone组比较,▲P<0.05
给药6周370.2±12.93 251.2±8.45*254.9±2.47*263.2±6.86△▲*260.9±5.37△▲*267.3±5.28△▲*组别Control组Model组Prednisone组TL组TM组TH组N 10 8 10 9 10 10给药2周290.34±11.1 230.62±7.83*233.0±.5.78 232.87±9.36 235.86±4.25 239.65±4.39给药4周320.26±12.46 245.38±7.15 252.33±4.06△*257.42±7.36△▲*259.37±5.57△▲*263.92±4.93△▲*
表2 各组24 h尿蛋白量比较(±s,mg)
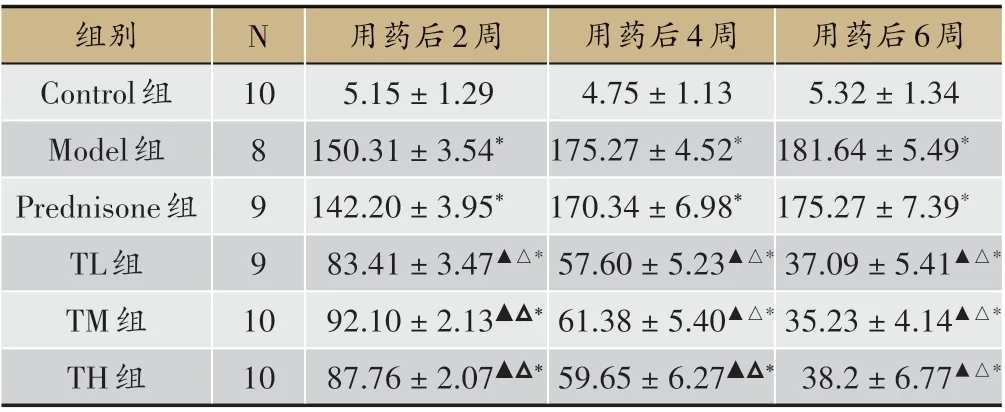
表2 各组24 h尿蛋白量比较(±s,mg)
注:与Control 组比较,*P < 0.05;与Model 组比较,△P < 0.05;与Predni‑sone组比较,▲P<0.05
用药后6周5.32±1.34 181.64±5.49*175.27±7.39*37.09±5.41▲△*35.23±4.14▲△*38.2±6.77▲△*组别Control组Model组Prednisone组TL组TM组TH组N 10 8 9 9 1 0 10用药后2周5.15±1.29 150.31±3.54*142.20±3.95*83.41±3.47▲△*92.10±2.13▲△*87.76±2.07▲△*用药后4周4.75±1.13 175.27±4.52*170.34±6.98*57.60±5.23▲△*61.38±5.40▲△*59.65±6.27▲△*
2 结果
2.1 各组大鼠一般情况
Control 组大鼠精神状态良好,反应灵敏,毛发光滑发亮,进食正常。造模后第7 d 大鼠出现尿量减少并伴有少量的腹水,精神状态日渐萎靡,进食减少,体重下降。1-2 周大鼠腹水显著增多,24 h 尿蛋白增多;大鼠出现嗜睡、反应迟钝,有弓背耸肩现象,蜷卧少动,体毛发灰发暗,大便稀溏等体征。Control 组无大鼠死亡;Model组2只大鼠因腹水、进食减少死亡,死亡率20%(2/10)。TL 组、TM 组、TH 组各有1 只因腹水、体重下降而死亡,Prednisone 组1 只死亡。与Model 组相比,TL 组、TM 组、TH 组、Prednisone 组大鼠活跃度增加,精神好转,毛发渐有光泽。随着给药时间的延长,大鼠体重逐渐增加,给药2周,与Control组相比,Model组体重降低;给药4 周、6 周,与Model 组、Prednisone 组相比,TL 组、TM 组、TH 组组体重升高,差异均有统计学意义(P<0.05)(见表1)。
2.2 各组大鼠尿蛋白定量变化
与Control组相比,Model组24 h尿蛋白量升高,差异有统计学意义(P < 0.05)。与Model、Prednisone 组相比,TL 组、TM 组、TH 组24 h 尿蛋白量降低,差异有统计学意义P<0.05)(见表2)。
表3 各组血清肾功能、血脂水平比较(±s)
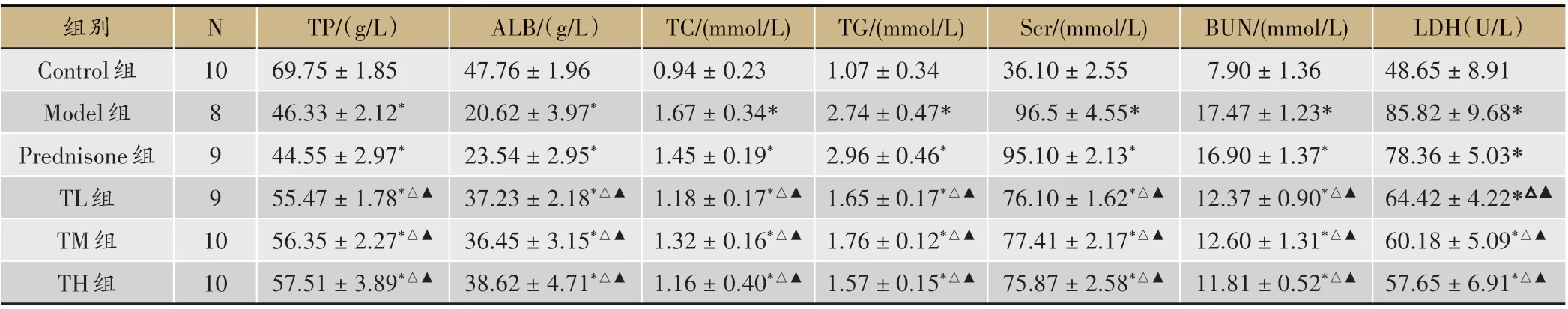
表3 各组血清肾功能、血脂水平比较(±s)
注:与Control组比较,*P<0.05;与Model组比较,△P<0.05;与Prednisone组比较,▲P<0.05
LDH(U/L)48.65±8.91 85.82±9.68*78.36±5.03*64.42±4.22*△▲60.18±5.09*△▲57.65±6.91*△▲组别Control组Model组Prednisone组TL组TM组TH组N 10 8 9 9 1 0 10 TP/(g/L)69.75±1.85 46.33±2.12*44.55±2.97*55.47±1.78*△▲56.35±2.27*△▲57.51±3.89*△▲ALB/(g/L)47.76±1.96 20.62±3.97*23.54±2.95*37.23±2.18*△▲36.45±3.15*△▲38.62±4.71*△▲TC/(mmol/L)0.94±0.23 1.67±0.34*1.45±0.19*1.18±0.17*△▲1.32±0.16*△▲1.16±0.40*△▲TG/(mmol/L)1.07±0.34 2.74±0.47*2.96±0.46*1.65±0.17*△▲1.76±0.12*△▲1.57±0.15*△▲Scr/(mmol/L)36.10±2.55 96.5±4.55*95.10±2.13*76.10±1.62*△▲77.41±2.17*△▲75.87±2.58*△▲BUN/(mmol/L)7.90±1.36 17.47±1.23*16.90±1.37*12.37±0.90*△▲12.60±1.31*△▲11.81±0.52*△▲
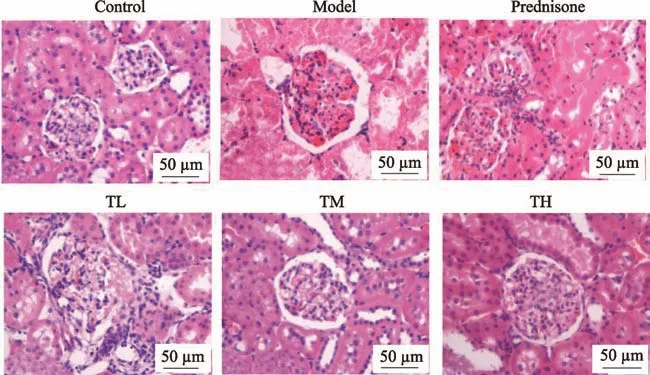
图2 HE染色观察肾组织病理形态学变化(200×)
2.3 各组血清血脂、肾功能有关指标变化情况
与Control 组相比,Model 组TP、ALB 水平降低,TC、TG、Scr、BUN、LDH 水平升高,差异有统计学意义(P < 0.05)。与Model、Prednisone 组相比,TL 组、TM组、TH组血清TP、ALB水平升高,TC、TG、Scr、BUN、LDH水平降低,差异有统计学意义(P<0.05)(见表3)。
2.4 HE染色检测大鼠肾脏病理形态学
Control 组肾小球、肾小管基本正常,球内毛细血管结构清晰;Model 组肾小球囊粘连,细胞增生明显,周围间质内较多炎细胞浸润,毛细血管内呈均质状透明样变,肾小管上皮细胞变性,管腔内均有透明管型。经激素及与右归丸联合治疗后肾小球、肾小管损伤得到一定的改善,病理损伤程度减轻。与Control 组相比,Model 组肾小球硬化评分、肾小管间质损伤评分、胶原纤维比例升高,差异有统计学意义(P < 0.05)。与Model、Prednisone 组相比,TL 组、TM 组、TH 组肾小球硬化评分、肾小管间质损伤评分、胶原纤维比例降低,差异有统计学意义(P < 0.05)(见图2、图3、图4和表4)。
2.5 肾组织细胞凋亡情况
与Control 组相比,Model 组肾组织细胞凋亡率升高,差异有统计学意义(P<0.05)。与Model、Prednisone组相比,TL 组、TM 组、TH 组肾组织凋亡率降低,差异有统计学意义(P<0.05)(见图5、表5)。
2.6 肾脏组织中纤维化蛋白表达情况
与Control 组相比,Model 组TGF-β1、CTGF 蛋白表达升高,差异有统计学意义(P < 0.05)。与Model、Prednisone 组相比,TL 组、TM 组、TH 组TGF-β1、CTGF蛋白表达降低,差异有统计学意义(P < 0.05)(见图6、表6)。
2.7 肾脏组织中JNK/p38信号通路蛋白表达情况
与Control 组相比,Model 组JNK、p38 蛋白磷酸化水平升高,差异有统计学意义(P < 0.05)。与Model、Prednisone 组相比,TL 组、TM 组、TH 组JNK、p38 蛋白磷酸化水平降低,差异有统计学意义(P<0.05)(见图7、表7)。
2.8 肾脏组织中凋亡蛋白表达情况

图3 Masson染色观察肾组织病理形态学变化(200×)

图4 PAS染色观察肾组织病理形态学变化(200×)

图5 Tunel联合免疫组化检测肾组织凋亡情况(100×)
表4 各组肾组织损伤评分比较(±s)

表4 各组肾组织损伤评分比较(±s)
注:与Control 组比较,*P < 0.05;与Model 组比较,△P < 0.05;与Predni‑sone组比较,▲P<0.05
胶原纤维比例/%2.16±0.53 58.33±6.49*52.98±7.32*41.87±6.13*△▲38.63±5.41*△▲36.48±4.22*△▲组别Control组Model组Prednisone组TL组TM组TH组N 10 8 9 9 1 0 10肾小球硬化评分0.24±0.03 2.79±0.53*2.58±0.75*1.43±0.42*△▲1.52±0.34*△▲1.59±0.46*△▲肾小管间质损伤评分/分0.41±0.05 3.26±0.54*3.14±0.59*1.76±0.35*△▲1.68±0.34*△▲1.55±0.26*△▲
表5 各组肾组织凋亡率比较(±s,%)
表5 各组肾组织凋亡率比较(±s,%)
注:与Control 组比较,*P < 0.05;与Model 组比较,△P < 0.05;与Predni‑sone组比较,▲P<0.05
凋亡率3.61±0.88 37.66±4.39*34.42±4.83*25.76±2.36*△▲24.44±2.93*△▲22.13±2.85*△▲组别Control组Model组Prednisone组TL组TM组TH组N 10 8 9 9 1 0 10
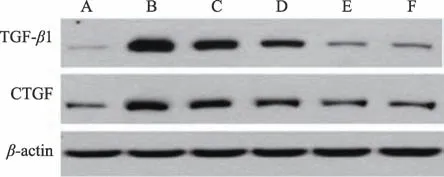
图6 免疫印迹法检测肾脏组织中TGF-β1、CTGF信号通路蛋白表达
表6 各组肾组织中TGF-β1、CTGF信号通路蛋白表达比较(±s)
表6 各组肾组织中TGF-β1、CTGF信号通路蛋白表达比较(±s)
注:与Control 组比较,*P < 0.05;与Model 组比较,△P < 0.05;与Predni‑sone组比较,▲P<0.05
CTGF/β-actin 0.24±0.05 0.91±0.12*0.86±0.09*0.52±0.06*△▲0.34±0.04*△▲0.31±0.03*△▲组别Control组Model组Prednisone组TL组TM组TH组N 10 8 9 9 1 0 10 TGF-β1/β-actin 0.12±2.39 1.82±0.41*1.64±0.39*0.73±0.08*△▲0.35±0.04*△▲0.33±0.03*△▲
与Control 组相比,Model 组Caspase-3、Bax 蛋白表达升高,Bcl-2 蛋白表达降低,差异有统计学意义(P<0.05)。与Model、Prednisone 组相比,TL 组、TM 组、TH组Caspase-3、Bax 蛋白表达降低,Bcl-2 蛋白表达升高,差异有统计学意义(P<0.05)(见图8、表8)。
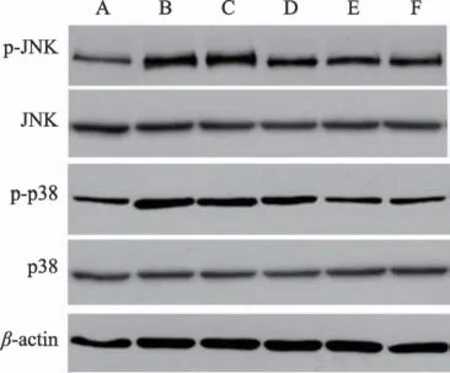
图7 免疫印迹法检测肾脏组织中JNK/p38信号通路蛋白表达
表7 各组肾组织中JNK/p38信号通路蛋白表达比较(±s)

表7 各组肾组织中JNK/p38信号通路蛋白表达比较(±s)
注:与Control 组比较,*P < 0.05;与Model 组比较,△P < 0.05;与Predni‑sone组比较,▲P<0.05
N 10 p-p38/p38 0.38±0.05 1.14±0.23*1.06±0.18*0.76±0.14*△▲0.69±0.03*△▲0.65±0.05*△▲组别Control组Model组Prednisone组TL组TM组TH组8 9 9 1 0 10 p-JNK/JNK 0.31±0.03 1.05±0.16*0.97±0.12*0.48±0.06*△▲0.41±0.04*△▲0.45±0.06*△▲

图8 免疫印迹法检测肾脏组织中Caspase-3、Bax、Bcl-2蛋白表达情况
表8 各组肾组织凋亡蛋白表达比较(±s)
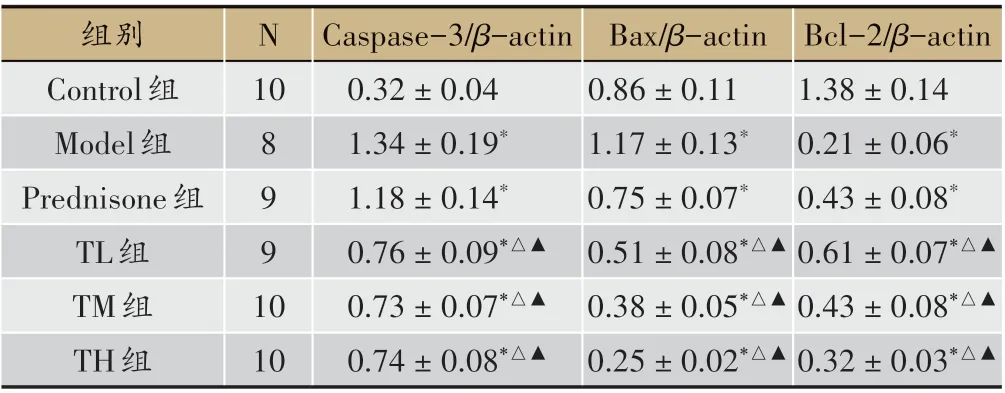
表8 各组肾组织凋亡蛋白表达比较(±s)
注:与Control 组比较,*P < 0.05;与Model 组比较,△P < 0.05;与Predni‑sone组比较,▲P<0.05
10组别Control组Model组Prednisone组TL组TM组TH组N Bcl-2/β-actin 1.38±0.14 0.21±0.06*0.43±0.08*0.61±0.07*△▲0.43±0.08*△▲0.32±0.03*△▲10 8 9 9 1 0 Caspase-3/β-actin 0.32±0.04 1.34±0.19*1.18±0.14*0.76±0.09*△▲0.73±0.07*△▲0.74±0.08*△▲Bax/β-actin 0.86±0.11 1.17±0.13*0.75±0.07*0.51±0.08*△▲0.38±0.05*△▲0.25±0.02*△▲
3 讨论
阿霉素为癌症化疗药物,能够从DNA 水平干预足突细胞DNA 生成,导致足突细胞变异,引发肾细胞损伤;此外,阿霉素还能够诱发肾小球上皮细胞发生脂质过氧化反应,破坏肾小球滤膜结构,形成蛋白尿,是目前肾病综合征动物模型常用的化学药物[6]。既往学者采用阿霉素制备肾病综合征大鼠发现大鼠出现大量蛋白尿,肾水肿、高血脂等肾病综合征典型特征[7],与临床人肾病综合征临床表现相似。本研究采用一次性尾静脉注射阿霉素后,经HE 染色发现与Control组相比,Model 组大鼠肾小球、肾小管发生明显病理损伤,肾组织损伤评分升高,胶原纤维比例升高,24 h 尿蛋白含量明显升高,血清学检测发现大鼠血清TP、ALB 水平降低,TC、TG、Scr、BUN、LDH 水平升高,纤维化蛋白TGF-β1、CTGF 表达升高,进一步表明大鼠蛋白代谢、脂代谢异常、肾功能发生障碍,与肾综合征大鼠模型制备结果相似[8],提示SRNS 大鼠模型复制成功。
在肾病发生过程中,会发生“溺毒”“肾劳”“肾风”等情况,患者主要表现为正虚邪实,因此中医认为,脾肾阳虚是肾综合征疾病的治疗目的。右归丸出自《景岳全书》,属于补肾代表方,临床药理学研究显示其能够缓解哮喘、增强机体免疫力,改善大鼠边缘系统等[9]。熊霞等[10]研究发现,右归丸能够降低肾衰竭患者血清中BUN 肾功能指标水平,改善肾功能并提高免疫力,降低炎症反应,进而缓解病情进展。于化新等[11]研究发现,右归丸可降低肾衰大鼠血清中Scr、BUN 水平,改善肾损伤,延缓肾衰的发生。上述研究说明,右归丸对肾病具有一定的缓解作用。本研究显示,经Prednisone 治疗后大鼠肾组织损伤、血清蛋白、脂代谢指标变化并不显著,而经Prednisone 联合右归丸治疗后,病理学检测发现肾小球、肾间质损伤得到一定的改善,血清TP、ALB 水平升高,TC、TG、Scr、BUN、LDH水平、纤维化蛋白TGF-β1、CTGF 表达降低,提示右归丸能够缓解SRNS 大鼠肾功能损伤,改善脂代谢、蛋白代谢。
MAPK 信号通路在细胞增殖、分化、应激、炎症等生理病理过程调控中发挥重要作用,JNK、p38 为通路主要成员,研究发现,在肾纤维化进展中,受到炎症刺激等可激活p38,使其发生磷酸化,且p38 磷酸化水平与氧化应激程度、纤维化程度密切相关[12-13]。Huang等[14]研究发现,激活Hk-2细胞中JNK信号通路后能够加速LPS 诱发的急性肾损伤。Yoon 等[15]研究发现,外源性cgrp 通过调控肾近端小管细胞中的cgrp 受体/pkc/jnk 信号通路,进而加速肾小管纤维化的方发生。Wang 等[16]研究发现,抑制JNK/p38 MAPK 信号通路和干扰氧化应激反应减轻大鼠肾缺血再灌注损伤,保护肾功能。本研究发现,与Control组相比,Model组大鼠肾组织中p38、JNK 蛋白磷酸化水平明显升高,推测JNK/p38 信号通路可能与SRNS 的发生有关。陈叶香等[17]研究发现右归丸通过抑制TGF-β1 诱导的EMT 过程进而缓解肾间质纤维化。本研究发现,经Prednisone联合右归丸治疗后,大鼠肾组织中p38、JNK蛋白磷酸化水平明显降低,提示右归丸对SRNS 大鼠肾功能的恢复可能是通过对JNK/p38信号通路的抑制来实现的。
肾组织细胞凋亡伴随着肾病发生发展,存在肾病的损伤及修复过程中。本研究通过采用Tunel 染色检测SRNS肾组织细胞凋亡情况,结果发现,与Control组相比,Model 组、Prednisone 组大鼠肾组织细胞凋亡率明显增加,经右归丸干预后,细胞凋亡率明显降低,推测右归丸具有抗肾组织细胞凋亡的作用。Bax、Bcl-2蛋白是研究较多的凋亡蛋白,研究证实Bax/Bcl-2 通路参与肾组织细胞凋亡[18],而Caspase-3是细胞凋亡的最终执行者[19]。本研究发现,与control 组相比,Model组肾组织中Caspase-3、Bax 蛋白表达显著升高,Bcl-2蛋白表达降低,经右归丸干预后,肾组织中Caspase-3、Bax 蛋白表达显著降低,Bcl-2 蛋白表达降低升高,推测右归丸可通过降低肾细胞凋亡进而发挥对肾脏的保护作用。
综上所述,右归丸能够缓解SRNS 大鼠肾组织损伤,保护肾功能,其可能是通过抑制Jnk/p38 信号通路,降低肾细胞凋亡实现的,然而,SRNS 发病机制较复杂,右归丸是否还可能通过其他途径发挥作用,还有待后续深入研究。

