填精通络方对糖尿病性勃起功能障碍大鼠组织RhoA/Rho信号通路相关因子表达的影响*
于旭东,刘蕊嘉,王继升,邓 省,鲍丙豪,商建伟
(北京中医药大学东直门医院 北京 100700)
1 研究背景
勃起功能障碍(Erectile dysfunction,ED),是指在性行为过程中阴茎无法达到或维持足够良好的勃起[1]。本病不仅使患者性功能低下,而且降低其生活质量,同时也是心血管疾病的预警信号。随着当前社会经济的快速发展,中青年一代压力与日俱增,流行病学调查显示,糖尿病(Diabetes mellitus,DM)患者的ED 发 病 率 达 到35%-90%[2],是 非DM 人 群 的1.9-4倍[3-5]。糖尿病性勃起功能障碍(Diabetes-induced erectile dysfunction,DIED)的发病是一个复杂的病理生理学过程,涉及血管内皮功能、周围神经系统、内分泌系统的改变等多因素。其中阴茎海绵体血管平滑肌舒张能力的下降被认为是引起勃起功能障碍的关键因素之一。近年来,许多研究发现平滑肌的收缩能力也是决定阴茎勃起功能的重要因素,其中代表性的信号通路RhoA/Rho是当前研究热点之一。
当前对于DIED 的治疗方法主要包括口服PED-5抑制剂、假体植入、负压吸引等,然而这些治疗手段都具有一定的副作用和局限性,口服PED-5 抑制剂类药物治标难治本,存在依赖性强、易复发等不足之处,外科手术治疗的适应症有限,且疗效一直备受争议[6]。中医药治疗DIED 有一定疗效,中医理论认为DIED 最主要的病机是肾虚血瘀,因此,填精通络方在临床一线中具有良好的应用效果,该方由仙灵脾、熟地、水蛭、川牛膝组成。仙灵脾和熟地补肾养血,填精益髓,水蛭和川牛膝活血通经逐瘀。现代中药药理学研究表明,这些药物具有改善血管内皮功能、修复内皮损伤的功效[7-8]。因此,本研究以阴茎海绵体血管平滑肌的收缩功能为切入点,观察填精通络方治疗DIED 模型大鼠勃起功能的疗效及其对RhoA/Rho 信号通路的影响,探索填精通络方的部分机制。
2 材料和方法
2.1 药物和试剂
实验所需药物主要包括造模药物和实验干预药物,其中造模使用的链脲佐菌素(STZ)和阿朴吗啡(APO)从中国上海Sigma-Aldrich 公司统一购置。实验干预所用阳性对照药他达拉非从Eli Lilly and Company购入,溶解后在适宜环境中储存备用。
2.2 中药的制备
所用中药颗粒来自北京中医药大学东直门医院(中国北京)。填精通络方的药物组成包括:熟地黄10g、仙灵脾15g、川牛膝10g、水蛭10g。制备工艺:中药饮片经单味提取、浓缩、干燥、制粒而成颗粒型,具体单味药颗粒型的制备工艺流程由北京同仁堂有限公司统一进行,填精通络方将已加工成颗粒状的相应药物按比例调配在一起完成中药的制备。质量标准:颗粒剂的质量标准由东直门医院药物质检部门统一检验合格后购入。颗粒剂购入后制备为溶解液将颗粒溶于蒸馏水中,浓度为700 mg/kg 灌胃,溶解后在适宜环境中储存备用。
2.3 动物和治疗
2.3.1 动物
SPF 级成年雄性SD 大鼠,8 周龄,体重(230±50)g,购自北京维通利华验动物科技有限公司(合格证号NO.SYXK(京)2012-0001,北京,中国)。大鼠在标准的实验室条件下饲养,提供标准食物和水。北京中医药大学东直门医院动物与人类伦理委员会批准了这项研究。
2.3.2 建立DIED大鼠模型
SD 大鼠禁食12 小时用STZ 溶液以腹腔注射的方式进行DIED 大鼠模型的建立。72 小时后,第1 周和第2周各从大鼠的尾静脉取血检测即时血糖水平。每次的检测结果>16.7 mmol/L,同时记录各组大鼠每日排尿情况和饮食情况,两者较前均增加则表明造模成功。根据Heaton的方法[9],将DM大鼠称重并放置在透明的玻璃箱中,光线暗到仅供观察,房间保持安静。在适应环境15分钟后,每只大鼠在颈部皮肤松弛处注射APO100 µg/kg 并观察30 分钟。阴茎增大,包皮回缩,龟头阴茎充血,阴茎末端出现称为阴茎勃起。如果勃起次数≥1,则认为勃起试验阳性。血糖> 16.7 mmol/L且勃起试验阴性的大鼠为DIED造模成功。
2.3.3 治疗
实验大鼠进行5 天的适应性喂养,之后随机选择10 只作为正常组,其余进行DIED 造模。其余造模成功的大鼠分为三组:模型组(DIED 组)(n=10)、对照组(他达拉非组)(n10)和填精通络组(n=10)。在随后的4周中,对照组的大鼠每天灌胃0.2 mg/kg他达拉非,填精通络组大鼠通过灌胃每天灌胃9.3 g/kg 填精通络中药。对照组和模型组大鼠给予等体积蒸馏水。每周称量大鼠,每天观察它们的健康状况。
2.4 勃起功能评估
药物干预4 周后,对各组大鼠阴茎勃起次数和勃起潜伏时间进行测试。具体方法是每只大鼠皮下注射APO,记录30分钟内勃起次数和勃起潜伏期。如果没有勃起,潜伏期记为30分钟。
2.5 组织的制备
治疗结束后称重大鼠并用戊巴比妥钠(50 mg/kg,腹膜内)麻醉。从每只大鼠取出阴茎组织并用冷盐水洗涤并用10%布因氏溶液固定24小时。脱水后,石蜡包埋,4-5µm 切片,苏木精和伊红(HE)染色。在显微镜下观察HE 染色的载玻片(BK-FL4,OPTEC,重庆,中国)。
2.6 Western Boltting
为检测RhoA、ROCK1和ROCK2,取出每只大鼠的海绵体组织的一部分,在冰冷的组织裂解缓冲液中匀浆。将混合物以12000 rpm 离心10 分钟后收集上清液。使用BCA 蛋白质测定试剂盒测定蛋白质浓度,用RIPA 调节蛋白质浓度并煮沸5 分钟。每个样品用10%SDS 聚丙烯酰胺凝胶分离,转移到聚偏二氟乙烯膜上。稀释比例分别为RhoA(1∶300)、ROCK1(1∶300)和ROCK2(1∶300)(BIOSS,北京,中国)。以βactin 作为内参(ImmunoWay Biotechnology Company,USA)进行免疫印迹,4℃水平摇床孵育过夜。第二天将二抗稀释后在室温下孵育30分钟,使用ECL检测系统(Millipore,USA)检测免疫反应信号。
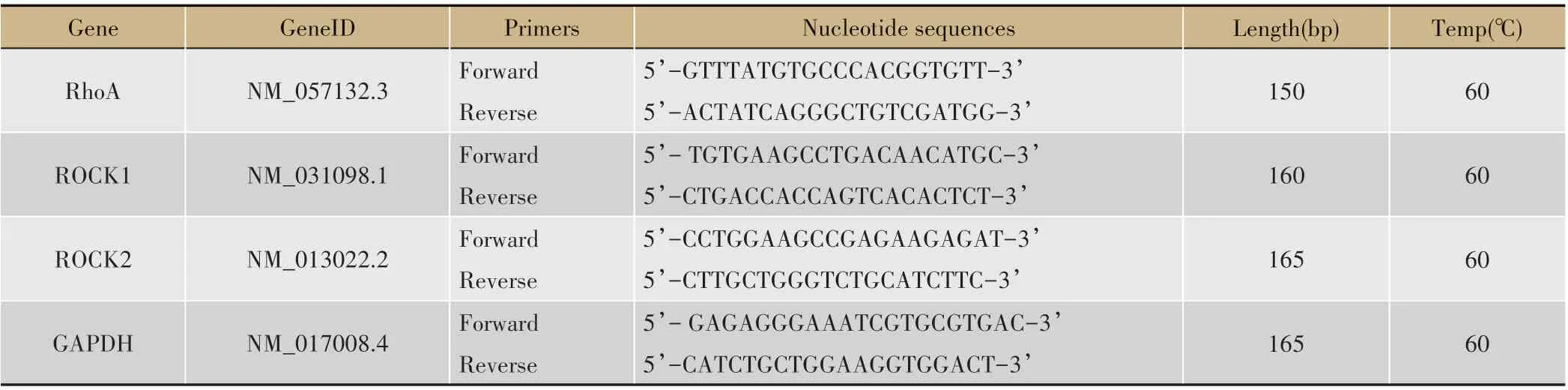
表1 靶基因的实时PCR引物序列

表2 各组大鼠治疗后勃起行为的比较
2.7 PCR检测RhoA,ROCK1和ROCK2 mRNA
用Trizol(TaKaRa Biotechnology,大连,中国)将海绵体组织匀浆。使用RNA 样品的OD260/OD280 比率评估RNA的质量。根据制造商的说明使用PrimeScript RT Master Mix(TaKaRa Biotechnology,Dalian,China)将总RNA 逆转录为cDNA。靶基因的实时PCR 引物序列如表1。
使用DNA 结合染料SYBRGreen 通过ABI 7500 系统(Applied Biosystems,CA,USA)进行cDNA 的扩增。使用GAPDH 作为内部参照基因,并使用2-ΔΔCt 方法评估RhoA,ROCK1和ROCK2 mRNA表达的变化。
2.8 统计分析
所有来自本研究的计量数据均使用SPSS 25.0 统计软件进行分析。结果表示为平均值± 标准偏差。若数据符合正太分布,各组间采用独立样本t检验;不满足正态分布情况下,若满足方差齐性,则使用单因素方差分析(ANOVA)分析组间差异,若不满足方差齐性,则采用非参数检验法,P<0.05表示差异显著。
表3 各组大鼠治疗前后血糖比较(mmol/L,±s)

表3 各组大鼠治疗前后血糖比较(mmol/L,±s)
注:与模型组比较,*P<0.01;与他达拉非组比较,#P<0.01
组别正常组模型组他达拉非组填精通络组n 10 10 10 10治疗前4.3±0.3 22.1±1.9 23.5±2.0 23.7±1.6治疗后4.2±0.4 23.6±2.2 24.8±1.0 18.8±1.3*#
3 结果
3.1 填精通络方对各组SD大鼠勃起行为的影响
结果如表2、图1 显示,与模型相比,对照组(他达拉非组/Tadalafil 组)和填精通络组阴茎勃起次数显著增加,潜伏期缩短(P<0.01 和P<0.05)。对照组和填精通络组之间没有显著差异。
3.2 填精通络方对各组SD大鼠血糖的影响
实验结果表明,填精通络方能明显降低大鼠血糖水平。填精通络组治疗后血糖均显著低于治疗前血糖(P < 0.01)。与模型组比较,填精通络组的血糖明显降低(P<0.01);与他达拉非组比较,填精通络组的血糖明显降低(P<0.01)。实验结果见表3。
3.3 填精通络方对DIED大鼠组织病理学的影响

图1 各组大鼠治疗后勃起行为的比较
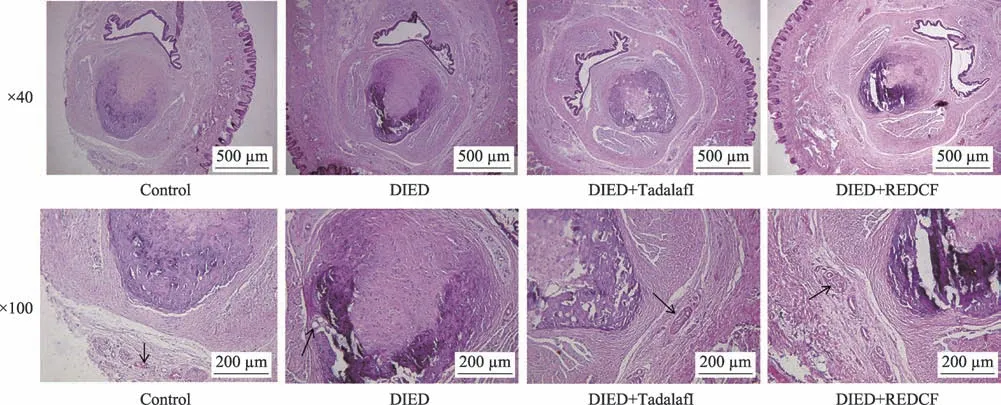
图2 各组大鼠阴茎海绵体HE染色结果(×40;×100,n=3)
正常组阴茎海绵窦毛细血管丰富,呈网状交织,未见明显的阴茎海绵体间隔,可见大量不规则血窦间隙,血窦、内皮细胞、平滑肌细胞、间质组织及微血管腔结构清晰,血窦间隙表面附有扁平的内皮细胞,血窦小梁含有大量平滑肌细胞及胶原纤维。模型组(DIED 组)阴茎海绵体间隔明显,阴茎海绵体血窦、内皮细胞、平滑肌细胞分布杂乱,阴茎海绵体平滑肌细胞数量减少,血管内皮细胞连续性破坏,胶原纤维密度增加,间质组织大量增生、排列紊乱,血管壁增厚,呈纤维样变,管腔变小或闭塞,提示血管破坏,红细胞数目减少,同时可见结缔组织增生,如箭头所指部位细胞连续性受到破坏,排列紊乱。对照组(他达拉非组/Tadalafil 组)和填精通络组(REDCF 组)阴茎海绵体血管中红细胞数目较模型组增多,但结缔组织差异不明显,病理变化介于两者之间,如箭头所指部位对照组与填精通络组治疗后组织结构较模型组改善明显,见图2。
3.4 填精通络方对DIED 大鼠RhoA,ROCK1 和ROCK2 mRNA表达的影响
实时荧光定量PCR 检测海绵体相关基因mRNA表达水平见图3。与空白组相比,模型组(DIED 组)、对照组(他达拉非组/Tadalafil 组)和填精通络组(REDCF 组)RhoA,ROCK1 和ROCK2 的mRNA 水平显着 升 高(P < 0.01 和P < 0.05)。与DIED 组 相 比,Tadalafil 组 和REDCF 组RhoA,ROCK1 和ROCK2 mRNA 的 表 达 显 着 降 低(P < 0.01 和P < 0.05)。Tadalafil组与REDCF组之间无显着差异。
3.5 填精通络方对DIED 大鼠RhoA,ROCK1 和ROCK2蛋白表达的影响
如图4 所示,本研究发现对照组(他达拉非组/Tadalafil 组)和填精通络组(REDCF 组)的RhoA,ROCK1 和ROCK2 蛋白水平低显著低于模型组(DIED组)(P < 0.01 和P < 0.05)。RhoA 蛋白水平高于对照组(P < 0.01)。对照组(他达拉非组/Tadalafil 组)和填精通络组(REDCF 组)之间RhoA,ROCK1 和ROCK2蛋白表达无显著性差异。
4 讨论
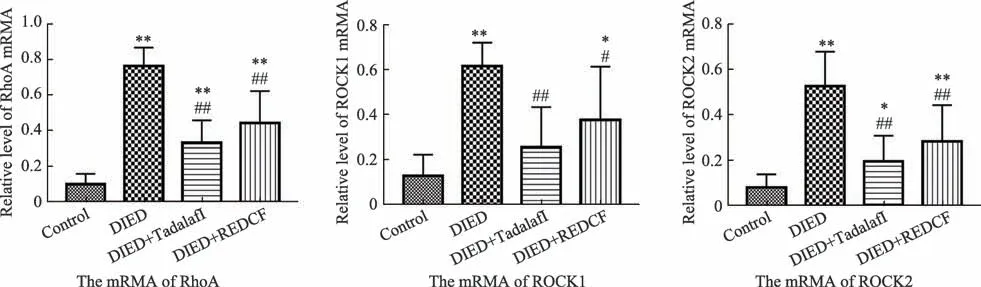
图3 各组大鼠RhoA,ROCK1和ROCK2 mRNA表达水平

图4 各组大鼠RhoA/Rho信号通路相关蛋白表达水平
肾精亏虚、脉络瘀阻贯穿DIED 发生发展的始终,在治疗上以补肾活血、填精通络为主要原则。辨证施治的时需在补肾活血,填精通络的前提下,再根据不同的证型具体的临证加减药物及其用量。“气为血之帅,血为气之母。”气虚则难以推动血行,导致气虚血瘀,脉络瘀阻。使得宗筋不得气血之濡养,则发为阳痿。所谓“肾虚必致血瘀,瘀血必归于肾”,是因为血瘀脉络而导致肾精化生不畅。因此,DIED 在治疗上应以补肾活血,填精通络为主要的治疗方法,肾精得补,瘀血得散才能使得肾中精气化生有源,宗筋得以气血濡养,方能起痿。
临床上,本研究发现填精通络方在治疗DIED 上有着良好的效果,不仅能过改善患者勃起功能,还能明显辅助降低患者血糖。研究表明DIED 的严重情况和血糖控制情况是密切的,DIED 的治疗是以控制血糖为基础的,防止糖尿病对血管、神经的进一步损害。本实验结果表明,填精通络组治疗后血糖均显著低于治疗前血糖,但血糖降低的幅度并不大,可见在治疗DM的时候,还是其他辅助方式来治疗DM。
目前,在实验研究方面,ED 的研究主要集中在海绵体和血管平滑肌舒张功能的减弱上。实际上,良好的阴茎勃起还取决于收缩功能。在松弛状态下,海绵体和血管平滑肌的收缩是主要的;而在勃起状态下,其松弛是主要的。阴茎必须首先克服平滑肌的收缩力才能完全勃起。因此,海绵体和血管平滑肌收缩功能增强也是诱导ED 发生的重要机制[10-11]。2001 年,Chitaley 等[9]首次发现阴茎海绵体组织中表达内源性Rho 激酶(ROCK)。近年来,许多研究发现RhoA/Rho激酶途径参与DIED 发生[12-13]。该通路中的RhoA 是一种小分子的GTP 结合蛋白,属于Ras 相关的Rho 家族,主要以非活化的状态与二磷酸鸟苷(guanosine diphosphate,GDP)结合,是无活性的GDP 与活性的GTP 的分子开关。Rho 激酶是一种丝氨酸/苏氨酸激酶,有两种亚型:ROCK1、ROCK2,它们可以增高胞浆内Ca2+浓度,使胞浆中的Ca2+与钙调蛋白结合,活化肌球蛋白轻链激酶(MLCK),使其磷酸化,导致肌球蛋白和肌动蛋白发生交联,最终引起平滑肌的收缩[14-15]。同时,RhoA/Rho 激酶通路可通过抑制eNOS 的磷酸化从而减少NO的产生,进而减弱平滑肌的舒张功能。
本实验所采用的STZ注射造模,是经典的DIED造模方法。根据前期研究基础,本实验选用50 mg/kg 的注射量,造模阶段STZ 造模组与造模空白对照组比较逐渐出现明显多尿、多饮、多食、体重下降现象,体毛逐渐枯黄,无光泽,反应逐渐迟钝,这与中医的“消渴”病症状相符;同时,对DM 大鼠使用APO 筛选后,成功选取勃起功能障碍大鼠,成功构建DIED 大鼠模型。本实验所采用的阳性对照药物他达拉非是PDE5 抑制剂之一,临床广泛用于治疗ED。研究证实PDE5-Is对Rho/ROCK 通路有影响。PDE-5 抑制剂可能通过几种生物学机制改善症状,包括Rho 相关蛋白激酶失活的改变[16]。故本研究选择了他达拉非作为阳性对照药物。
从实验结果可以看出,第一,本研究可以得出结论:STZ 造模的DIED 大鼠RhoA/Rho 激酶表达增加。第二,根据勃起行为的结果,填精通络方和他达拉非干预后勃起功能增强。第三,填精通络方治疗改善了阴茎海绵体的形态学改变。第四,经填精通络方干预后,RhoA、ROCK1 和ROCK2 的表达显着下降,可认为填精通络方改善DIED 大鼠勃起功能的机制之一可能是下调RhoA/Rho 激酶的表达。而且,根据DIED 组的结果,本研究可以发现他达拉非还具有降低RhoA/Rho通路的蛋白表达的功效。先前的研究已证实PDE5-Is对Rho/ROCK 通路有影响,这与实验结果一致,并且此研究进一步证明了RhoA,ROCK1 和ROCK2 参与介导该过程。在勃起时,RhoA/Rho 通路被抑制,从而引起海绵体平滑肌舒张增强和收缩减弱。相反地,RhoA/Rho通路的激活抑制海绵体平滑肌的舒张功能并促进收缩功能,最终导致勃起功能障碍[17]。因此,RhoA/Rho蛋白的高表达意味着平滑肌舒张功能的下降与收缩能力的增强,也就是勃起功能的减弱。
5 结论
本实验的研究结果表明,填精通络方改善了由STZ构建的DIED 大鼠的勃起功能,其作用机制可能是下调RhoA、ROCK1 和ROCK2 蛋白在RhoA/Rho 通路中的表达,为RhoA/Rho 成为治疗DIED 的新靶点提供重要依据。

