合成条件对电解锰渣制备水化硅酸钙的溶解性能与溶解动力学的影响
李昌新,喻源,张庆武,汪洋,钟宏,王帅
(1.南京工业大学 安全科学与工程学院,江苏 南京 211816;2.中南大学 化学化工学院,湖南 长沙 410083;3.中南大学 锰资源高效清洁利用湖南省重点实验室,湖南 长沙 410083)

1 实验部分
1.1 材料与仪器
锰渣为湘西某电解锰厂渣库中堆存的废渣(pH为5.50,水溶性物质占24.43%,锰渣中主要化学成分如下:SiO2(24.6%),Al2O3(12.25%),MnO(4.6%),Fe2O3(7.9%),CaO(8.6%),锰渣的物相构成非常的复杂,但锰渣的物相构成主要为:石英(SiO2),石膏(CaSO4·2H2O));硅酸钠、氢氧化钠、PEG 400、无水乙醇均为分析纯;水为去离子水。
Optima 5300型电感耦合等离子体原子发射光谱(CP)。
1.2 C-S-H材料的制备
电解锰渣经2 mol/L HNO3于80 ℃下活化2 h后,过滤得到浸出渣及浸出液,其中浸出渣的综合利用见本课题组的前期研究,锰渣基C-S-H的制备以浸出液为原料,C-S-H的制备工艺见图1。本研究中,C-S-H 的制备采用碱硅酸盐与钙盐的溶液反应法,根据前期工作及文献报道[10],选取Ca/Si=1∶1(摩尔比),在制备C-S-H时首先将一定体积的2#滤液逐滴滴加到100 mL 0.1 mol/L硅酸钠溶液中,同时保证搅拌均匀,其中硅酸钠溶液中先预溶0.6 mL/L的PEG 400;待全部滴加完全时以0.5 mol/L 氢氧化钠溶液调整溶液至一定pH值,然后将上述悬浮液于一定温度下剧烈搅拌反应2 h后,继续在该温度下晶化一定时间。晶化完成后过滤,先后用去离子水和无水乙醇充分洗涤、过滤并于80 ℃干燥4 h得到C-S-H粉体。
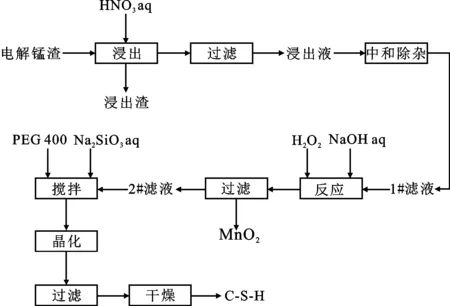
图1 电解锰渣制备C-S-H实验流程图
1.3 C-S-H材料溶钙性能测定
向装有100 mL蒸馏水的250 mL锥形瓶中加入所制备得到的C-S-H 0.4 g,在25 ℃、100 r/min恒温恒速搅拌条件下,在预设的时间间隔下,取上层清液,离心后测定溶液中Ca2+的浓度。Ca2+浓度的测定采用电感耦合等离子体原子发射光谱(ICP)测定。
2 结果与讨论
2.1 反应pH值对C-S-H材料溶解动力学的影响
由于水化硅酸钙除磷的主要机制是该材料自发溶出Ca2+与含磷溶液中的磷酸根离子反应形成(羟基)磷酸钙沉积物,因此考察所制备的C-S-H的溶钙性能是十分必要的。图2为不同反应pH值下制备的C-S-H的溶钙曲线。

图2 反应pH值对C-S-H溶钙能力影响
由图2可知,C-S-H材料溶出的Ca2+浓度随着反应pH值的增加,呈现出先增加后降低的趋势,当达到反应平衡时,于pH 11.0,12.0,13.0下制备的C-S-H溶出钙浓度分别为8.64,11.52,10.02 mg/L。由此可见,当反应pH在12.0时,C-S-H的溶钙性能较好。
本研究用Avrami[11]动力学方程处理数据,此方程首先由Avrami提出,Kabai[12]将其应用于多相反应体系,其模型方程如下:
-ln(1-x)=ktn
(1)
将式(1)两边同时取自然对数得到下式:
ln[-ln(1-x)]=lnk+nlnt
(2)
其中,k为速率常数;n为固相的特征常数;t为反应时间;x为溶解分数(即为t时刻的溶解浓度Ct与最大溶解浓度Cmax之比)。
通过式(2)对不同反应pH值下制备所得的C-S-H材料溶钙数据进行分析和处理,结果见图3,分别求得其k值和n值,并拟合得出如下动力学方程:
pH 11.0:-ln(1-x)=0.030 12t0.933 9
pH 12.0:-ln(1-x)=0.076 54t0.770 5
pH 13.0:-ln(1-x)=0.066 72t0.832 2
拟合方程相关系数R2均>0.99,线性相关性较好,表明Avrami动力学模型方程式能够用于描述在不同pH值下制备所得的C-S-H材料在水溶液中的溶解动力学特征。同时,根据拟合所得的动力学方程,速率常数k值也随着反应pH值增加,先增加后降低,其与不同反应pH值下制备所得的C-S-H材料钙出钙离子浓度曲线变化趋势基本吻合(见图3)。
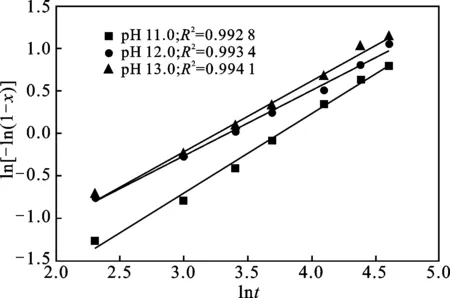
图3 不同反应pH值下ln[-ln(1-x)]与lnt的关系Fig.3 Plot of ln[-ln(1-x)] vs.lnt under various pH value
2.2 晶化时间对C-S-H材料溶解动力学的影响
控制反应体系初始Ca/Si=l.0,反应pH值12.0,反应温度100 ℃,不同晶化时间下制备所得的C-S-H材料的溶钙曲线见图4。
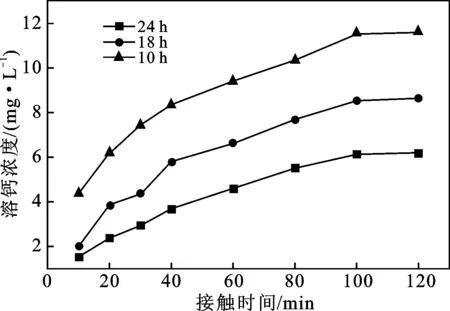
图4 晶化时间对C-S-H溶钙能力影响
由图4可知,晶化时间为10 h的C-S-H溶出的Ca2+浓度最大,而晶化时间为24 h的C-S-H溶出的 Ca2+浓度最小。
通过式(2)对不同晶化时间下制备所得的C-S-H 材料溶钙数据进行分析和处理,结果见图5,分别求得其k值和n值,并拟合得出如下动力学方程:
晶化时间10 h:-ln(1-x)=0.076 54t0.770 5
晶化时间18 h:-ln(1-x)=0.026 79t1.004 1
晶化时间24 h:-ln(1-x)=0.017 12t1.103 4
拟合方程相关系数R2均>0.99,线性相关性较好,表明Avrami动力学模型方程式能够用于描述在不同晶化时间下制备所得的C-S-H材料在水溶液中的溶解动力学特征。同时,根据拟合所得的动力学方程,速率常数k值随着晶化时间的增加而逐步降低,其与不同晶化时间下制备所得的C-S-H材料钙出钙离子浓度曲线变化趋势基本吻合(图4)。
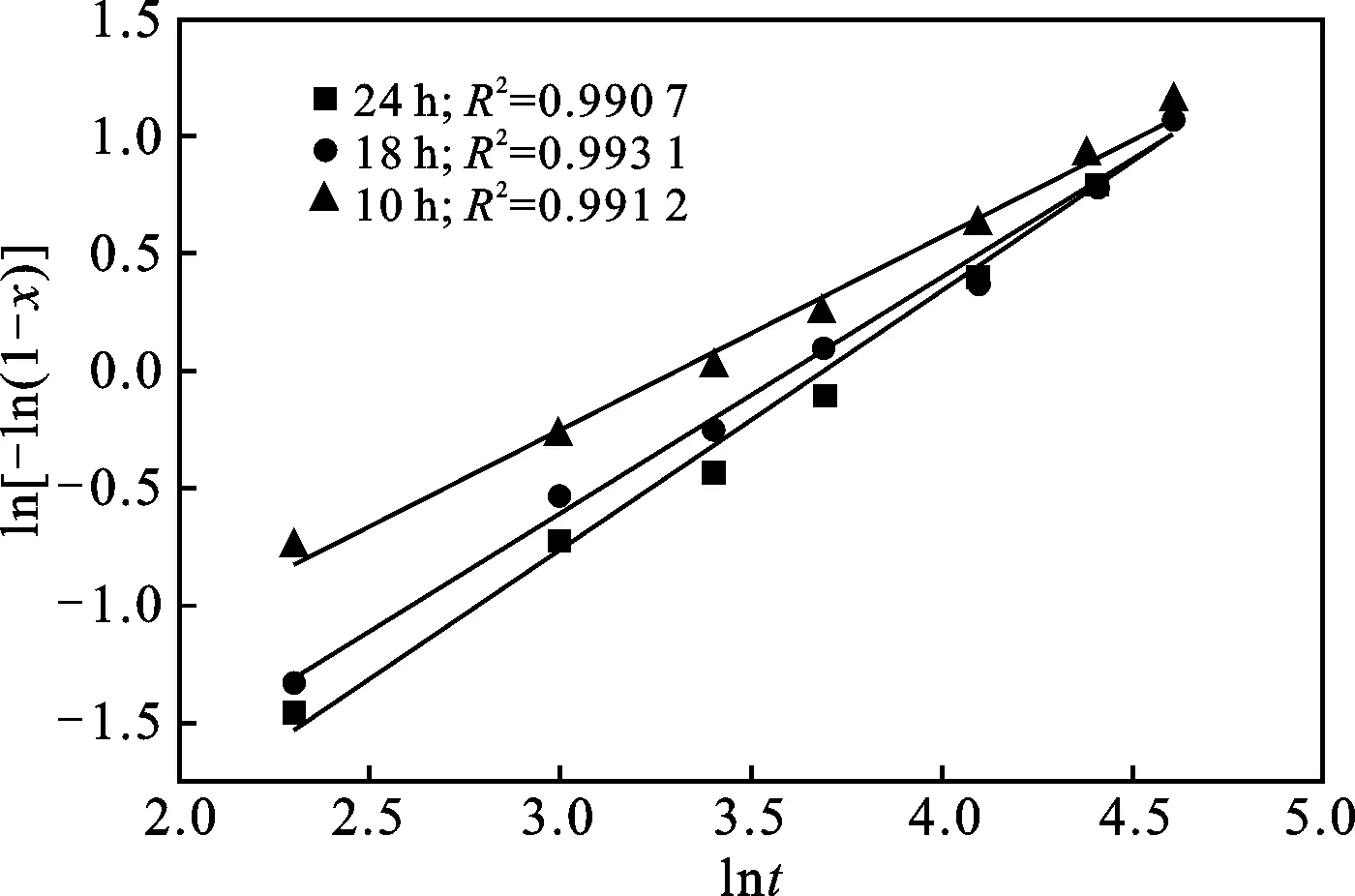
图5 不同晶化时间下ln[-ln(1-x)]与lnt的关系
2.3 反应温度对C-S-H材料溶解动力学的影响
在初始Ca/Si=l.0,反应pH值12.0,晶化时间10 h的条件下考察了反应温度对制备所得的C-S-H溶钙性能的影响,结果见图6。

图6 反应温度对水化硅酸钙溶钙能力影响Fig.6 Concentration of Ca2+ dissolved by the synthesized C-S-H under various reaction temperature
由图6可知,不同反应温度合成的C-S-H材料在水中Ca2+溶出浓度存在差异,其中,当反应温度为100 ℃时,溶出Ca2+浓度达到11.52 mg/L,而反应温度为60 ℃时,溶出Ca2+浓度仅为7.14 mg/L。
通过式(2)对不同反应温度下制备所得的C-S-H 材料溶钙数据进行分析和处理,结果见图7,分别求得其k值和n值,并拟合得出如下动力学方程:
反应温度60 ℃:-ln(1-x)=0.015 99t1.129 8
反应温度80 ℃:-ln(1-x)=0.038 45t0.945 4
反应温度100 ℃:-ln(1-x)=0.076 54t0.770 5
拟合方程相关系数R2均>0.99,线性相关性较好,表明Avrami动力学模型方程式能够用于描述在不同反应温度下制备所得的C-S-H材料在水溶液中的溶解动力学特征。同时,根据拟合所得的动力学方程,速率常数k值随着反应温度的增加而逐步增加,速率常数k与不同反应温度下制备所得的C-S-H材料钙出钙离子浓度曲线变化趋势基本吻合(图6)。

图7 不同反应温度下ln[-ln(1-x)]与lnt的关系Fig.7 Plot of ln[-ln(1-x)] vs.lnt under various reaction temperature
3 结论
采用电解锰渣为主要原料制备C-S-H材料,研究水热合成体系中反应pH值、反应温度、晶化时间等因素对合成C-S-H材料的溶钙性能与溶解动力学的影响。实验结果表明,C-S-H材料的溶钙性能与溶解动力学与反应制备过程中反应pH值、反应温度、晶化时间等因素紧密相关,通过调节反应pH值、反应温度、晶化时间等可控制材料的溶钙速率,进而增大材料的除磷活性。另外,以钙离子溶出实验数据进行拟合,C-S-H材料在水溶液中的钙溶出过程符合Avrami型溶出动力学模型。

