地锦草有效成分的提取及其生物活性的研究
许慧瑶, 薛建云, 卢玉栋, 郑文贺
(1. 福建师范大学 化学与材料学院,福建省先进材料化工基础重点实验室,福建 福州350117;2. 福建中医药大学附属人民医院,福建 福州350004)
地锦草(Euphorbiae humifusa)为双子叶植物纲大戟目大戟科大戟属地锦草科[1],又有铺地草、血见愁、乳汁草、地瓣草等40多个别名[2],是一种疗效显著的中草药,也是维吾尔族药材和蒙药材。地锦草生命力旺盛,在路边庭院间随处可见,除广东、广西外,分布遍及全国各地,来源广泛,资源丰富[3]。地锦草主要含槲角素甙类、山奈素甙类以及其他黄酮类化合物[4],具有凉血止血、清热止痢、通乳汁、清热解毒、利湿退黄等功效,药理研究证实黄酮类化合物是地锦草抗菌、止血、抗氧化的主要有效成分,地锦草煎剂、醇提取液及地锦草素均有抗菌止血[5]的作用。地锦草在临床中得到很大程度的应用,多用于治疗痢疾、外伤出血、乳汁不足、肠炎、咳血、便血、崩漏[6]等病症。还可以将地锦草运用到功能性食品、化妆品和制药行业[7]。
黄酮类化合物具有很强的抗氧化性、抗菌、抗病毒能力,可以清除体内过剩的自由基,起到保护机体的作用,具有很好的免疫调节作用,而且对多种酶均有抑制作用[8]。
提取黄酮类化合物方法有溶剂法,比较常用的溶剂一般有水、甲醇、乙醇、乙醚、氯仿等[9-10],提取方法有超声辅助提法、生物酶方法、超临界流体萃取法等[11-13]。
本文主要对地锦草的黄酮类化合物进行提取,并考察其抗氧化、抗菌、酶抑制等性能,为地锦草的应用提供前期研究。
1 实验
1.1 仪器与试剂
VIS-721可见光分光光度计(上海佑科仪器仪表),CARY 50紫外可见光度计(Varian公司),RE-52A旋转蒸发仪(上海亚荣生化仪器厂),500 mL索氏提取器(临沂正衡化玻仪器有限公司),细(霉)菌培养箱(福州科远贸易有限公司),无菌操作台(苏州净化设备有限公司)。
地锦草(安徽省亳州市润邦食品有限公司),芦丁、无水乙醇、无水甲醇、氢氧化钠、抗坏血酸、双氧水、碘、碘化钾、可溶性淀粉、六水合硫酸亚铁(国药集团化学试剂有限公司,AR),亚硝酸钠(天津市瑞金特化学品有限公司,AR),硝酸铝(天津市红岩化学试剂厂,AR),水杨酸(上海实验试剂有限公司,AR),磷酸氢二钠十二水合物、磷酸二氢钠二水合物(上海展云化工有限公司,AR),α-淀粉酶(江苏锐阳生物科技有限公司,AR),大肠杆菌、枯草芽孢杆菌、青霉、曲霉(由福建师范大学生科院提供),所用水均为去离子水。
1.2 地锦草提取工艺
1.2.1 芦丁标准曲线的绘制[14]
准去称取2.5 mg芦丁标准品,用50%甲醇定容至10 mL,得到浓度为250 μg/mL的芦丁标准溶液。然后分别取0.0、1.0、2.0、3.0、4.0、5.0 mL的芦丁标准溶液于25 mL的容量瓶中,加入5%的亚硝酸钠1 mL,摇匀,放置6 min;加10%硝酸铝1 mL,摇匀,放置6 min;再加4%氢氧化钠10 mL,加水定容至刻度,摇匀,放置10 min。在紫外可见分光光度计上于其最佳吸收波长510 nm处测其吸光度,并以浓度为横坐标,吸光度为纵坐标,绘制浓度-吸光度标准曲线。
地锦草提取物中总黄酮含量的计算公式如式(1)所示。

式中:Fc是地锦草中总黄酮含量,mg/g;c是样品吸光度代入标准曲线计算所得浓度,ug/mL;V是溶液试样所需溶剂体积,mL;V1是吸取试样溶液的体积,mL;V2是稀释试样溶液体积,mL;m-地锦草的质量,g。
1.2.2 乙醇浓度对地锦草有效成分提取的影响
称取地锦草10 g,分别加入20倍量75%、80%、85%、90%的乙醇溶液,90℃的水浴下,用索氏提取器回流提取3次,用旋转蒸发仪将提取液进行浓缩,并计算浓缩液总黄酮的含量,最后烘干称重。
1.2.3 料液比对地锦草有效成分提取的影响
称取地锦草10 g,分别加入15、20、25倍量的90%的乙醇溶液,90℃的水浴下,用索氏提取器回流提取3次,用旋转蒸发仪将提取液进行浓缩,并分别计算浓缩液总黄酮的含量,最后烘干称重。
1.2.4 提取次数对地锦草有效成分提取的影响
称取地锦草10 g,加入20倍量90%的乙醇溶液,90℃的水浴下,用索氏提取器分别回流提取1、2、3次,用旋转蒸发仪提取液进行浓缩,并分别计算浓缩液总黄酮的含量,最后烘干称重。
1.3 抗氧化性能的测定[15-16]
1.3.1 空白组
向25 mL容量瓶依次加入2 mL浓度为0.2 mmol/L六水合硫酸铁溶液,1.5 mL浓度为0.2 mmol/L水杨酸溶液,最后加入0.2 mL 体积分数为0.3%的双氧水,用水定容到25 mL,摇匀,用721可见光分光光度计在波长510 nm下测定吸光值A0,平行测定3组,取其平均值。
1.3.2 样品组
取5个25 mL容量瓶,向每个容量瓶中加入2 mL浓度为0.2 mmol/L六水合硫酸铁溶液,1.5 mL浓度为0.2 mmol/L水杨酸溶液,0.2 mL体积分数为 0.3%的双氧水,反应5 min后,向容量瓶中依次加入0.04 g/L的地锦草提取物1 mL、2 mL、3 mL、4 mL、5 mL,用水定容到25 mL,摇匀,反应5 min,用721可见光分光光度计在波长510 nm下测定吸光值AX,平行测定3组取其平均值。
1.3.3 对照组
用0.2 mL的蒸馏水替代双氧水,用721可见光分光光度计在波长510 nm下测定吸光值AX0,平行测定3组,取其平均值。
地锦草提取物对羟自由基的清除率按式(2)计算。
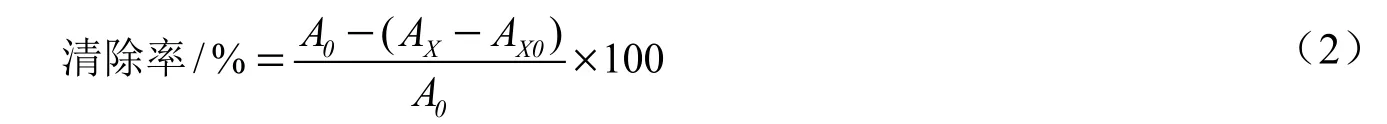
式中:A0是空白组样品的吸光值,AX是样品的吸光值,AX0是对照组样品的吸光值。
1.4 地锦草提取物抗菌实验[17]
采用纸片琼脂扩散法对地锦草提取物抑制大肠杆菌、枯草芽孢杆菌、青霉、曲霉进行试验,每种菌实验重复3次,抑菌效果取3次实验平均值。
1.5 地锦草提取物对α-淀粉酶活性的抑制试验[18]
1.5.1 地锦草提取物的浓度对α-淀粉酶活性的影响
取20 μL α-淀粉酶(由pH 6.8的磷酸缓冲溶液配制),加入20 μL不同浓度的地锦草提取物,于37℃的酶标仪中振荡数下,并恒温10 min后,加入0.4 g/L 140 μL淀粉溶液(称取0.4 g淀粉溶于pH 6.8磷酸缓冲溶液中并煮沸,冷却后定容至100 mL容量瓶,使用时稀释10倍),在酶标仪中振荡数下,且反应2 min后,迅速滴加30 μL 0.01%碘液[19],振荡,在波长为660 nm下测定波长A0。平行测定三组,取其平均值,若实验数据波动比较大,则在舍去原有数据的基础上进行补测,直至数据趋于比较稳定为止。设置空白组,用等体积pH6.8磷酸盐缓冲溶液代替地锦草提取物,于660 nm测定波长A,地锦草对α-淀粉酶的抑制率按式(3)计算。

式中:A0是样品在660 nm激发波长下测定的样品波长,A是空白样品在660 nm激发波长下测定的样品波长。
1.5.2 地锦草提取物的温度对α-淀粉酶活性的影响
将25 mL浓度为0.001 6 g/mL的地锦草提取物分别置于40℃、50℃、60℃、70℃、80℃的恒温水浴中,保温30 min。冷却至室温后,按“1.5.1”的步骤测定对α-淀粉酶活性,并计算其抑制率。
1.5.3 地锦草提取物的pH值对α-淀粉酶活性的影响
分别用pH值为 4.5、5.7、6.8、7.5的缓冲溶液配制相同浓度的地锦草提取物后,按“1.5.1”的步骤测定对α-淀粉酶活性,并计算其抑制率。
2 结果与讨论
2.1 地锦草提取工艺
2.1.1 芦丁标准工作曲线
以芦丁标准品的浓度为横坐标,吸光度为纵坐标来绘制标准曲线,并对曲线进行拟合得到的线性回归方程为:Y=0.005 83 X+0.042 5,其中R2=0.998 7,这说明在芦丁在0~50 μg/mL具有良好的线性关系,符合定量所需,其工作曲线如图1所示。
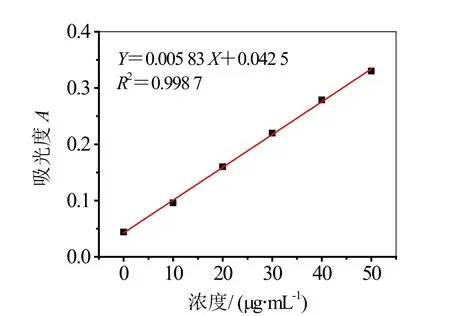
图1 芦丁标准品的工作曲线
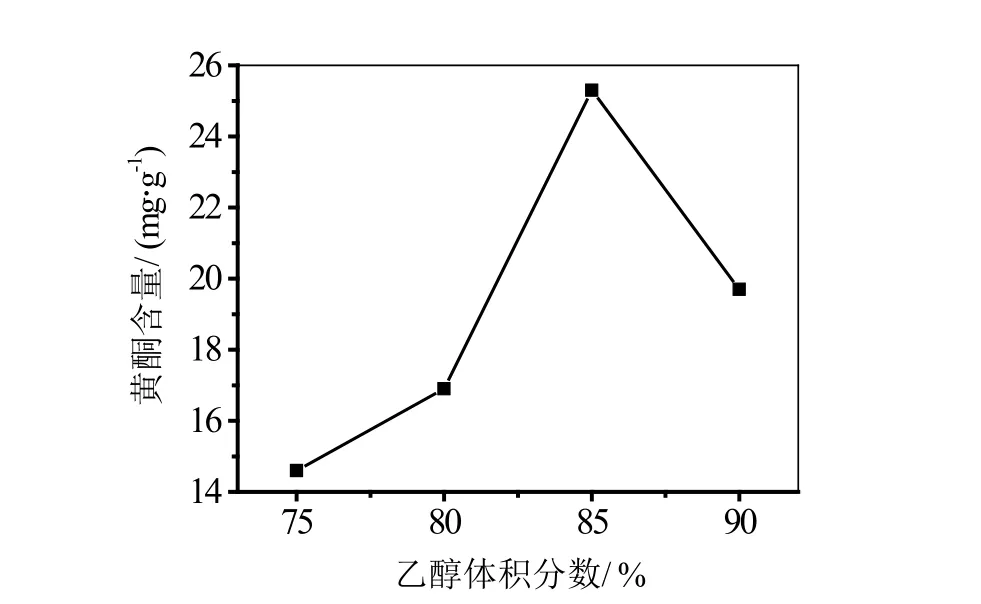
图2 乙醇浓度对地锦草提取效果的影响
2.1.2 乙醇浓度对地锦草提取效果的影响
采用不同浓度的乙醇溶液对地锦草进行提取,地锦草提取物中总黄酮含量与乙醇浓度的关系如图2所示。由图2可知,当乙醇浓度在75%~85%之间,总黄酮含量是随着浓度的增大而升高,在浓度为85%之后,随浓度的增大而下降。这是由于随着乙醇浓度的增加,溶液中的总黄酮含量也随之升高,然而当浓度过大时,溶液极性变小,会使得地锦草中的其他成分也随之进入到溶液中,所以总黄酮含量变小。因此在一定浓度范围内,乙醇浓度的增加与地锦草中总黄酮含量呈现正相关的计量关系。本实验测得的地锦草提取的最佳提纯浓度为85%。
2.1.3 提取次数对地锦草提取效果的影响
对地锦草进行不同次数的提取,考察地锦草提取物中总黄酮含量与提取次数的关系,结果如表1所示。
由表1可知,随着提取次数的增加,溶液中总黄酮含量也随之增加。从1次增加到2次的总黄酮含量增长的趋势明显大于从2次增加到3次。这是由于随着提取次数的增加,地锦草中的黄酮逐渐进入乙醇溶液中,提取次数越多,进入溶液中的黄酮便越多,但是随着回流次数的增加,能耗、时间都逐步增加,综合考虑之下回流提取3次最佳。
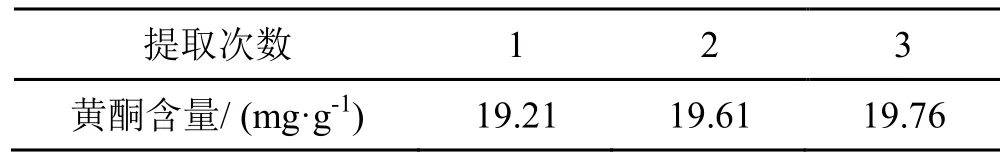
表1 提取次在数对地锦草提取效果的影响
2.1.4 料液比对地锦草提取效果的影响
采用体积分数为85%的乙醇对地锦草进行提取,考察料液比对地锦中黄酮提取的影响,其结果如图3。
由图3可知,随着料液比得到增加,溶液中总黄酮含量随之呈现下降趋势。这是由于在其他条件都不变的情况下,随着料液比的增加,只是增加了溶剂的量,但是地锦草中总黄酮的含量是固定的,提取必定存在极限,继续增大料液比反而使得浓缩过程不能够彻底进行。从图3可以看出,在料液比为1∶15时,溶液中总黄酮含量最高,因此本实验测得的最佳料液比为1∶15。
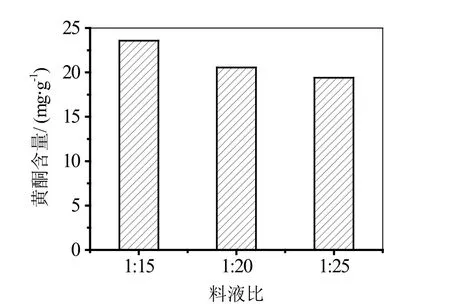
图3 料液比对地锦草中黄酮提取的影响
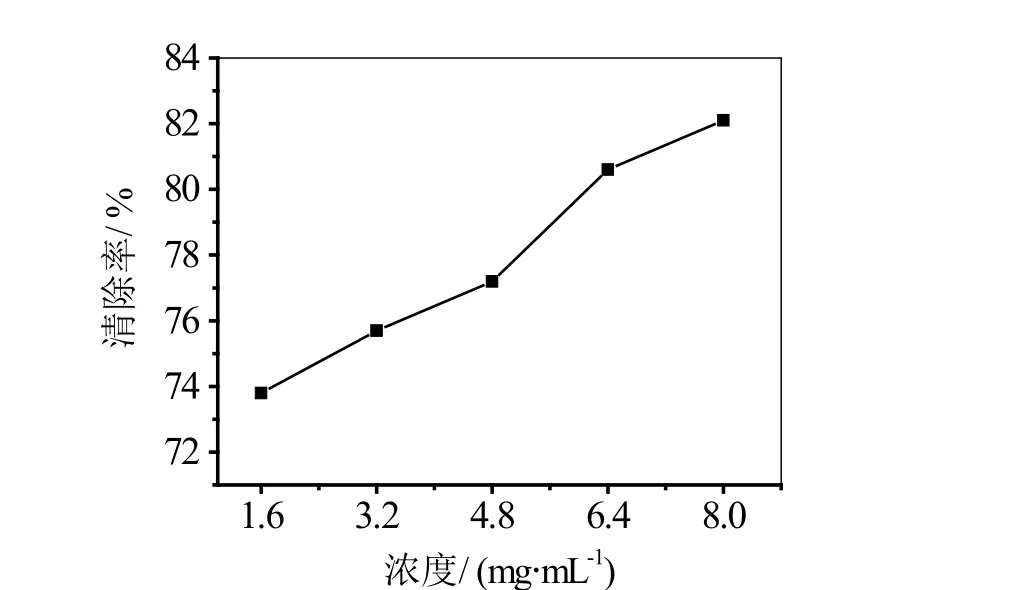
图4 地锦草提取物浓度对羟自由基清除效果的影响
2.2 地锦草提取物浓度对羟自由基清除效果的影响
采用不同浓度的地锦草提取物对羟自由基进行清除实验,地锦草提取物浓度对羟自由基的清除关系如图4所示。
由图4可知,随着地锦草提取物浓度的增加,对羟自由基清除率的也随之增大,当浓度达到8.0 mg/mL时,其清除率达到82.04%。说明浓度越大,对羟自由基的清除效果越好,这是由于相同数量的羟自由基,浓度大的提取物对其清除速度快,清除效率高。
2.3 地锦草抗菌性能的测定
为了考察地锦草提取物的抗菌性能,采用纸片琼脂扩散法进行抗菌实验,实验结果如表2所示。
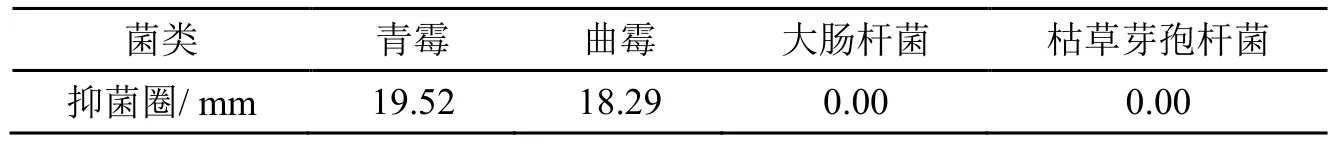
表2 地锦草提取物抗菌性能
由表2可知地锦草对青霉、曲霉均有抑菌效果,且青霉的抑菌圈达到19.52 mm,曲霉的抑菌圈达到18 .29 mm,但是对大肠杆菌和枯草芽孢杆菌的抗菌效果几乎为0,并没有明显的抑菌圈出现。
2.4 地锦草提取物对α-淀粉酶抑制作用
2.4.1 地锦草提取物浓度对α-淀粉酶活性的影响
参照“1.5.1”的实验方法来探究地锦草提取物的浓度对α-淀粉酶活性的影响,其结果如图5所示。
由图5可知,随着地锦草提取物浓度的增大,对α-淀粉酶的抑制率先随着增大,当达到一定数值后,随着地锦草提取物浓度的增大而减小。当地锦草提取物浓度在1.6~4.8 mg/L之间,抑制率随着浓度的增大而升高,当浓度超过4.8 mg/L之后,随浓度的增大而下降。因此,4.8 mg/L为抑制作用最强的浓度。在一定浓度范围内,随着地锦草提取物的增加,其对α-淀粉酶的抑制作用呈现正相关的计量关系。
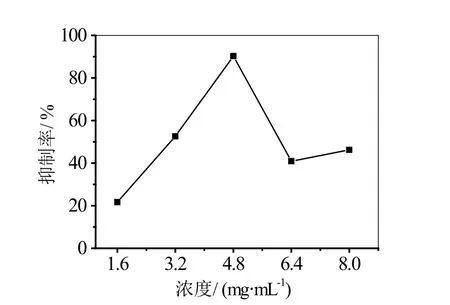
图5 不同浓度地锦草提取物对α-淀粉酶的抑制率
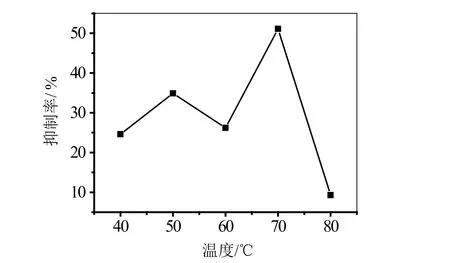
图6 不同温度的地锦草提取物对α-淀粉酶的抑制率
2.4.2 地锦草提取物的温度对α-淀粉酶活性的影响
通过单因素实验来探究不同温度下的地锦草提取物对α-淀粉酶活性的影响,其结果如图6所示。
由图6可知,随着温度的升高,地锦草提取物对α-淀粉酶活性抑制率基本上处于先上升后下降的趋势。在70℃时,地锦草提取物对α-淀粉酶活性抑制率最高,达到了50%左右。
2.4.3 地锦草提取物的pH值对α-淀粉酶活性的影响
为了探究不同pH值的地锦草提取物对α-淀粉酶活性的影响,通过控制单一变量,采用不同pH值的地锦草提取物实验,得到如表3的实验数据。由表3可知,随着pH的增加,抑制率先增加,当达到一定数值后,随着pH的增大呈现下降的趋势。而在pH 6.8时抑制率最大,这符合人体内的正常pH耐受值。

表3 不同pH的地锦草提取物对α-淀粉酶的抑制率
3 结论
通过单因素实验得出地锦草总黄酮的最佳提取工艺为:提取温度为90℃,乙醇体积分数为85%,料液比为1∶15,提取次数为3次。
地锦草提取物对羟基自由基具有一定的清除能力,且在浓度为8 mg/mL是清除率达到最大,为82.04%。地锦草提取物对青霉和曲霉具有一定的抗菌能力,抗菌效果比较显著,抑菌圈达到19.52 mm、18.29 mm,而对大肠杆菌和枯草芽孢杆菌没有明显的抗菌效果。
地锦草提取物对α-淀粉酶具有一定的抑制作用,最佳抑制条件为:浓度为4.8 mg/mL,pH值为6.8,温度为70℃,此时地锦草提取物对α-淀粉酶活性的抑制率达45.13%。

