乳清多肽对抑制反复冻融猪肉糜氧化和改善品质的影响
彭新颜,刘 媛,贺红军,张 敏,邵凌健,曾玉龙,王晓雨
(1.鲁东大学食品工程学院,山东 烟台 264025;2.鲁东大学生物纳米技术研究院,山东 烟台 264025;3.烟台大学生命科学学院,山东 烟台 264005)
冷冻贮藏是国内外调节肉制品市场最普遍且有效的手段[1]。然而在实际贮藏、生产和销售过程中,由于冷链的缺失,使得冷藏肉不可避免的反复经历冷冻-解冻(反复冻融)过程[2-3]。反复冻融循环会导致脂质和蛋白质氧化,引发肉产品中蛋白质、脂肪、肌纤维发生一系列生理生化反应,如丙二醛和羰基衍生物含量增加,巯基含量减小,肌球蛋白和肌动蛋白发生轻微变性[1],从而引起肉制品汁液流失、功能品质下降和营养物质损失等问题,由此造成的肉品质劣变已成为肉品学科广泛关注的焦点[1,3-4]。据统计,我国冷冻肉制品汁液流失率高达8%~10%,每年造成肉品行业经济损失已超过450亿 元[4]。特别是近几年需求量逐渐增大的肉丸、肉饼、肉排、肉肠等调理肉制品所需的肉糜原料,由于反复冻融给企业造成的损失已受到业界的高度重视。因此,如何防止贮藏过程中肉制品的氧化和改善产品品质已经成为肉制品行业中亟待解决的重要问题[5-6]。
近年来,随着人们对合成抗氧化剂潜在危害的关注,利用不同蛋白资源开发天然抗氧化多肽已成为近年来的广泛关注焦点[7]。研究发现,蛋白质水解物可以与肉体系中蛋白发生共价或非共价结合,起到防止肉蛋白氧化的作用[8-10]。如Wang等[8]证实,土豆水解多肽能降低猪肉硫代巴比妥酸值(thiobarbituricacid reactive substances,TBARS)和蛋白的羰基含量,对猪肉脂肪和蛋白的氧化具有明显的抑制作用[9];Li Yanqing等[10]研究表明,在冻藏过程中添加乳清多肽(whey protein hydrolysates,WPH)可以有效抑制鱼糜肌原纤维蛋白氧化的发生。研究者将玉米蛋白、猪皮胶原蛋白、豌豆蛋白和麦胚蛋白的水解物添加到贮藏的肉糜中发现,添加多肽的处理组能显著降低样品的TBARS值、过氧化物值、高铁肌红蛋白含量及增加肉糜的红度值(a*)[11]。猪肉糜中添加大豆多肽后,所形成的凝胶紧密均匀、网络结构好,对蛋白凝胶质构也具有保护作用[12]。课题组前期研究发现,将WPH添加到猪肉糜中,能够抑制冷藏猪肉糜羰基含量升高以及巯基的降低速率,改善冷藏时猪肉肌原纤维蛋白结构的劣变,保护肉蛋白的凝胶质构[13]。本研究拟在前期工作基础上,以猪肉糜为研究对象,继续研究WPH对反复冻融肉糜的保护作用,主要以解冻损失、肉蛋白质构、羰基含量、流变学特性等为指标,探讨WPH对反复冻融肉糜品质变化的影响,以期为调理肉的冷冻加工提供理论依据。
1 材料与方法
1.1 材料与试剂
猪肉(屠宰后5 h以内的新鲜脊背肉)购于山东烟台大润发超市;乳清蛋白(蛋白含量约为95%)MilkyWay商业公司;碱性蛋白酶(6h104U/g)丹麦Novo公司;丁基羟基茴香醚(butyl hydroxyanisole,BHA) 美国Sigma公司;其余试剂为分析纯。
1.2 仪器与设备
Avanti J-E离心机 美国Beckman Coulter公司;Ultra Turrax T-25 Basic高速匀浆机 德国IKA公司;TA.XT plus质构仪 英国Stable Micro Systems公司;M2e多功能酶标仪 美国MD公司;MCR 301流变仪 奥地利Anton Paar有限公司;Evolution激光显微共聚拉曼光谱仪法国HORIBA公司;绞肉机 山东嘉信食品机械公司;AL-104精密电子天平 梅特勒-托利多有限公司。
1.3 方法
1.3.1 WPH的制备
参考Peng Xinyan等[13]的方法并稍作改动,将乳清蛋白配制成5%的溶液,经95 ℃预热5 min,降温到65 ℃后加入碱性蛋白酶(质量分数2%),通过不断加入1 mol/L的NaOH溶液,使pH值保持在8.5,水解5 h后沸水浴5 min灭酶,将得到的乳清水解物经1 ku的超滤膜分离,收集透过1 ku膜的WPH部分,冻干后用于后续实验。
1.3.2 猪肉糜肉饼的制备
猪肉糜的制备在4 ℃冷库中进行,取宰后脊背肉3 000 g,去除表面筋膜和多余的脂肪,切成小肉块后绞碎。实验分为6 组,每份食盐质量分数1.5%,第1组为空白组,第2组添加10%未水解乳清蛋白(native whey protein,NWP),3、4、5组分别加入5%、10%、15%的WPH,最后一组添加0.02%的BHA作阳性对照。制成肉饼(约6.5 cmh1.5 cm),2 个放入一个CT盒中,保鲜膜封好,置于-18 ℃冷冻8~12 h,然后在恒温条件下((21f0.5)℃)将猪肉糜饼自然解冻至中心温度为0 ℃。解冻完成后重新放回-18 ℃冰箱中冷冻贮存,每5 d记作一个循环,分别做0、1、3、5、7、9 次冻融循环处理后测定指标。
1.3.3 猪肉糜肌原纤维蛋白的提取与测定
参考刘旺等[14]方法并适当的修改,整个过程在4 ℃冷库完成。将搅碎肉糜加入5 倍体积的提取缓冲液(20 mmol/L的KH2PO4/K2HPO4、1 mmol/L EGTA、0.1 mol/L KCl、2 mmol/L MgCl2,pH 7.0)冰浴匀浆30 s,4 ℃、2 500hg离心10 min,用4 层纱布进行过滤。弃去上清液,重复4 次,其中第2次提取液加入质量分数0.5% Triton X-100。最后将提取的肌原纤维蛋白膏体保存于冰盒中待测,蛋白的质量浓度用双缩脲法进行测定。
1.3.4 肌原纤维蛋白凝胶的制备
将提取的肌原纤维蛋白用磷酸盐缓冲液配制成40 mg/mL的肌原纤维蛋白溶液,然后量取20 mL于100 mL离心管中,在20 ℃的上升水浴锅中加热至70 ℃后进行保温20 min,结束后迅速用冰块冷却,最后保存在4 ℃冷库中平衡过夜后待测。
1.3.5 解冻损失的测定
参考Filgueras等[15]的方法略作修改,将肉糜制成75 g的肉糜饼,置于-18 ℃冷冻8~12 h,将冷冻好的肉糜饼取出后立即准确称其质量,随后在恒温条件下((21f0.5)℃)解冻,让猪肉糜饼自然解冻至中心温度为0 ℃,解冻过程3.5 h左右。解冻完成后,用滤纸将猪肉糜饼表面渗出的水分擦净,准确称量猪肉糜饼的质量。解冻损失率按式(1)计算:
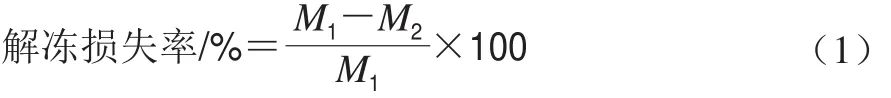
式中:M1为解冻前的质量;M2为解冻后的质量。
1.3.6 挥发性盐基氮(total volatile base nitrogen,TVB-N)值的测定
TVB-N值是评价肉类鲜度的最常用指标,检测方法按照GB/T 5009.44ü2003《肉与肉制品卫生标准的分析方法》进行。
1.3.7 TBARS值的测定
参照Kim等[16]的方法,并适当修改。取20 g捣碎猪肉糜放入试管中,加50 mL 25%的三氯乙酸溶液和40 mL蒸馏水,高速均质后进行离心处理,取4 mL上清液加入4 mL的TBA溶液,待沸水浴中反应20 min结束后进行冷却,测定吸光度。以1,1,3,3-四乙氧基丙烷作标准曲线,TBARS值按式(2)计算:

式中:A为吸光度;V为猪肉糜体积/mL;M为丙二醛摩尔质量(72.063 g/mol);ε为摩尔吸光系数;L为光程,1 cm;m为猪肉糜质量/g。
1.3.8 羰基的测定
羰基含量的测定采用2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)比色法,根据Sher等[17]的方法并作适当的修改。将0.5 mL质量浓度为40 mg/mL的蛋白溶液放于2 个离心管中,其中1 管加入DNPH溶液,另1 管加入HCl溶液作为空白组,期间每隔10 min旋涡振荡1 次,然后加入10%三氯乙酸停止反应,离心后倒掉上清液,用滤纸吸干外壁并用丙酮和盐酸(100∶3,V/V)洗涤沉淀3 次,加入2 mL浓度为6 mol/L的盐酸胍溶液,37 ℃溶解沉淀20 min,10 000hg离心5 min,最后去除不溶性部分,在370 nm波长处测定吸光度。重复3 次后,羰基含量按式(3)计算:

式中:ρ为蛋白质量浓度/(mg/mL)。
1.3.9 动态流变的测定
参照刘旺等[14]的方法并加以修改。采用P/50型号的探头,狭缝距离为1 mm,将猪肉糜均匀涂抹在50 mm平行板上并确保无气泡。升温区间设定为20~80 ℃,加热速率2 ℃/min,测试频率为1 Hz,应变力为1%。为防止升温过程中水分的蒸发,用石蜡封住平行板与空气接触的外沿。每样品平行测定3 次。
1.3.10 质构的测定
肉糜凝胶制备:取适量猪肉糜放在10 mL小烧杯压实,封口膜密封后置于水浴锅中,以2 ℃/min从20 ℃升温到80 ℃,并在80 ℃保持25 min。形成凝胶后取出冷却,于4 ℃冷藏库中过夜后测定指标。应用TPA模式对猪肉糜样品制成的凝胶进行质构测试,主要对硬度、弹性、内聚性、咀嚼性进行研究。具体参数按照Qi Jun等[18]的方法稍作修改。采用P50探头,测试前速率2.0 mm/s,测试速率2.0 mm/s,测试后速率10.0 mm/s,压缩程度50%,两次测试时间间隔为3 s,数据采集速率为200 pps,触发值为5.0 g,测定距离为25 mm,每组样品测试平行3 次。
1.3.11 拉曼光谱的测定
参考Shao Junhua等[19]的方法对猪肉糜中肌原纤维蛋白进行拉曼光谱测定。光谱测量采用LabRAM HR Evol激光显微镜共聚拉曼分析仪(配532 nm氩离子激光光源)进行,测试所使用的功率约为100 mW,用50 倍长焦距镜头对样品进行激光聚焦。光谱获取条件为:开孔200 μm,光栅600 g/mm,累积扫描3 次,测定时间为60 s,分辨率为2 cm-1,数据获取速率为1 2 0/(c m gm i n)。获取的拉曼光谱范围在400~2 100 cm-1之间。测试完成后用Labspec软件对拉曼光谱数据进行处理(平滑,多点基线校正去除荧光背景),每个样品重复测定3 次。
1.4 数据统计分析
每个实验重复3 次,结果表示为fs。利用Statistix 9.1软件中的Linear Models程序进行处理,进行差异显著性分析(P<0.05,差异显著),使用Sigmaplot 12.0软件作图。
2 结果与分析
2.1 WPH对反复冻融肉糜解冻损失的影响

图1 WPH对不同冻融循环猪肉糜解冻损失的影响Fig. 1 Effect of wWPH on thawing loss during repeated freezingthawing of chopped pork
如图1所示,猪肉解冻损失率随冻融循环次数的增加而显著升高。在1 次冻融循环时,各组猪肉糜的解冻损失率维持在2.67%~2.93%之间,无显著性差异(P>0.05)。当冻融循环在3~9 次时,解冻损失率持续增加,冻融9 次后解冻损失率高达7.00%~12.4%。WPH各处理组解冻损失率显著低于空白组(P<0.05),其中15% WPH组解冻损失最小。NWP组在第7次冻融循环时显著优于空白组(P<0.05),达到WPH低、中剂量组的水平。BHA组在第5次冻融循环时,显著优于空白组(P<0.05),说明WPH具有更好保水能力。
2.2 WPH对反复冻融肉糜TVB-N值的影响
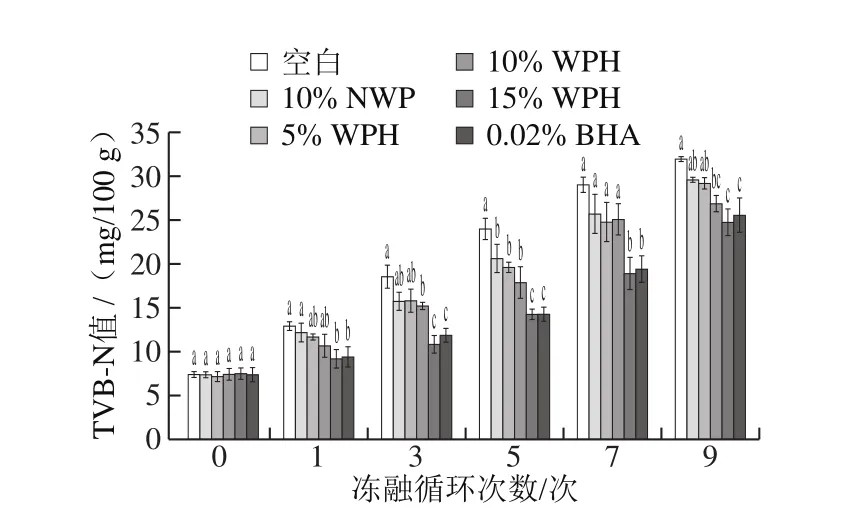
图2 WPH对不同冻融循环的猪肉糜TVB-N值的影响Fig. 2 Effect of WPH on TVB-N value during repeated freezingthawing of chopped pork
由图2可知,各组TVB-N值随着冻融次数不断增加呈现明显的上升趋势。冻融0 次时猪肉糜TVB-N值最低,在7.33~7.66 mg/100 g之间上下浮动,且各处理组之间并无显著差异(P>0.05);当冻融循环达到9 次,猪肉糜TVB-N值显著升高到24.79~31.95 mg/100 g,说明冻融使猪肉糜产生了严重的腐败变质。冻融循环3 次后,10% NWP组和5%、10% WPH组无显著性差异(P>0.05),但与WPH高剂量组及BHA组差异显著(P<0.05),说明高剂量WPH有效抑制了因蛋白质腐败分解而造成的挥发性盐基氮的形成。
2.3 WPH对反复冻融肉糜TBARS值的影响

图3 WPH对不同冻融循环猪肉糜TBARS值的影响Fig. 3 Effect of WPH on TBARS value during repeated freezingthawing of chopped pork
如图3所示,TBARS值随冻融次数的增加而呈现明显的上升趋势,从冻融0 次时的0.047~0.048 mg/kg显著升高至0.133~0.183 mg/kg,说明猪肉糜的脂肪氧化程度显著增加。在冻融0 次时,各处理组的TBARS值无显著差异(P>0.05)。在冻融1~9 次期间,10% NWP处理组、5%和10% WPH组差异不显著(P>0.05)。在冻融1、3、5、7 次时,15% WPH处理组TBARS值最低,与0.02% BHA阳性空白组差异不显著(P>0.05)。尤其当冻融3 次时,15% WPH组抗氧化效果明显超过0.02%BHA组。说明添加WPH能够抑制TBARS值的上升。
2.4 WPH对反复冻融肉糜肌原纤维蛋白羰基的影响

图4 WPH对不同冻融循环猪肉糜羰基含量的影响Fig. 4 Effect of WPH on protein carbonyl content during repeated freezing-thawing of chopped pork
图4 反映了WPH对不同冻融循环处理后的肌原纤维蛋白羰基含量的变化。未冻融前,各组分含量与空白组分无显著性差异(P>0.05);随冻融次数的增加,猪肉糜肌原纤维蛋白氧化时间增加,羰基含量也呈现显著的上升趋势(P<0.05)。如9 次冻融循环后,空白组的羰基含量从0 次冻融的0.76 nmol/mg增加到6.98 nmol/mg。3 次冻融处理后,10% NWP组、5%和10% WPH组之间无显著差异(P>0.05),而15% WPH高剂量组以及0.02%BHA组的蛋白羰基含量显著优于未水解组和5% WPH低剂量组。从冻融1 次循环开始,15% WPH组羰基含量与0.02% BHA组无显著差异(P>0.05),对肌原纤维蛋白羰基含量的抑制效果最好。
2.5 WPH对反复冻融肉糜流变性的影响

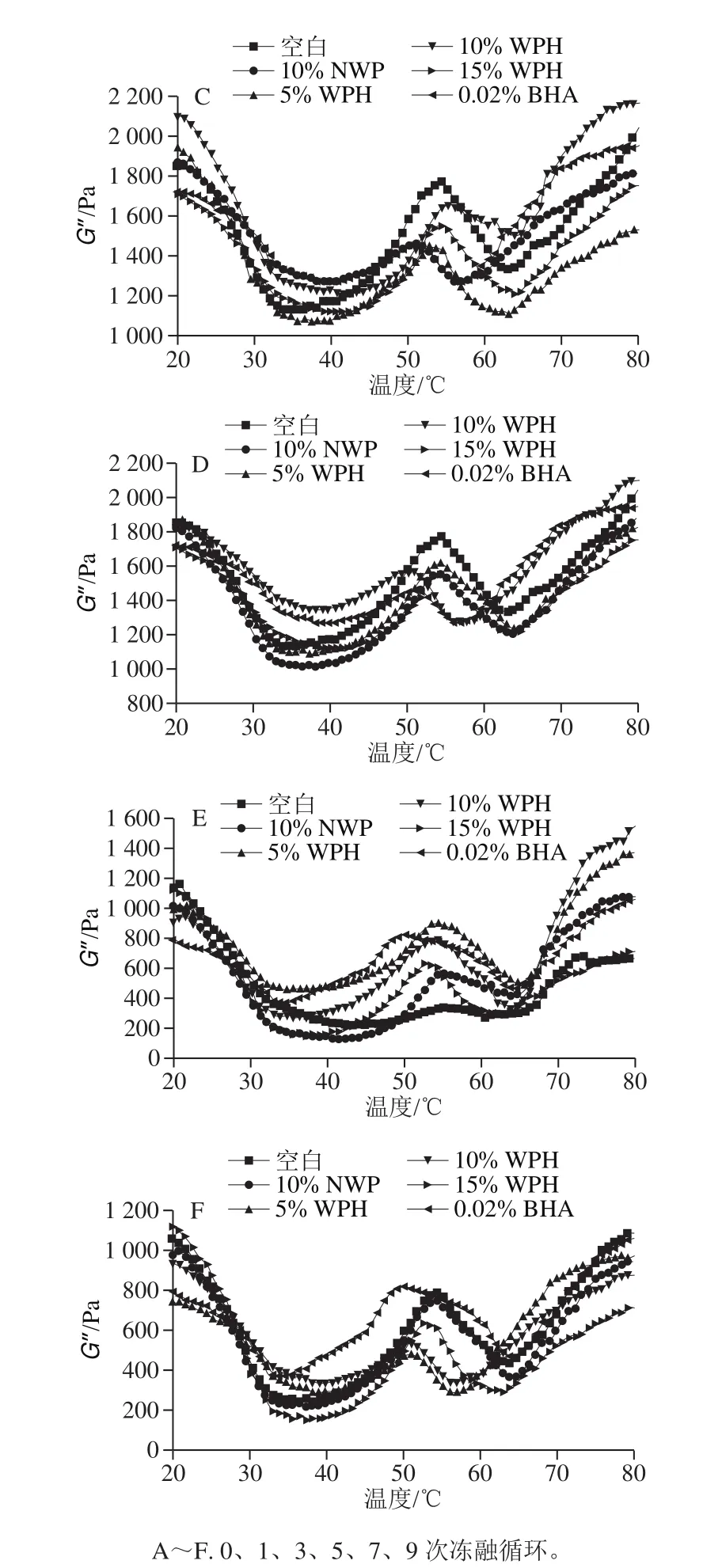
图5 WPH对不同冻融循环猪肉糜模量损耗G’’的影响Fig. 5 Effect of WPH on G’’ during repeated freezing-thawing of chopped pork
如图5A所示,在低温时,各处理组的模量损耗G’’相似,差别不明显。G’’值随着冻融循环的增加开始出现差异,温度越高差异越显著。在整个升温区间,都有G’’相对最大值出现。由图5可知,猪肉糜G’’值随着冻融循环的增加而呈现明显降低趋势。在同一冻融次数下,15% WPH组与0.02% BHA组G’’值最低,空白组G’’值最高,差异明显。由图5E、F可知,冻融7、9 次时,15% WPH组的G’值比空白组分别降低了37.83%和23.17%。
2.6 WPH对反复冻融肉糜质构的影响
表1反映了不同冻融循环处理后猪肉糜硬度、弹性、咀嚼性和内聚性等质构指标的变化。未冻融时,各组分之间的4 种质构指标均无显著变化(P>0.05)。经过冻融处理后,空白组与处理组之间存在显著性差异(P<0.05)且冻融次数越多,差异越明显。其中硬度从未冻融时的186.06~187.73 g降低至151.90~163.07 g,变化最明显。在冻融7、9 次时,WPH组和0.02% BHA组的弹性和内聚性显著高于未处理组(P<0.05)。冻融循环过程中,15% WPH组的硬度和咀嚼性最好,超过0.02%BHA阳性空白组。尤其在冻融9 次时,加入15% WPH后,猪肉糜咀嚼性从9.63 g显著升高到17 g(P<0.05)。10% WPH组的咀嚼性与0.02% BHA相似(P<0.05),且显著优于10% NWP组和空白组(P>0.05)。冻融3 次时,15% WPH组的内聚性与0.02% BHA组无显著差异(P>0.05)。在冻融5 次时,15% WPH组的弹性最高达到0.69,超过0.02% BHA阳性空白组,与其他组差异显著(P<0.05)。

表1 WPH对不同冻融循环猪肉糜质构特性的影响Table 1 Effect of WPH on texture properties during repeated freezing-thawing of chopped pork
2.7 WPH对反复冻融肉糜肌原纤维蛋白拉曼光谱的影响
15% WPH对不同冻融循环处理后的猪肉糜肌原纤维蛋白二级结构的影响如图6所示。通过分析400~2 100 cm-1范围的拉曼光谱,可以看出不同冻融次数处理后,1 650 cm-1附近的酰胺I带和1 250 cm-1附近的酰胺III带出现明显变化。未经冻融的蛋白质α-螺旋含量最高,与其他循环组差异不显著(P>0.05)。随着冻融次数的增加,15% WPH可以延缓冻融期间蛋白质酰胺I带的位移,降低蛋白氧化聚合程度,对蛋白质二级结构有一定的保护作用。

图6 高剂量组(15% WPH)对不同冻融循环猪肉糜肌原纤维蛋白拉曼光谱的影响Fig. 6 Effect of 15% WPH on Raman spectrum of myofibrillar protein during repeated freezing-thawing of chopped pork
3 讨 论
肉及肉制品反复冻融后的变化存在多样性和复杂性,冰晶的形成、融化及重结晶的过程不仅会破坏细胞膜和细胞器,还会引发一系列的生化链锁反应[6,20]。损伤的肌细胞会释放出促氧化剂,造成脂肪氧化,产生自由基和氢过氧化物,引发并加速蛋白质的氧化变性[1,21],诱发产品品质劣变。解冻损失、TVB-N值、TBARS值和羰基含量是衡量冷冻肉持水性、新鲜度、氧化程度的重要指标[22]。本实验中,这4 种指标均随冻融循环次数的增加而上升,这可能是由于冰晶胁迫的氧化会导致蛋白网状结构从致密变得松散,天然构象降解或聚集后,使埋藏于内部的疏水基团暴露,造成肉体系持水能力下降[23-24]。Cheng Weiwei等[1]证实,蛋白质氧化会造成水分迁移流失,使得肉制品的多汁性和质构变差。Liu Qian[25]和Ayla[26]等研究发现,贮藏时间的延长会使肌原纤维蛋白羰基含量增加,凝胶组织硬度、弹性、持水力均有所下降。其中添加WPH的猪肉糜解冻损失明显降低而凝胶质地明显改善,这可能是WPH的添加使得肉糜中水分迁移发生变化,肽与水、蛋白质、脂肪等的结合方式、结合力及自身结构等同时也发生了变化。此外,WPH的加入,对肉糜凝胶致密的三维网状结构具有一定的保护作用,减缓了由反复冻融导致凝胶网络的疏松甚至崩塌,保护了交联基团如二硫键等的作用力。从而保存了更多的肉糜汁液改善了凝胶理化品质。冻融循环中冰晶的反复形成会造成肌细胞破裂,促进脂肪氧化,使制品TBARS值升高。同时蛋白氨基酸侧链被肌肉中产生的自由基攻击,使羰基化合物及其衍生物含量增加[1-3]。Jeong[27]和Cheng Weiwei[1]等研究表明,冻融循环会加速肉品色泽恶化和TBARS值的升高。Zhang Bin等[28]认为,冷冻贮藏增加了肌原纤维蛋白对冷冻氧化的敏感性,使得虾中的羰基含量显著增加。同时,蛋白质分解产生挥发性氨、二甲胺和三甲胺的速度加快,促进了蛋白质氧化降解和脂质氧化、甚至腐败的发生。TVB-N是评估肉品腐败变质程度的重要指标,TVB-N值越高,肉品腐败程度越高[20]。Shao Ying等[20]报道,反复冻融增加了大口鲈鱼TVB-N值,肉质有腐败的趋势。本实验结果还表明,添加WPH,尤其是15%高剂量WPH,可以在肉糜冻融循环中显著抑制TBARS值、羰基含量和TVB-N值的升高(P<0.05),其中多肽组效果明显优于NWP组,这可能是由于蛋白水解后,更多的抗氧化活性基团能够暴露出来,使抗氧化能力增强。因此大量好氧性微生物的生命活动受到抑制,微生物的分解能力下降,使产品保持更高的新鲜度。Karolina等[29]研究发现,在香肠制品中添加5%酸乳清,不仅可以提高产品营养价值,还能显著提高香肠的风味。Martina等[30]研究表明,乳清蛋白及其水解物可以明显抑制脂肪过氧化,有效清除自由基,具有很强的金属离子螯合能力。Mulcahy[31]和Li Dongmei[23]等研究也证实,WPH具有改变食品理化性质、提高营养和肉品功能特性的作用,已被广泛用于肉制品加工过程中,在抑制氧化、保证产品质量方面发挥着重要的作用。
越来越多的研究证实,流变性能、凝胶质构以及拉曼光谱是表征猪肉糜功能特性和蛋白理化性质变化的重要指标,对肉制品的加工具有重要的现实意义。本研究发现,反复冻融循环后,猪肉糜的硬度、咀嚼性、弹性和内聚性都随冻融循环次数的增加呈现明显的劣变趋势。这可能是猪肉糜经反复冻融后已发生明显酸败,细胞间结合力减弱,组织结构受到破坏[21],导致咀嚼性和硬度等性质劣变;而且肌肉组织冻结会使肌原纤维蛋白变性,局部断裂,肌原纤维蛋白盐溶性随之降低[32],弹性和内聚性也被破坏。Ali等[33]研究表明,肉品质与蛋白质氧化程度密切相关,多次冻融循环增加了鸡胸肉脂质和蛋白质氧化,氧化越严重,肉产品的凝胶质构会越差[34],与本实验结果一致。在猪肉糜的热动态流变性测定中,不同冻融循环时猪肉糜凝胶G’’整体趋势大致相同,40~60 ℃之间形成一个最明显的G’’最大峰值,这是因为温度升高使得蛋白质分子活跃,分子之间开始聚集,形成三维凝胶网络结构,因此造成了很大模量损耗[35]。冻融后期猪肉糜G’’值整体趋势逐渐紊乱无序,各组差异显著,这可能是由于多次冻融循环使猪肉糜结构过度展开,蛋白聚集沉淀,活性功能基团被屏蔽,或是蛋白结构过度展开,导致蛋白变性[36]。5 次冻融循环后,添加WPH组,虽然能够抑制肌原纤维蛋白氧化变性(图4),但猪肉糜的黏性却下降明显。可见,WPH对反复冻融猪肉糜蛋白氧化抑制作用与黏性品质没有明显相关性。酰胺I带(1 655f5)cm-1处振动与蛋白质二级结构密切相关,利用拉曼光谱可以有效反映肌原纤维蛋白的二级结构[20]。包括主要集中在(1 655f5)cm-1处的高α-螺旋含量的酰胺I带振动、1 665~1 680 cm-1处的高β-折叠含量的酰胺I带振动,此外还有1 680 cm-1附近的β-转角和1 660~1 665 cm-1处的无规卷曲[37]。本实验中随着冻融循环次数的增加,蛋白质的α-螺旋出现略微的降低趋势,β-折叠、β-转角及无规卷曲的含量均呈现不同程度的增加趋势,说明冻融引起蛋白质氧化严重,使C=O的电子云密度增加,氢键之间作用力减弱[38]。Cao Yungang等[39]也发现,由于肌原纤维蛋白在贮存期间发生氧化变性,导致蛋白α-螺旋结构破坏、疏水结构域暴露,肌原纤维蛋白的网络骨架也随之改变。本研究发现,WPH的添加在一定程度上改善了猪肉糜凝胶的质构品质、抑制模量损耗的升高、增强猪肉的流变性能、提高蛋白质α-螺旋的含量,在加温区间使流变损耗降到最低。这一方面可能是WPH通过具有良好的抗氧化作用,保护了猪肉肌原纤维蛋白在反复冻融过程中的二级结构,对肌原纤维蛋白的降解起到一定的抑制作用,使其黏弹性和流变特性有所改善。另一方面,WPH加入后,与猪肉肌原纤维蛋白相互作用形成精细的网状结构,束缚住水分,改善了品质。
4 结 论
WPH能够通过抗氧化作用,在一定程度上抑制氧化链式反应,从而减缓蛋白氧化变性,抑制肉糜氧化速度。同时WPH与肉蛋白发生交互作用,形成保护层,维持肉体系均匀致密的网络结构,“锁住”水分,提高肌肉细胞间的结合力,保护蛋白质的功能结构。添加15%WPH处理组的效果最佳,接近甚至优于BHA处理组水平。可见WPH在肉体系具有较好的抗氧化效果,在改善肉制品品质方面有较好的应用前景。

