利用低场核磁共振及成像技术鉴别注水肉糜
盖圣美,游佳伟,张雪娇,张中会,刘登勇,2,
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
猪肉糜作为饺子、包子、香肠等传统食品的原材料,在我国具有广阔的市场,产量极大,其品质好坏与对应产品的质量密切相关[1]。目前,由于国内市场上存在肉糜及其制品生产标准不够完善,相关监管部门的管理力度欠缺等问题,导致一些不法生产者在实际生产中为牟取利益,用劣质原料取代优质原料,严重者直接往肉糜中注水、注胶等掺假现象,这种欺诈行为不仅损害了消费者的利益,而且对消费者的健康造成极大的安全隐患[2-4]。因此,建立准确、灵敏、快速的肉类掺假鉴别方法,对保障肉类安全、维护消费者权益都具有重要的现实意义。
近年来,一些新兴的方法逐渐被应用于掺假肉类的检测中,如微波法[5]、生物电阻抗技术[6]、激光诱导击穿光谱技术[7]、近红外光谱成像技术[8-9]、多光谱成像技术[10-11]、高光谱成像技术[12-14]等,但这些方法存在检测设备造价昂贵、对操作人员技术要求较高等弊端。与这些检测方法相比,低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)技术不仅具有检测速度快、对样品无损伤、无需预处理、实时获得数据等特点,同时还能够反映样品中水分子的存在形式及分布状态[15-16]。
LF-NMR是利用氢原子在磁场内受到一定频率的射频脉冲激发后,产生磁共振现象的物理学原理,虽然常温下1H核在静磁场中进行了塞曼能级分裂,但低能级和高能级上的核数之差非常小,所以需要一定的射频脉冲激发使其发生能级跃迁,以获得样品内部质子密度与分布,进而分析得到样品中水分分布状态[17-18]。目前,该技术在掺假食品的检测方面得以广泛应用。可对掺假牛奶进行定性、定量检测,LF-NMR结果发现,牛奶样品中的水分子仅有一种结合状态,且不同掺假比例的样品中弛豫时间存在明显差异;通过偏最小二乘回归(partial least squares regression,PLSR)模型可以对掺假比例进行很好预测(均方根误差(root mean square error,RMSE)为2.35%)[19]。Zhu Wenran等[20]利用LF-NMR技术结合化学计量学方法对掺假比例为10%~90%的花生油进行检测,结果发现随着掺假比例的增加,单组分弛豫时间(Tw)、多组分峰面积比(S21、S22)呈现线性变化;通过主成分回归(principal component regression,PCR)法能明显将正常花生油和掺假花生油区分。Li Min等[21]利用LF-NMR和MRI技术结合PCR对注胶虾进行检测分析发现,通过T2弛豫特性可以将注胶虾从正常虾中检出,此外通过MRI技术能清楚观测到所注射的胶体在虾中的分布情况。虽然LF-NMR技术在肉类掺假检测方面得以广泛应用,但多局限于对样品的定性分析,在定量检测方面还相对较少[22-26]。
本实验主要利用LF-NMR技术分析注水肉糜中水分分布的变化,并结合PCR法对注水肉糜进行有效区分;通过建立回归预测模型对注水肉糜掺假比例进行预测;还利用MRI技术观察注水肉糜中水分的空间分布情况,以期可直观地对注水肉糜进行区分。
1 材料与方法
1.1 材料与试剂
猪肉背最长肌购自天添食品有限公司,冷藏条件下带回实验室进行实验。
1.2 仪器与设备
PQ001型低场核磁共振分析仪 上海纽迈电子科技有限公司;PL203型电子天平 英国梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 样品制备
随机选择10 条新鲜的猪背最长肌,去除表面的脂肪及结缔组织后,用绞肉机打碎成糜状。原料肉不添加任何物质,即为正常肉。肉糜总共分为135 份,每份100 g。取其中的90 份肉糜,分为6 组,以4%的梯度向肉糜中注入去离子水并充分混匀,配制注水量为0%、4%、8%、12%、16%、20%的模拟注水肉糜,建立预测模型。取剩余45 份肉糜,分为3 组,配制成5%、10%、15%的模拟注水肉糜,用来评估预测模型。
1.3.2 注水肉糜水分子弛豫信息采集
取2 g左右的肉糜样品于核磁管中,把装有样品的核磁管加塞后放入低场核磁设备磁体腔中采集T2弛豫信息。LF-NMR测试参数为:质子共振频率22 MHz;重复采样等待时间3.5 s;半回波时间150 μs;回波个数5000;重复扫描次数16。
1.3.3 核磁共振成像
不同比例注水肉糜的核磁成像实验,成像方式为冠状面成像,脉冲序列为自旋回归脉冲序列,具体参数为:中心频率22 MHz,信号采样点数400,采样频率20 kHz,重复采样等待时间1 000 ms,回波时间6 ms,采样层数1,采样厚度2 mm,重复采样次数8。
1.4 数据处理与分析
所有的肉糜样品分为校准集、验证集两组,注水比例为0%、4%、8%、12%、16%、20%的样品作为校准集,建立预测模型。注水比例5%、10%、15%的样品作为验证集,用来评价预测模型的准确性。以校准集肉糜样品的5 000 个回波峰点作为自变量x,水分含量作为因变量y,用Unscrambler 9.7数据分析软件(version 9.7,CAMO software AS,Oslo,Norway)对自变量x和因变量y进行PLSR、PCR拟合,得到PLSR、PCR预测模型[27]。把验证集样品的5 000 个回波峰点代入PLSR、PCR预测模型,得到验证集中肉糜注水比例的预测值。预测模型的评价分别从决定系数R2和RMSE两个方面考虑。R2和RMSE分别根据式(1)、(2)计算[28]:

式中:R2为决定系数;n为肉糜样本数;yi为肉糜样品真实水分含量;为yi的平均值;为肉糜样品预测水分含量。

式中:RMSE为均方根误差;yi为肉糜样品真实水分含量;为预测水分含量;n为样本数。
PCR是在保留原始变量主要信息的前提下,把多个指标转化为少数几个综合指标的一种多元数据统计方法[29]。通过将多变量的信息进行数据转换和降维,使数据可视化。利用降维后的特征向量形成散点图,直观地反映样品之间的差异。
用系统自带反演软件对CPMG衰减曲线进行单组分反演得到注水肉糜的单组分弛豫时间,通过多组分反演得到注水肉糜中结合水、不易流动水、自由水的弛豫时间、峰面积、峰面积比;用SPSS 19.0数据分析软件对数据进行差异显著性分析、PCR;通过Unscrambler 9.7数据分析软件建立和验证PLSR、PCR模型;用Origin 8.5绘制相关图形;用系统自带成像软件获取注水肉糜的MRI图像,随后通过Matlab2016a数据分析软件对所得MRI图像进行伪彩处理。
2 结果与分析
2.1 不同注水肉糜的CPMG衰减曲线
由图1可以看出,正常肉糜、注水肉糜由于样品内部水分子数量及可移动性的差异使CPMG曲线表现出不同的衰减特征[30]:正常肉糜由于水分含量少、水分子流动性相对较弱,CPMG衰减曲线的信号强度较弱且呈衰减速率快(曲线曲率大)的特点;肉糜注水后其水分含量增加(质子数随之增加)、水分子流动性增强,CPMG衰减曲线的信号强度较强且呈衰减速率慢(曲线曲率小)的特点。正常肉糜、注水肉糜CPMG衰减曲线的差异主要集中在0~600 ms范围内,说明这是区分正常肉糜、注水肉糜的重要信号区域。在该区域内,随着注水比例的增加,衰减曲线的曲率随着注水比例的增加逐渐减小,信号完全衰减的时间也随之延长,水分子的流动性增强。

图1 不同注水比例肉糜的CPMG衰减曲线Fig. 1 CPMG attenuation curves of ground meat samples with different proportions of injected water
2.2 注水对肉糜单组分弛豫时间的影响

图2 注水比例对肉糜单组分弛豫时间的影响Fig. 2 Effect of different proportions of injected water on singlecomponent relaxation time in ground meat samples
由图2可以看出,随着注水比例的增加,肉糜的组分弛豫时间Tw呈线性增加的趋势(R2=0.953 5)。Tw增加主要是由于去离子水的掺入,使得肉糜中的水分含量增加、水分子流动性逐渐增强,从而导致肉糜整体的弛豫过程变慢,弛豫时间延长。
2.3 注水比例对肉糜多组分弛豫特性的影响
由图3可以看出,正常肉糜、注水肉糜多组分弛豫图谱上均存在4 个明显的水分群,T2弛豫时间分别在0.1~1、1~10、10~100、100~1 000 ms范围内,分别对应肉糜中的紧密结合水(T2b)、结合水(T21)、不易流动水(T22)、自由水(T23)[31-32],与注胶虾[21]、循环冻融海参[32]中的水分分布一致。

图3 不同注水比例肉糜的多组分拟合横向弛豫图谱Fig. 3 Distribution of multi-exponentially fitted transverse relaxation time spectra of ground meat samples with different proportions of injected water

图4 不同注水比例对肉糜弛豫时间(A)和峰面积比(B)的影响Fig. 4 Effect of different proportions of injected water on relaxation time (A) and peak area ratio (B) in ground meat samples
由图4A可以看出,相对于正常肉糜,注水肉糜的T2b值未发生显著变化(P<0.05),而T21、T22、T23均显著增加。这说明紧密结合水的流动性在注水后未发生明显改变,而结合水、不易流动水、自由水在注水后流动性明显增强。P2b、P21、P22、P23分别为T2b、T21、T22、T23所对应峰的积分面积占总积分峰面积的百分比,由图4B可以看出,在所有处理组中,P2b、P21值最小,注水前后均为2%左右,对肉中水分分布的影响可以忽略不计。所有组的P22值均在85%以上,说明不易流动水是肉糜中水分子的主要存在形式[33]。相对于正常肉糜的P22值,各注水组的P22值均有所减小,其中当注水比例大于8%时,P22值减小显著(P<0.05)。P23的变化与P22相反,正常肉糜的P23值为2.21%,注水后肉糜的P23值增加了3.16%~11.84%,其中当注水比例大于8%时,P22值相对于正常肉糜增加显著(P<0.05)。
2.4 PCR结果

图5 不同注水比例肉糜主成分得分图Fig. 5 Principal component score plots of ground meat samples with different proportions of injected water
为了区分正常肉糜和注水肉糜,通过PCR对不同比例注水肉糜的核磁数据进行降维处理,得到PC1、PC2,如图5所示。PC1、PC2的贡献率分别为88.69%、10.41%,而累计贡献率达99.10%。从不同注水比例肉糜在得分图上的分布看,正常肉糜与注水量较少的肉糜(4%、8%)分布在主成分得分图的左侧区域,而注水量较高的肉糜(12%、16%、20%),则分布在得分图右侧区域。且随着注水比例的增加,肉糜PC1的得分逐渐增加,而PC2得分则是先增加后减小。可以说明,注水后的肉糜可以通过PCR的方法从正常猪肉中区分出来。与本实验类似结果有,Li Min等[21]利用LF-NMR及MRI技术研究了注胶虾,结果表明注射不同浓度明胶的对虾在主成分得分图上可以得到很好地区分;Santos等[19]利用LFNMR技术分析了掺假牛奶,结果表明不同掺假比例的牛奶可以在主成分得分图上得到区分;Zhu Wenran等[20]利用LF-NMR技术结合PCR、判别分析的方法研究了花生油掺假,结果表明花生油掺入不同比例的大豆油、菜籽油或棕榈油后都可以从主成分得分图上得到区分。
2.5 利用多元回归模型预测肉糜的注水比例
由图6、7可以看出,PLSR预测模型校准集和PCR模型校准集的都是0.97,决定系数均在0.95以上,且RMSE值均在1.5%以下,说明不同注水比例肉糜的预测模型拟合结果较好。PLSR、PCR验证集结果表明,不同注水比例肉糜的真实值与预测值的决定系数均在0.90以上,RMSE值均不超过1.50%,这说明LF-NMR结合PLSR、PCR模型可以准确地预测注水肉糜中增加的水分。通过进一步比较PLSR、PCR模型发现,PLSR、PCR模型验证集RMSE分别为1.27%、1.25%,相差仅为0.02%,说明PLSR、PCR模型的预测结果基本一致。Zang Xiu等[27]利用LF-NMR技术,通过建立PLSR、PCR预测模型的方法,对小黄鱼中的水分含量和脂肪含量做了预测分析,同样也发现PLSR模型与PCR模型的预测结果基本一致。

图6 注水肉糜PLSR模型建立和验证的散点分布图Fig. 6 Scatter plots of calibration and prediction sets for PLSR model

图7 注水肉糜PCR模型建立和验证的散点分布图Fig. 7 Scatter plots of calibration and prediction sets for PCR model
2.6 注水肉糜质子加权成像
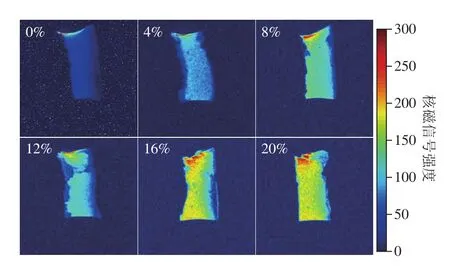
图8 注水肉糜质子加权成像Fig. 8 Proton density-weighted images of water-injected ground meat
通过质子密度加权成像的方法对注水肉糜中的水分分布情况进行可视化处理。由于质子密度加权成像的信号强度取决于样品中的质子数,而水分子又是肉糜中质子的主要来源,因此,样品中的水分含量越高,质子密度图像的信号越强,MRI图像(未做伪彩处理的原始图像)的亮度也越高。通过对MRI原始图像进行伪彩处理,可清晰观测到水分子在肉糜中的分布情况(图8)。图中红色区域表示核磁信号最强、水分含量最高;蓝色区域表示核磁信号最弱、水分含量最低;黄色区域的信号强度/水分含量则介于红色和蓝色区域之间。可以看出,正常肉糜的MRI图像呈蓝色,表明正常肉糜的水分含量较低。注水肉糜中,注水比例为4%~12%时,肉糜的MRI图像呈浅蓝色或青色,表明水分含量相比正常肉糜有所增加;注水比例为16%~20%时,肉糜的MRI图像呈黄色或红色,表明水分含量相比正常肉糜明显增加。此外,对单个成像结果进行观察发现,正常肉糜的MRI图像颜色呈蓝色、颜色较为单一,说明正常肉糜中的水分分布较为均匀,而注水肉糜的MRI图像左右两侧呈蓝色,中心位置呈红色或黄色,说明注射的水分在肉糜各部位的分布有所差异。
3 结 论
本实验利用LF-NMR及MRI技术对注水肉糜做检测分析,对不同注水比例肉糜的CPMG衰减曲线分别进行单组分拟合、多组分拟合处理,结果发现单组分Tw随着注水比例的增加呈线性增加(R2=0.953 5);多组分拟合结果表明,正常肉糜、注水肉糜中均存在4 种水分子,分别对应肉糜中的紧密结合水、结合水、不易流动水和自由水。统计结果表明,不易流动水、自由水弛豫时间相对于正常肉糜均显著增加(P<0.05)。通过PCR法对注水肉糜的核磁数据进行降维处理,得到了两个主成分PC1和PC2,贡献率分别为88.69%、10.41%,在主成分得分图上,正常肉糜、不同比例注水肉糜得到了明显区分。注水比例预测结果表明,PLSR模型与PCR模型的预测结果基本一致RMSE为1.27%;RMSE为1.25%)。MRI结果表明,随着注水比例的增加,肉糜伪彩图由蓝色逐渐向黄色、红色转变,以此可直观地对注水肉糜进行区分。综上所述,利用LF-NMR及MRI技术可作为一种检测注水肉糜的有效方法。

