PRIME HLB固相萃取-超高效液相色谱-串联质谱法测定蜂产品中10 种头孢类药物的残留量
章 豪,吴银良,张宜文,陈 国,江潇潇
(1.宁波市农业科学研究院,农业农村部农产品质量安全风险评估实验室(宁波),浙江 宁波 315040;2.北京市计量检测科学研究院,北京 100012)
头孢类药物属于广谱抗生素,临诊应用的头孢类药物均为半合成物质,杀菌力强,较青霉素类稳定,目前已发展到第5代[1]。然而过量使用头孢类药物会对人体健康带来潜在的危害,对儿童、老人,特别是胎儿的影响更大,严重者会导致胎儿病变、畸形、流产甚至死亡[2-3]。由于细菌产生耐药性和过敏反应等原因,世界各国对部分动物源性产品中头孢类药物残留量均提出了限量要求,如美国食品药品管理局规定牛奶中头孢匹林最高残留限量为20 μg/kg,牛肉未蒸煮可食组织中头孢匹林最高残留限量为100 μg/kg;欧盟规定牛奶中头孢类药物最高残留限量为20~100 μg/kg;目前我国制定的头孢类药物的最高残留限量为:头孢氨苄在牛肌肉、肝、肾、脂肪和奶中的最高限量分别为200、200、1 000、200 μg/kg和100 μg/kg;头孢喹肟在牛猪肌肉、肝、肾、脂肪和牛奶中的最高限量分别为50、100、200、50 μg/kg和20 μg/kg;头孢噻呋在牛猪肌肉、肝、肾、脂肪、牛奶中的限量分别为1 000、2 000、6 000、2 000 μg/kg和100 μg/kg,其中头孢噻呋的残留量以其代谢产物去呋喃甲酰基头孢噻呋检测含量计算[4]。但目前头孢类药物在蜂蜜中暂无限量规定。
目前对包括头孢类药物在内的β-内酰胺类药物残留分析的方法主要有液相色谱-串联质谱法[5-9]、高效液相色谱法[10-15]、毛细管电泳法[16-17]和微生物法[18],且主要集中在肉[19-20]和牛奶[21-23],以及饲料[24-25]和鸡蛋[26]样品。然而,近年来,有关蜂产品中头孢类药物分析方法的研究鲜有报道。GB/T 22942—2008《蜂蜜中头孢唑啉、头孢匹林、头孢氨苄、头孢洛宁和头孢喹肟残留量的测定 液相色谱-串联质谱法》中方法以磷酸盐缓冲溶液为提取液,采用Oasis HLB固相萃取小柱净化,液相色谱-电喷雾串联质谱仪测定。该方法中头孢唑啉的定量限为10 μg/kg,头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟的定量限为2.0 μg/kg。20世纪90年代以后,绝大多数生物有机体中的β-内酰胺类药物残留分析采用液相色谱进行测定。然而使用液相色谱法测定时,未经衍生化测定时,基体干扰较大,而经衍生化测定后灵敏度有所提高,但只能作为一种筛选方法进行使用,且对于分析多种头孢类药物有极大难度。而超高效液相色谱-串联质谱(ultrahigh performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法是一种集多组分定性、定量和高效分离于一体的系统,对于分析蜂产品中头孢类药物,不仅能够显著提高方法的灵敏度和定性的准确度,而且能够降低前处理的成本和工作量[27]。高效液相色谱和UPLC-MS/MS方法,对于复杂基质的前处理方法常采用固相萃取小柱进行净化和富集[5,21,23]。根据头孢类药物的相关报道[28-29],考虑到药物的理化特性,前处理中净化一般选用Oasis HLB固相萃取小柱,且净化过程往往需要活化等费时费力的步骤。近来,Oasis PRiME HLB固相萃取小柱简单快速的通过式净化方案被用于快速有效地去除食品基质中的各种主要干扰物,包括脂肪、磷脂以及色素等[30]。Oasis PRIME HLB固相萃取小柱省去传统的活化、平衡步骤,样品经提取后直接上样,这种样品净化方法简单、快速、有效,适合大批量日常分析检测。但是,目前鲜见相关文献报道采用Oasis PRIME HLB固相萃取小柱用于蜂产品抗生素的样品前处理。
本研究采用Oasis PRIME HLB固相萃取小柱,对仪器条件和样品前处理方法进行优化,选择了目前各国规定的最大残留限量要求的10 种头孢类药物及其代谢产物,建立了基于UPLC-MS/MS仪测定3 类主要蜂产品(蜂蜜、蜂王浆和蜂王浆冻干粉)中头孢类药物残留的分析方法。该方法具有精密度和准确度高、检测周期短的优点,为蜂产品中头孢类药物的风险识别、确证与风险评估提供了有效的技术支撑。
1 材料与方法
1.1 材料与试剂
蜂产品:蜂蜜、蜂王浆和蜂王浆冻干粉 市购。
头孢类药物标准品(头孢匹林、头孢哌酮、头孢唑啉、头孢乙腈、头孢拉定、头孢氨苄、头孢洛宁、头孢喹肟、去乙酰基头孢匹林、头孢噻肟)(纯度均大于95%) 德国Dr. Ehrenstorfer GmbH公司;甲酸(色谱纯) 美国Tedia公司;乙腈、甲醇(均为色谱纯) 德国Merck公司;Oasis PRIME HLB固相萃取小柱(500 mg/6 mL) 美国Waters公司;实验用水为Milli-Q超纯水。
1.2 仪器与设备
UPLC XevoTMTQ-S micro超高效液相色谱-串联质谱仪(配有电喷雾离子源(electron spray ionization,ESI)及MassLynxV4.1数据处理系统) 美国Waters公司;低温高速离心机 德国Sigma公司;Vortex Genie 3旋涡振荡器 德国IKA公司。
1.3 方法
1.3.1 样品处理
称取蜂蜜样品约5.00 g(精确至0.01 g)于50 mL离心管中;称取蜂王浆样品约2.50 g(精确至0.01 g);称取蜂王浆冻干粉样品约1.00 g(精确至0.01 g)。分别加入10%甲酸溶液20 mL,涡旋振荡1 min;蜂蜜样品直接移取溶液,蜂王浆、蜂王浆冻干粉样品9 500 r/min离心5 min,移取上清液至Oasis PRIME HLB固相萃取小柱,待液面到达柱床表面时用3 mL水淋洗,3 mL乙腈洗脱,收集全部流出液,流出液在40 ℃氮气吹干;用1 mL 0.1%甲酸溶液-甲醇(95∶5,V/V)溶液溶解,涡旋振荡,过0.22 μm滤膜,然后UPLC-MS/MS进行分析。
1.3.2 色谱条件
色谱柱:Acquity UPLC BEH C18(2.1 mm×100 mm,1.7 μm);流动相:A相为0.1%甲酸溶液,B相为甲醇;流速0.30 mL/min;进样量10 μL。
1.3.3 质谱条件
多反应离子监测模式(multiple reaction monitoring,MRM);ESI源正离子模式电离;脱溶剂气流速:1 000 L/h;锥孔气流速:50 L/h;离子源温度:150 ℃;脱溶剂气温度:500 ℃;毛细管电压:2.0 kV;射频电压:0.5 V;萃取锥孔电压:25 V。
1.4 数据分析
所有实验至少重复3 次,数据以平均值表示,采用Excel 2013软件进行统计分析,由工作站直接生成MRM色谱图。
2 结果与分析
2.1 仪器条件优化
2.1.1 色谱条件
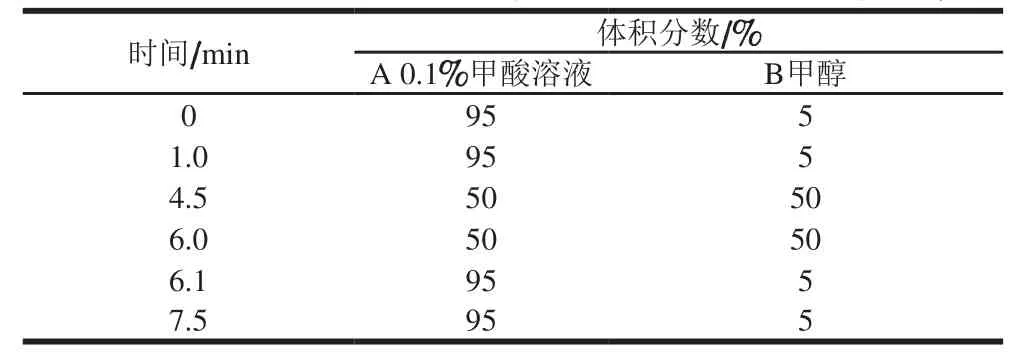
表1 梯度洗脱程序Table 1 Gradient elution program of liquid chromatography
本实验考察了水-乙腈和水-甲醇2 种流动相体系的响应情况,发现当采用水-乙腈进行梯度洗脱时,各头孢类药物之间存在相互离子抑制情况,其中头孢哌酮、头孢乙腈等头孢类药物的响应较差,可能是在乙腈作为流动相的体系中,易离子化的头孢类药物抑制了不易离子化的头孢类药物进行离子化,从而导致有的药物未完全离子化;而采用水-甲醇体系为流动相进行梯度洗脱时,相互抑制的情况未发生,10 种药物的响应均较好,所有的头孢类药物均获得了较好的离子化,从而均获得了较好的灵敏度,因此确定水-甲醇体系为流动相。梯度洗脱条件如表1所示。
2.1.2 质谱条件
本实验采用体积分数5%的甲醇溶液分别配制2.0 mg/L的10 种头孢类药物标准溶液,利用UPLC-MS/MS仪自带的Intellistart软件分别获得10 种头孢类药物的母离子、子离子、锥孔电压和碰撞能量,如表2所示。对头孢类药物采用ESI正负离子模式扫描,发现较负离子模式在正离子模式下10 种药物的响应更高,灵敏度更好,所以采用正离子模式进行实验。这与现有文献报道的基于液相色谱-串联质谱仪测定头孢类药物残留的分析方法大多采用ESI源正离子模式电离一致[5-9]。

表2 10 种头孢类药物的母离子、子离子、锥孔电压和碰撞能量Table 2 Parent ions, daughter ions, cone voltages and collision energies for 10 cephalosporins
2.2 前处理条件优化
实验使用体积分数10%甲酸溶液和乙腈-水(80∶20,V/V)2 种溶剂对蜂蜜在加标量20 μg/kg水平下进行提取上样,结果发现采用乙腈-水(80∶20,V/V)上样时,所有头孢类药物的回收率为75.9%~87.5%;而采用10%甲酸溶液上样时,所有头孢类药物的回收率均不低于82.5%(82.5%~95.5%),因此确定以10%甲酸的溶液进行溶解上样。在10%甲酸溶液作为头孢类药物提取溶剂的条件下,蜂蜜样品回收率较高,但蜂王浆和蜂王浆冻干粉样品的回收率较低,这是由于头孢类物质在水中的溶解度较高,与蜂蜜样品相比,蜂王浆和蜂王浆冻干粉样品中含水量较少,从而导致提取目标化合物不完全,回收率较低。以蜂王浆为例补充了相关的实验。发现当蜂王浆样品为5 g的情况下需要的水的体积为50 mL左右,这将给下一步过柱和方法的实际操作带来一定的困难,因此将蜂王浆的称样量定为2.5 g;同理,将蜂王浆冻干粉称样量定为1.0 g。发现在减少蜂王浆和蜂王浆冻干粉样品的称样量后,回收率可以达到与蜂蜜样品相近的结果。
2.3 固相萃取小柱的选择
根据头孢类药物的相关报道[28-29],考虑到药物的理化特性,前处理中净化一般选用Oasis HLB固相萃取小柱,且净化过程往往需要活化等费时费力的步骤。本实验对Oasis PRIME HLB和Oasis HLB两款固相萃取小柱进行比较。结果显示,在无需活化等复杂的步骤下,样品采用Oasis PRIME HLB固相萃取小柱净化后,无论是在回收率还是基质干扰方面,均优于采用Oasis HLB固相萃取小柱净化的结果。这可能是因为对于蜂产品特别是蜂王浆和蜂王浆冻干粉中的磷脂和蛋白质等杂质,相比较Oasis HLB固相萃取小柱,Oasis PRIME HLB固相萃取小柱可以更好地吸附这些杂质,不仅无需活化等费时费力的前处理步骤,在显著缩短净化时间的同时还能延长色谱柱的使用寿命[30-31]。因此本实验采用Oasis PRIME HLB固相萃取小柱作为净化小柱。
2.4 线性实验结果

表3 10 种头孢类药物在不同基质中的标准曲线和相关系数Table 3 Standard curve equations with correlation coefficients in different matrices for 10 cephalosporins
采用蜂产品空白基质液配制1、5、20、50、200、500、1 000 μg/L的系列基质标准工作溶液(其中头孢乙腈、头孢哌酮和头孢唑啉为5、20、50、200、500、1 000 μg/L)进行UPLC-MS/MS分析,以峰面积对相应质量浓度作标准曲线,得到线性回归方程和相关系数(r2),如表3所示。10 种头孢类药物在相应质量浓度范围内线性关系良好,r2均大于0.999。
2.5 回收率、精密度与检出限测定结果

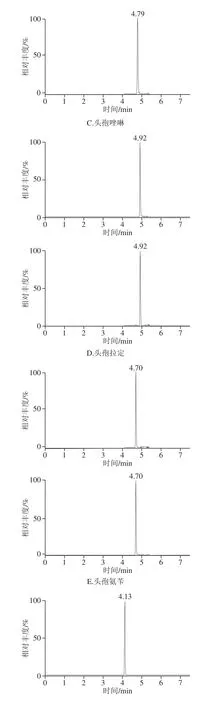


图1 10 种头孢混合标准溶液(1 μg/L)的MRM色谱图Fig. 1 MRM chromatograms of mixed standard solution (1 μg/L)
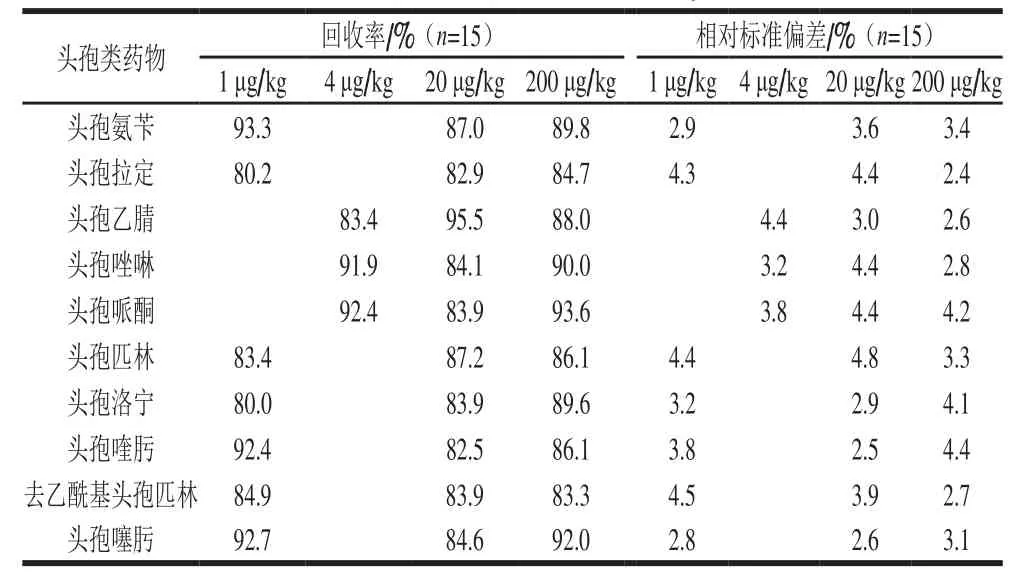
表4 10 种头孢类药物在蜂蜜中的回收率和相对标准偏差Table 4 Recoveries and relative standard deviations of 10 cephalosporins in honey
头孢类药物标准溶液MRM色谱图见图1。在蜂产品中选取最为主要的蜂蜜、蜂王浆和蜂王浆冻干粉3 类基质进行实验,从每一类基质中选取代表样品进行添加回收实验,计算相对标准偏差。样品前处理同1.3.1节,其中,蜂蜜中头孢哌酮、头孢乙腈和头孢唑啉3 种头孢类药物的添加量为4、20、200 μg/kg,其余7 种头孢类药物的添加量为1、20、200 μg/kg;蜂王浆中头孢哌酮、头孢乙腈和头孢唑啉3 种药物的添加量为8、40、200 μg/kg,其余7 种头孢类药物的添加量为2、20、200 μg/kg;蜂王浆冻干粉中头孢哌酮、头孢乙腈和头孢唑啉3 种药物的添加量为20、50、200 μg/kg,其余7 种头孢类药物的添加量为5、50、200 μg/kg,每批次同添加水平做5 个平行样品,重复测定3 次,结果见表4~6。

表5 10 种头孢类药物在蜂王浆中的回收率与相对标准偏差Table 5 Recoveries and relative standard deviations of 10 cephalosporins in royal jelly

表6 10 种头孢类药物在蜂王浆冻干粉中的回收率与相对标准偏差Table 6 Recoveries and relative standard deviations of 10 cephalosporins in lyophilized royal jelly powder
由表4~6可知,10 种头孢类药物的加标回收率为80.0%~95.5%,相对标准偏差为1.5%~4.8%。上述结果表明,该方法对测定蜂蜜、蜂王浆和蜂王浆冻干粉中10 种头孢类药物的残留均具有较好的准确度和精密度。按3 倍信噪比(RSN=3)计算,10 种头孢类药物的检出限为0.1~1 μg/kg;按10 倍信噪比(RSN=10)计算,10 种头孢类药物的定量限为0.3~3 μg/kg。GB 31650—2019《食品中兽药最大残留限量》规定头孢喹肟、头孢氨苄在动物性食品中的最大残留限量为20~1 000 μg/kg,而本方法检出限为0.1~1 μg/kg,能满足该类药物在蜂产品中含量分析的需要。
3 结 论
建立了同时分析蜂产品中10 种头孢类药物的UPLCMS/MS方法,样品经10%甲酸溶液提取后离心,上清液经Oasis PRIME HLB固相萃取柱净化,氮吹后复溶进样分析。10 种头孢类药物的添加回收率为80.0%~95.5%,相对标准偏差为1.5%~4.8%;检出限为0.1~1 μg/kg,定量限为0.3~3 μg/kg。方法具有精密度和准确度高、检测周期短的优点,能满足蜂产品中10 种头孢类药物含量分析的需要。

