气相色谱-串联质谱法测定婴幼儿配方奶粉中氯丙醇酯和缩水甘油酯
林丽珊,傅武胜,,张一可,高 博,蓝丽华,庞 杰
(1.福建农林大学食品科学学院,福建 福州 350000;2.福建省人兽共患病研究重点实验室,福建省疾病预防控制中心,福建 福州 350001;3.福建医科大学公共卫生学院,福建 福州 350122;4.福建国际旅行卫生保健中心,福建 福州 350003;5.福建中医药大学药学院,福建 福州 350122)
氯丙醇酯(chloropropanols esters,MCPDE)和缩水甘油酯(glycidyl esters,GE)是在热加工处理或氯离子作用下形成的一类食品加工过程污染物[1-3]。2012年国际癌症研究机构(International Agency for Research on Cancer,IARC)将3-氯丙醇(3-monochloropropane-1,2-diol,3-MCPD)和缩水甘油(glycidol,Gly)分别列为2B、2A类致癌物[4-5]。2017年,欧盟食品安全局(European Food Safety Authority,EFSA)确定了人体对3-氯-1,2-丙二醇脂肪酸酯(3-chloro-1,2-propanediol fatty acid ester,3-MCPDE)的每日最大允许耐受量(tolerable daily intake,TDI)为2.0 μg/(kg·d),食品添加剂委员会将其暂定为4.0 μg/(kg·d)[6]。这些污染物普遍存在精炼食用油等油脂性食品中[7-8],婴幼儿配方奶粉(以下简称婴配)含有约20%的脂肪,其主要来自于生产中添加的食用植物油,因此容易造成MCPDE和GE的污染[9]。对于婴儿,配方乳粉是母乳的唯一替代品,因此此类物质引起的食品安全问题一直倍受国际关注。2016年EFSA报道欧盟地区婴配中3-MCPDE和GE的平均含量分别为0.108、0.087 mg/kg(以奶粉计)[10]。Arisseto等[11]报道巴西市售婴配3-MCPDE和GE的平均含量分别高达0.150、0.220 mg/kg,由此评估0~5 月龄婴儿3-MCPDE的平均摄入量达2.49 μg/(kg·d),超过EFSA提出的TDI,1 岁以下婴儿GE的暴露边界比(margin of exposure,MOE)为2 793~6 635,明显小于界限值(25 000),显示存在致癌风险。上述产品中GE均值也超过了欧盟制订的限量值(0.050 mg/kg,以奶粉计)[12]。
目前有关MCPDE和GE测定方法的研究多集中于食用植物油,针对婴配基质的报道较少。由于婴配生产中添加的配料种类多,加上生产工艺复杂且产品之间差异大,因此婴配中该类物质测定的难度较大,影响结果准确性的因素较多,尤其脂肪的提取和水解步骤影响较大。一般待测物MCPDE和GE随脂肪一起从婴配中提取出来,提取方法主要有加速溶剂提取法[13]或加压溶剂提取法[14]、液-液萃取法[15]和碱水解法[16]。待测物定量的方法有直接法和间接法2 种,直接法采用液相色谱-三重四极杆质谱仪测定各单体物质的方式实现[15-17],因此结果通常偏低且测定成本高;间接法能获得总量,结果相对准确,但操作步骤较为繁琐,需经水解(酯交换反应)、衍生后再以气相色谱-质谱联用测定,通过检测水解产物的衍生物而得到MCPDE和GE的含量,水解方法有酸水解[18-19]、碱水解[20-22]以及酶解法[23]。目前国内外均无此类物质的法定强制性检测方法,标准化方法仅有美国分析化学家协会(Association of Official Agricultural Chemists,AOAC)法[24],该法一开始就在婴配中加入内标后提取,而更多报道采用在提取出的脂肪中加入内标再进行预处理的做法。我国报道了婴配中MCPDE[25]或GE[26]一类物质的测定方法,无法实现3 类物质的同时测定。为此,在本实验室建立的食用油MCPDE和GEGE测定方法的基础上,建立同时测定婴配中这3 类物质的方法,并对重要因素进行了优化,取得较好效果,该方法已被编入我国食品安全风险监测工作手册,在全国推广应用。
1 材料与方法
1.1 材料与试剂
婴配(编号为A及YL-34) 市售。
氨水、乙醇、乙醚、石油醚(30~60 ℃)、硫酸(均为分析纯) 国药集团化学试剂有限公司;四氢呋喃、甲醇、正己烷、异辛烷、二氯甲烷(均为色谱纯) 美国Fisher公司;七氟丁酰基咪唑衍生(N-heptafluorobutyrylimidazole,HFBI) 北京百灵威科技有限公司;高效脱水剂、硅藻土固相萃取小柱(1.5 g/45 mL,另含3.0 g硅藻土分散剂) 福州勤鹏生物科技公司;去离子水由实验室制备。
3-氯-1,2-丙二醇棕榈酸二酯(纯度98%,CAS号51930-97-3)、2-氯-1,3-丙二醇硬脂酸二酯(纯度98%,CAS号267-56-4)、缩水甘油棕榈酸酯(纯度95%,CAS号7501-44-2)及对应同位素D5-3-氯-1,2-丙二醇棕榈酸二酯(纯度99%,CAS号1185057-55-9)、D5-2-氯-1,3-丙二醇硬脂酸二酯(纯度99%)、D5-缩水甘油-棕榈酸酯(纯度97.5%) 加拿大TRC公司。
1.2 仪器与设备
7890A-7000B气相色谱-串联质谱仪 美国Agilent公司;G-560E型旋涡混合器 美国Scientific Industries公司;DKN602型电热恒温鼓风干燥箱 日本Yamato公司;CP225D电子天平(感量至0.01 mg) 德国Sartorious公司;YP202电子天平(感量至0.01 g)上海精密科学仪器公司;BM510-RE801旋转蒸发仪日本Yamato公司;SHA-B水浴恒温振荡器 常州金坛精达仪器制造公司;EFAA-DC24氮吹仪 上海安谱实验科技股份有限公司。
1.3 方法
1.3.1 脂肪的提取和测定
参考GB 5009.6—2016《食品中脂肪的测定》[27]并进行适当的优化。婴配称样量经优化由5.00 g减少为1.50 g,氨水用量为3.0 mL,其余有机溶剂用量也按照相应比例进行调整。
1.3.1.1 婴配的称样量
分别称取1.00、1.50、2.00、2.50、3.00 g奶粉于15 支50 mL塑料离心管中,保持与GB 5009.6—2016[27]相同的料液比加入有机溶剂,每组(称样量)重复3 次实验,以奶粉计。
1.3.1.2 氨水用量
准确称取1.50 g婴配于15 支50 mL离心管中,加入5 mL热水(65±5)℃分散后,于对应的离心管中分别加入氨水1.0、2.0、3.0、4.0、5.0 mL,进行脂肪提取及后续目标含量的测定,每组重复操作3 次实验,以奶粉计。
1.3.1.3 干燥方式
准确称取1.50 g婴配于9 支50 mL离心管中,将所得提取液浓缩后,采用3 种方式干燥脂肪,对比干燥方式对MCPDE和GE测定结果的影响,具体为真空干燥(50~60 ℃、2 h)、国标干燥法(105 ℃、2 h)[27]和高温干燥法(120 ℃、2 h),每个条件重复实验3 次。
1.3.2 MCPDE与GE含量的测定
准确称取脂肪0.100 g(精确至1 mg),加入混合内标液后涡旋,先进行溴代将GE转化为3-溴丙醇酯,再采用酸水解法进行酯交换,将待测物水解为3-MCPD、2-MCPD和3-溴丙醇;水解液经碱中和后,用基质分散固相萃取法净化,洗脱液充分脱水后浓缩,经HFBI衍生后供气相色谱-串联质谱法测定,采用同位素内标法对3-MCPDE、2-氯-1,3-丙二醇脂肪酸酯(2-chloro-1,3-propanediol fatty acid ester,2-MCPDE)和GE定量,具体操作步骤参考文献[28]。
1.3.3 气相色谱-串联质谱测定
气相色谱条件:参考文献[28]方法进行测定。色谱柱:DB-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm);不分流进样;进样体积1.0 μL;进样口温度280 ℃;载气为高纯氦气,恒流,流速0.8 mL/min;程序升温:50 ℃保持1 min,然后以3 ℃/min升温至100 ℃,再以40 ℃/min升温至300 ℃,保持3 min。
质谱条件:电子电离源;电离能量70 eV;多反应监测模式;离子源温度230 ℃;四极杆温度150 ℃;传输线温度280 ℃;溶剂延迟3.75 min。
1.4 数据处理
若未经特别说明以脂肪计(脂肪干燥实验结果),本实验MCPDE及GE含量均以奶粉计。用Excel 2019进行数据统计,通过SPSS 17软件进行显著性分析,并以Origin 8.5软件作图。婴配中MCPDE、GE的含量按下式计算:

式中:X为婴配中MCPDE、GE的含量(分别以氯丙醇、缩水甘油计)/(μg/kg);W为由标准曲线计算得到的脂肪中MCPDE和GE的质量/ng;m为婴配脂肪的质量/g;f为婴配中脂肪质量分数/%。
2 结果与分析
2.1 仪器条件的建立
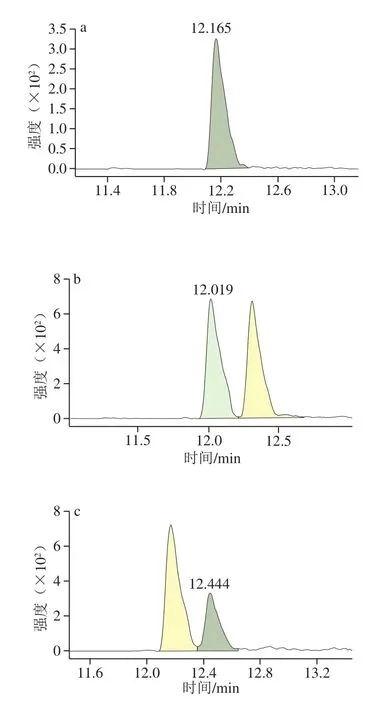
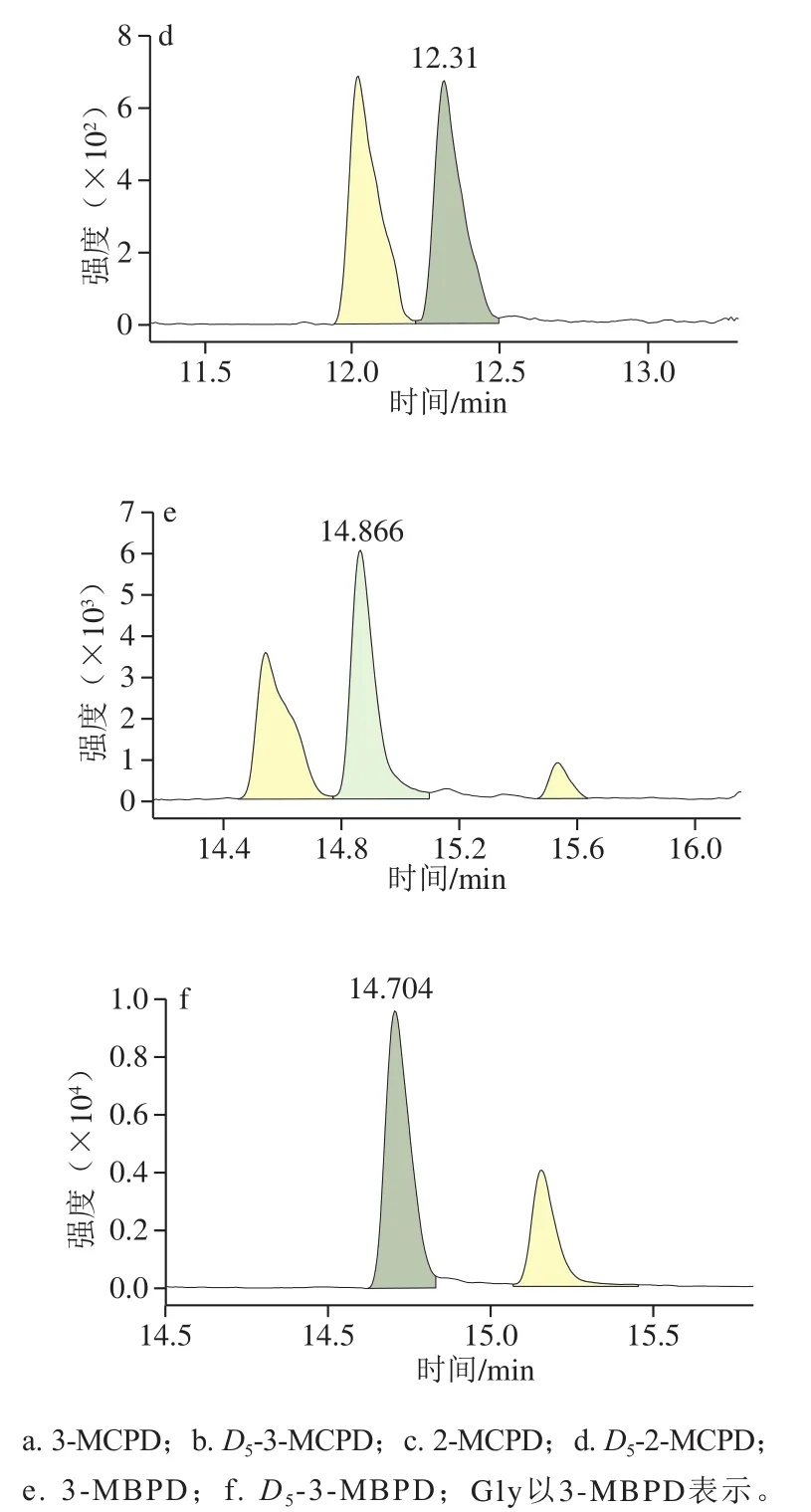
图1 婴配基质FAPAS 2656中MCPD与Gly衍生物的多反应监测色谱图Fig. 1 MRM chromatograms of MCPD and Gly derivatives in infant formula matrix FAPAS 2656

表1 MCPD和3-MBPD定量、定性离子对及碰撞电压Table 1 Quantitative, qualitative ion pairs and collision voltage for MCPD and 3-MBPD
将MCPD、MBPD及其同位素用乙酸乙酯配制为20 μg/mL的单一标准液,用HFBI衍生后,用全扫描方式进行测定,以此获得各物质的特征离子。选择特征离子对,在多反应监测模式下进行监测。如图1、表1所示,目标物能从干扰杂质中得到有效分离,确保了准确定量。
2.2 提取条件的优化
2.2.1 婴配称样量
表2 称样量对MCPD和G的影响Table 2 ffect of sample mass on the determination of MCPD and G

表2 称样量对MCPD和G的影响Table 2 ffect of sample mass on the determination of MCPD and G
化合物 含量/(μg/kg)1.00 g 1.50 g 2.00 g 2.50 g 3.00 g 3-MCPDE 176 183 183 183 183 2-MCPDE 63.5 65.2 68.5 67.2 65.7 GE 15.3 11.0 11.6 12.7 12.2
如表2所示,样品称取量在1.00~3.00 g之间时,测得3-MCPDE、2-MCPDE和GE含量基本一致,平均值分别为181.6、66.0、12.6 μg/kg,重复测定的相对标准偏差(relative standard derivation,RSD)均小于10%(n=3)。在单因素方差分析中,P0.05分别为0.838、0.311、0.125均大于0.05,表明婴配样品的均匀度高,称样量对MCPDE和GE含量测定均无显著性影响。但称取1.00 g时,所得脂肪仅为0.20 g左右,无法满足多次测定的用量;称取1.50 g时,得到的脂肪约为0.30 g,可满足后续2~3 次测定所需要的量。但样品量过多时,有机溶剂使用量较多,同时影响操作效率,如无法使用50 mL离心管进行振荡提取。因此确定最佳称样量为1.50 g。
2.2.2 氨水用量
表3 氨水用量对MCPD和G含量的影响Table 3 ffect of ammonia on the determination of MCPD and G
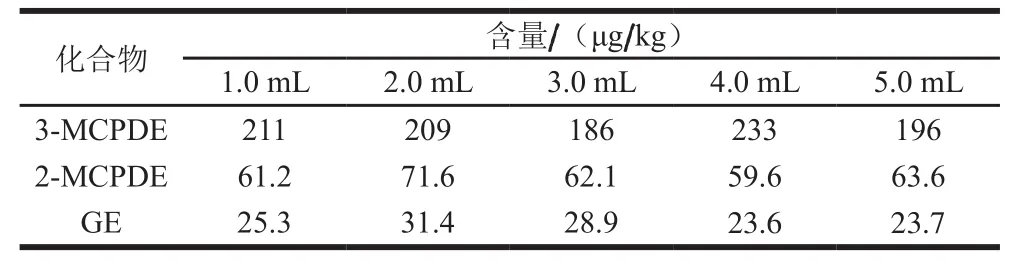
表3 氨水用量对MCPD和G含量的影响Table 3 ffect of ammonia on the determination of MCPD and G
化合物 含量/(μg/kg)1.0 mL 2.0 mL 3.0 mL 4.0 mL 5.0 mL 3-MCPDE 211 209 186 233 196 2-MCPDE 61.2 71.6 62.1 59.6 63.6 GE 25.3 31.4 28.9 23.6 23.7
如表3所示,当氨水用量在1.0~5.0 mL之间变化时,测得样品中3-MCPDE、2-MCPDE和GE的含量分别为186~213、59.6~71.6 μg/kg和23.6~31.4 μg/kg。方差分析3-MCPDE、2-MCPDE的P值(概率)分别为0.057、0.140,表明提取过程中氨水用量对3-MCPDE、2-MCPDE测定无显著影响(P>0.05);GE的P值为0.005(F0.05=7.18,组间差异),表明氨水用量对GE测定有显著性差异(P<0.05),但当氨水用量在1.0~3.0 mL之间时,GE测定值无显著差异(P=0.075)。对于本实验待测物而言,1.0~3.0 mL的氨水对测定均无显著性差异,但考虑到Rose Gottlieb Method[29]、GB 5009.6—2016[27]中测定婴配脂肪含量时,氨水的适宜用量为3.0 mL。因此采用3.0 mL的氨水量时,能充分满足这些指标准确检测的要求。
2.2.3 脂肪干燥

图2 脂肪干燥对MCPD和G含量的影响Fig. 2 Effect of fat drying on the determination of MCPDE and GE
MCPDE和GE为食品加工过程中形成的污染物,温度是极其重要的影响因素[30]。因此,在提取过程中,比较3 种脂肪干燥温度方式对MCPDE和GE测定结果的影响,见图2。3 种脂肪干燥温度对其无显著性影响(P>0.05),重复3 次实验时RSD均小于10%,这说明在120 ℃以下的温度干燥脂肪,均不会造成目标物含量的显著增加,但干燥温度仍然对3-MCPDE测定具有一定的影响,随温度升高测定值略有增加;干燥温度由低到高,测得平均含量分别为784、800 μg/kg和888 μg/kg,显示120 ℃干燥1 h时导致3-MCPDE测定值明显偏高,达13.3%,而在105 ℃干燥1 h时测定值800 μg/kg仅略高于真空干燥时测定值,增加2.0%,几乎可忽略不计。考虑到真空干燥设备不是通常配备的实验室设备,因此选择105 ℃常压加热1 h的条件对脂肪进行干燥。
2.3 方法学指标考察结果
2.3.1 线性范围、检出限和定量限结果
表43 -MCPD、2-MCPD与G的检出限与线性方程Table 4 LODs and linear equations for 3-MCPD, 2-MCPD and G
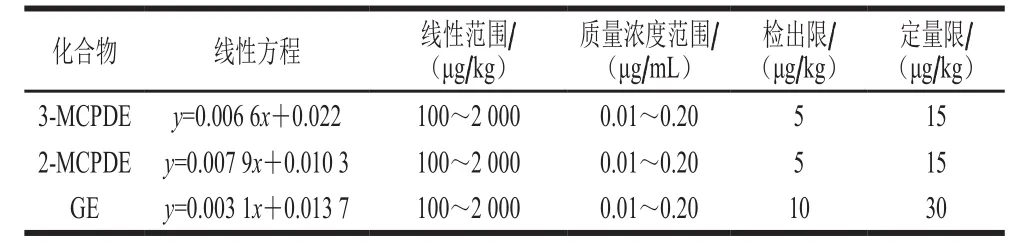
表43 -MCPD、2-MCPD与G的检出限与线性方程Table 4 LODs and linear equations for 3-MCPD, 2-MCPD and G
质量浓度范围/(μg/mL)化合物 线性方程 线性范围/(μg/kg)检出限/(μg/kg)定量限/(μg/kg)3-MCPDE y=0.006 6x+0.022 100~2 000 0.01~0.20 5 15 2-MCPDE y=0.007 9x+0.010 3 100~2 000 0.01~0.20 5 15 GE y=0.003 1x+0.013 7 100~2 000 0.01~0.20 10 30
以不含待测物空白油为基质,计算信噪比。检出限(RSN=3)和定量限(RSN=10)[31]结果见表4。分别以3-MCPD、2-MCPD及Gly表示3-MCPDE、2-MCPDE及GE的含量。将3-MCPD、2-MCPD及GE与其各自内标物峰面积的比值Y和脂肪中待测物的质量X(ng,以醇计)进行线性回归,相关系数在0.999以上。
2.3.2 精密度和准确度结果
婴配(YL-34)的脂肪质量分数为20.5%,3-MCPDE、2-MCPDE和GE的含量(以奶粉计)分别为21.3、8.20、5.34 μg/kg,本底值较低,因此适合加标实验。向提取的脂肪中加入标准溶液,加标含量分别为100、400、1 000 μg/kg;以奶粉计时,加标含量分别为20.5、82.0、205 μg/kg,其中82.0 μg/kg与欧盟规定的GE限量值(75.0 μg/kg)较为接近。在上述最优条件下进行实验,考察测定的准确度和精密度,分别以重复6 次回收率和RSD表示,结果见表5。
表5 婴配的加标回收率和RSD结果(n=6)Table 5 Spiked recoveries and RSDs of 3-MCPD, 2-MCPD and Gfrom infant formula (n= 6)
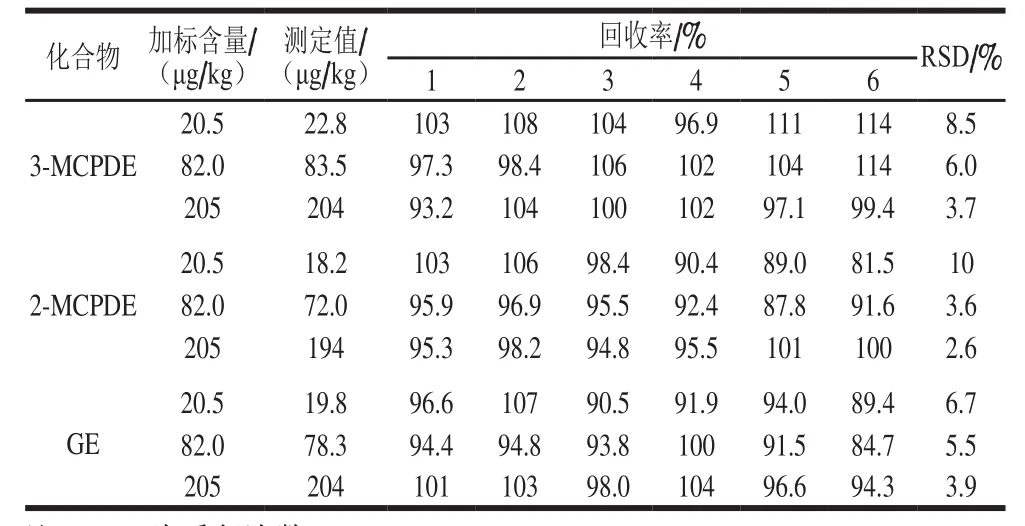
表5 婴配的加标回收率和RSD结果(n=6)Table 5 Spiked recoveries and RSDs of 3-MCPD, 2-MCPD and Gfrom infant formula (n= 6)
注:1~6为重复次数。
化合物 加标含量/(μg/kg)测定值/(μg/kg)回收率/% RSD/%1 2 3 4 5 6 3-MCPDE 20.5 22.8 103 108 104 96.9 111 114 8.5 82.0 83.5 97.3 98.4 106 102 104 114 6.0 205 204 93.2 104 100 102 97.1 99.4 3.7 2-MCPDE 20.5 18.2 103 106 98.4 90.4 89.0 81.5 10 82.0 72.0 95.9 96.9 95.5 92.4 87.8 91.6 3.6 205 194 95.3 98.2 94.8 95.5 101 100 2.6 20.5 19.8 96.6 107 90.5 91.9 94.0 89.4 6.7 82.0 78.3 94.4 94.8 93.8 100 91.5 84.7 5.5 205 204 101 103 98.0 104 96.6 94.3 3.9 GE
由表5可知,该婴配在20.5~205 μg/kg水平下进行6 次加标实验,3-MCPDE、2-MCPDE及GE的回收率分别为93.2%~114%、81.5%~106%和84.7%~107%,RSD在2.6%~10%之间,说明优化后的方法具有较好的准确度和精确度,满足方法学指标的要求。
2.4 FAPAS 2656考核样品测定结果
采用所建立的测定方法参加2019年英国食品与环境研究院举办的国际能力验证[32],项目编号为FAPAS 2656,样品基质为婴幼儿配方乳粉,由此更好地验证了本方法的准确性。全球共29 个实验室报名参加该次能力验证,但结果提交率仅为81%;在提交结果的实验室中,3-MCPDE和2-MCPDE的满意率(|Z|<2)较低,分别为56%(15/27)和68%(15/22)。3-MCPDE、2-MCPDE的指定值分别为44.0、16.4 μg/kg,采用本方法测得含量分别为35.2、17.7 μg/kg,对应Z值分别为-0.9和0.4,结果满意(Z<2.0),表明所建立的方法准确可靠。但本实验测定GE含量为21.7 μg/kg,由于各实验室报告的GE含量较为分散,无法用Z值进行评定和统计。
3 结 论
本实验对婴配脂肪提取、制备过程中的3 个因素进行研究,考察其对后期MCPDE和GE含量测定的影响,并对优化后的方法进行系统评价和性能考察,重点是采用加标回收率实验,对方法的准确度和精密度指标进行考察。结果表明,在脂肪提取过程中,婴配称样量、氨水用量以及干燥方式对后续脂肪中MCPDE和GE含量测定均无显著性差异,但考虑氨水添加量对GE以及干燥方式对3-MCPDE的影响,以婴配称样量为1.50 g、氨水用量为3.0 mL、105 ℃干燥1 h为实验最优条件。优化后方法的灵敏度、精密度和准确度均较为理想,同时参加国际能力考核(FAPAS 2656),测定结果Z值小于1.0,获得满意成绩,更进一步验证了本方法的精确度和准确度。该方法也被指定作为国家食品安全风险监测工作手册方法,在全国推广应用,为有关监测工作提供了可靠的技术支撑。

