支气管镜下激光、球囊扩张联合冷冻治疗良性中心气道狭窄的疗效分析
江玲 徐健 韩雪 高娜 赵婧 刘春芳
良性中心气道狭窄(central airway stenosis,CAS)指气管、右中间段支气管、主支气管,因各种良性病变引起的气道狭窄,可造成程度不一的呼吸困难、咳嗽、咳痰等,严重者甚至因窒息死亡[1]。良性CAS病因多样,主要机制为各类良性病因导致气道损伤而出现损伤修复过程异常,造成局部瘢痕组织、肉芽组织过度增生。虽然各类内镜介入治疗技术治疗良性CAS能获得不错的临床疗效,但观察发现,热消融、机械牵拉后还可能造成医源性黏膜水肿及肉芽肿,甚至诱发瘢痕狭窄[2]。冷冻治疗是近年用于良性CAS的新型介入治疗技术,通过局部低温清除气道内良性异物。近年来关于其报道认为冷冻治疗不刺激瘢痕及肉芽组织增生,基于冷冻治疗的机理,有学者认为其还可能对电刀、激光热消融、机械牵拉后的医源性损伤具有改善作用,但关于上述内镜介入联合治疗的临床报道较少[3]。因此本研究纳入42例良性CAS患者,研究冷冻治疗在支气管镜下激光、球囊扩张等介入治疗中的作用及机制,报道如下。
资料与方法
一、一般资料
本研究对象为2017年11月-2018年8月于我院治疗的42例良性CAS患者,随机数字表法均分为两组。对照组21例患者采用支气管镜下激光、球囊扩张治疗,观察组21例患者在此基础上联合冷冻治疗。对照组男性14例,女性7例;年龄18~71岁,平均(35.32±4.98)岁;气道狭窄程度27%~92%,平均(45.44±5.92)%;狭窄长度1~4cm,平均(2.03±0.42)cm;病因:气管结核12例,良性气道肿瘤1例、插管、气管切开后狭窄8例。观察组男性12例,女性9例;年龄18~67岁,平均(36.15±4.87)岁;气道狭窄程度25%~90%,平均(46.03±5.54)%;狭窄长度1~4cm,平均(2.01±0.40)cm;病因:气管结核15例,良性气道肿瘤1例、插管、气管切开后狭窄5例。两组一般资料比较差异无统计学意义(P>0.05)(见表1)。
纳入标准:(1)年龄18~80岁;(2)符合中华医学会呼吸病学分会《良性中心气道狭窄经支气管镜介入诊治专家共识》[4]诊断标准;(3)对支气管镜介入治疗、检查均耐受;(4)气道未完全闭塞。排除标准:(1)合并凝血功能障碍、严重基础疾病等手术不耐受者;(2)软化型狭窄;(3)非瘢痕病变、肉芽增殖性气道狭窄;(4)合并肺癌、哮喘等影响呼吸功能疾病。
二、方法
术前禁饮禁食6 h,取仰卧位,麻醉方案为2%利多卡因常规术前雾化吸入,联合术中芬太尼、丙泊酚静脉镇静镇痛,配合吸氧及生命体征监测。对照组采用支气管镜下激光、球囊扩张治疗,奥林巴斯BF1T260支气管治疗镜,铥激光治疗,发射头距离病变0.5~1cm,对准病变部位自中心向下,向外照射,直至瘢痕病变、肉芽增殖引起的狭窄处管腔明显增大到能够通过扩张球囊或冷冻探头为宜,再将坏死物经支气管镜负压吸出或活检钳钳夹。激光治疗后进行球囊扩张,根据狭窄程度选择较支气管正常管径略小的高压球囊扩张导管,由支气管镜活检孔道进入直至气道狭窄中心位置,球囊内经压力泵加压到3~8 atm(1atm=101.325 kPa),由低至高递增,先保持1min,若出现缺氧、呼吸困难时立即退出球囊。 如无明显胸痛、出血及再次加压,分别保持2~3min,待管腔明显增大后停止。
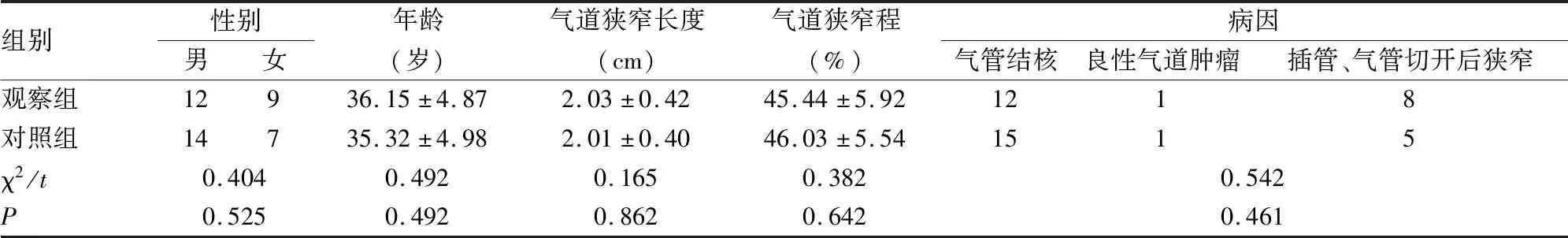
表1 两组一般资料比较
观察组联合冷冻治疗,经激光治疗、球囊扩张后连接主机与冷冻探头,将冷冻探头由孔道插入,超出支气管镜远端约1.0 cm,将探头末端置于病灶上,对肉芽组织进行冻融或冻切,切割后的瘢痕边缘进行冻融。 探头顶端形成冰球后持续8~10秒,病灶较大者可设定多个冷冻点,每点1~3 次,直至瘢痕边缘、肉芽增生的可见部分得到完全冷冻。若球囊扩张后观察到之前未发现的肉芽组织,新发现病变可再次进行冷冻治疗。
三、观察指标
随访1年,记录围术期情况;比较术后当天、1月、10个月气道狭窄疗效[5]:缓解:症状完全消失,管径达到或超过原径2/3或以上;部分缓解:症状有效改善,管径达到原径1/3~2/3;无效:未达以上标准甚至病情变重者;各随访时间采用美国胸科学会(American Thoracic Society,ATS)气促评分标准评价呼吸困难指数[6],0分:正常;1分:快速步行出现气促;2分:正常行走时气促,但能继续行走;3分:正常行走时气促,需停止休息;4分:轻微活动便发生气促;支气管镜下观察肉芽肿、黏膜水肿、管腔通畅等情况。
四、统计学分析
结 果
一、两组围术期情况
观察组术后住院期间发生呼吸困难1例,发生率4.76%,对照组发生4例,发生率19.05%,观察组显著低于对照组(χ2=7.655,P=0.014);经支气管镜下清理及糖皮质激素治疗后缓解;球囊扩张时均出现轻微渗血,无活动性出血;均无气胸、大咯血、纵隔气肿等发生。
二、两组气道狭窄疗效比较
两组术后当天气道狭窄疗效评价差异无统计学意义(P>0.05),术后1月、10个月观察组气道狭窄再通疗效优于对照组(P<0.05)(见表2)。
三、两组术后呼吸困难指数比较
观察组术后当天、1月、10个月呼吸困难指数均显著低于对照组(P<0.05)(见表3)。
四、两组术后支气管镜下情况
观察组术后肉芽肿能较快形成稳定非挛缩样瘢痕,并保持稳定管腔扩大状态;对照组易出现黏膜水肿,残留肉芽肿,容易出现管腔再狭窄(见图1~2)。
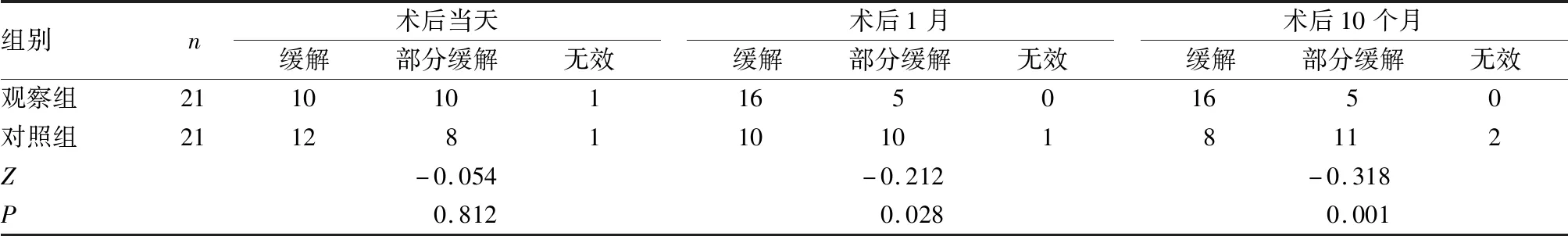
表2 两组气道狭窄疗效比较

表3 两组术后呼吸困难指数比较
注:与术后当天比较aP<0.05,与术后1月比较bP<0.05。

患者,女,22岁;图1a:术前支气管镜检查显示右主支气管狭窄;图1b:经支气管镜下激光、球囊扩张联合冷冻治疗后当天镜下显示右主支气管管径明显增大;图1c:术后10个月支气管镜复查支气管管径扩大到原管径2/3。
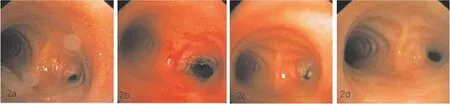
患者,男,28岁;图2a:术前支气管镜检查显示右主支气管狭窄;图2b:经支气管镜下激光、球囊扩张治疗后当天镜下显示右主支气管管径明显增大;图2c:术后1月支气管镜复查仍有肉芽组织,并进行再次治疗;图2d:术后10个月镜下显示支气管管径扩大到原管径1/3。
讨 论
良性CAS即由良性病因引起的中心气道狭窄,发病因素较多,包括支气管气管外伤、手术、异物、结核、气管插管或切开后,隆突再造等,以肉芽肿、瘢痕形成等造成的狭窄为主。良性CAS内科药物治疗往往效果不佳,外科手段去除造成CAS的良性病因,已成为胸外科领域的重要研究领域,但传统手术创伤大、恢复慢、并发症多,而近年随着内镜介入技术的发展,内镜下电刀、激光及经球囊扩张等技术在良性CAS取得了一定的临床疗效。但有报道称,无论是支气管镜下电刀、激光、氩等离子凝固等对肉芽肿、瘢痕等进行去除,均容易再发瘢痕,导致中心气道再次狭窄,临床疗效不佳[7]。Lewinsohn[8]认为,瘢痕治疗是良性CAS内镜介入技术的关键,热消融以及机械牵拉对瘢痕性狭窄能够获得良好的即时效果,但维持时间一直是其预后的重要影响因素。因此有学者认为,在良性CAS进行热消融或机械牵拉后给予冷冻治疗不仅能对之前未发现的肉芽或瘢痕组织进行再次冷切、冷融,还能降低热消融后瘢痕形成、组织水肿,有助于提高临床疗效及治疗安全性[9]。
铥激光是通过脉冲固体激光机发出的激光,它具有极高的能量密度, 一种很潜力的新型激光。在激光汽化治疗中,理论上波长越接近1940 nm的激光水吸收程度越良好,组织热损伤相对更轻,切割越准确,相较于传统波长2140nm的钬激光,铥激光在CAS的治疗中更加安全。直接辐照铥激光束能在短时间内使局部组织的温度达到200~1000℃,在良性CAS的治疗中受照射的瘢痕、肉芽组织凝固坏死,最终汽化或碳化。同时其生物组织吸收效果良好,热损伤深度仅0.1mm,对周围正常组织损伤较小,因此能够很好地掌握安全距离[10]。铥激光配合可控制的高压球囊扩张导管进行气道扩张,能够机械性进行气道扩大,其运用方便、经济、对气道损伤轻,联合热消融治疗气道扩张效果明显[11]。本研究结果显示,两组术后当天气道狭窄均获得良好的即时扩张效果,且再通疗效评价差异无统计学意义(P>0.05),提示支气管镜下激光、球囊扩张治疗良性CAS短期疗效显著。但术后1月、10个月观察组气道狭窄再通疗效优于对照组(P<0.05),这与加用冷冻治疗具有直接联系。
冷冻治疗的原理为焦耳-汤姆逊效应制冷,高压CO2气体释放在局部组织产生-80 ℃低温,在良性CAS的运用中能使肉芽或瘢痕组织中水分子迅速结晶并溶解,还能使局部血管停流、形成微血栓而致细胞坏死、凋亡。软骨含水量较少冷,冻治疗对含水少的组织损伤较轻,因此气道内组织给予冷冻治疗主要对增生瘢痕、肉芽组织进行冷融,对气道损伤较轻,气道穿孔危险性较低,安全性较高[12]。本研究在激光治疗后进行冷冻治疗,低温能使热消融后残余病变组织或周围较浅的正常组织内的肌腱蛋白C、血管内皮生长因子(VEGF)表达下调,因此能减少医源性损伤引起的瘢痕及组织水肿,对术后气道畅通的维持具有十分重要的意义[13]。球囊扩张后观察到之前未发现的肉芽组织,新发现病变再次进行冷冻治疗使病变坏死、脱落,气道扩张更为彻底,以至于观察组术后当天、1月、10个月呼吸困难指数均显著低于对照组(P<0.05),表明支气管镜下激光、球囊扩张联合冷冻治疗更佳彻底、有效。
但值得注意的是,冷冻治疗虽然冷切、冷融效果良好,但对于重度狭窄,瘢痕、肉芽组织较多者,其治疗效率偏低,因此不建议其单独进行良性CAS治疗,联合其他内镜介入治疗技术,能发挥更大的临床作用[14]。综上所述,支气管镜下激光、球囊扩张联合冷冻治疗良性CAS疗效更佳,术后呼吸更畅通,同时冷冻治疗能改善激光、球囊扩张治疗后出现的医源性黏膜水肿及肉芽肿引起的气道再度狭窄。

