茵虎清肝方对D-氨基半乳糖脂多糖诱导的急性肝衰竭模型大鼠肝损伤的影响*
何 瑜 马晓星 解 姗
(1.北京中医药大学枣庄医院,山东 枣庄 277000;2.山东省青岛市即墨区中医医院,山东青岛 266200)
急性肝衰竭(AHF)是指由多种因素引起的肝细胞大面积死亡或严重肝功能损伤一种临床综合征,可进展为肝性脑病多器官功能衰竭危及生命,可出现肝功能异常、黄疸、肝脏生化指标异常、凝血功能障碍等[1]。严重或持续的肝损伤是导致AHF发病的原因,早期干预对AHF尤为重要。AHF发病机制复杂,至今尚未完全阐明。中医在临床治疗AHF过程中发挥了重要作用。抗炎保肝是目前AHF研究的热点[2]。现代中医认为“毒邪-毒浊”肝衰竭是致病因素[3]。茵虎清肝方具有清热解毒、活血化瘀之功效,是笔者所在医院治疗AHF的临床经方。本研究通过腹腔注射D-氨基半乳糖脂多糖诱导大鼠建立急性肝衰竭模型,通过研究茵虎清肝方对AHF病理组织形态、炎症因子、氧化应激以及肝脏纤维化指标的影响,旨在探讨茵虎清肝方的作用机制。
1 材料与方法
1.1 实验动物 60只健康SPF级Wistar大鼠,8周龄,由北京维通利华实验动物技术有限公司提供[SCXK(京)2014-003],雌雄各半,体质量(250± 20)g。本研究经笔者所在医院实验动物伦理委员会批准,符合中国伦理委员会指导原则。
1.2 药物与试剂 茵虎清肝方:虎杖30 g,金银花12 g,茵陈15 g,黄连9 g,白花蛇舌草6 g,蒲公英9 g,野菊花6 g,紫花地丁6 g,丹参9 g,瓜蒌12 g,枳实9 g,甘草、法半夏各3 g。药材回流提取,最后浓缩成1 g/mL的煎煮液,放凉后待用。D-氨基半乳糖脂多糖由美国Sigma公司提供。安宫牛黄丸(北京同仁堂有限公司,批号20180918,国药准字Z11020076),水合氯醛(国药集团化学试剂有限公司,批号20180910),隐血试剂盒、苏木素-伊红(HE)染色试剂盒由北京索莱宝科技有限公司提供,C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)ELISA试剂盒购于武汉博士德生物技术有限公司。谷丙转氨酶(ALT)、谷草转氨酶(GOT)、总胆红素(TBIL)由Roche有限公司提供。超氧歧化酶(SOD)、血清丙二醛(MDA)试剂盒、谷胱甘肽(GSH)试剂盒均购自碧云天生物科技有限公司。
1.3 分组与给药 60只大鼠随机分为对照组、模型组、阳性组、实验组,每组15只。各组大鼠在自然光线,以标准饲料和无菌蒸馏水喂养。阳性组给予安宫牛黄丸0.3 g/kg灌胃;实验组给予茵虎清肝方10 g/kg灌胃,连续7 d。对照组和模型组均给予同体积的蒸馏水灌胃。
1.4 模型制备 7 d给药结束后开始进行造模。对照组未经任何处理,其余各组大鼠参考文献[4]制定急性肝衰竭模型大鼠模型:腹腔注射D-氨基半乳糖(DGalN,700 mg/kg)/脂多糖(LPS,10 μg/kg),作用 6 h后即完成建模。通过大鼠的肝功能水平和肝脏组织的病理改变情况判定造模是否成功。
1.5 标本采集与检测 1)肝组织病理变化观察。成模后7 d,断头处死大鼠,取肝大叶部分组织,固定于10%甲醛溶液中,脱水,石蜡包埋,切片,HE染色,制作2~3张切片,于显微镜下进行病理学检查。2)肝功能检测。采用全自动生化分析仪检测ALT、GOT及TBIL,记录肝脏指数。3)炎症因子、氧化应激和肝纤维化指标检测。处死大鼠后,取大鼠腹动脉血液样品3 mL,离心,分离血清,ELISA法检测CRP、TNF-α、IL-6炎症因子水平,SOD、MDA、GSH严格按照试剂盒说明书操作。用放射免疫分析透明质酸酶(HA)层黏连蛋白(LN)Ⅲ型前胶原(Ⅲ-PC)和Ⅳ型胶原Ⅳ(Ⅳ-C),严格按照试剂盒说明书操作。
1.6 统计学处理 应用SPSS19.0统计软件。计量资料以()表示,组间比较采用独立样本t检验,组内比较采用配对t检验,计数资料以n(%)表示,应用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组肝衰竭病理学观察 对照组大鼠的肝细胞排列均匀规则,结构清晰。模型组肝细胞排列紊乱、细胞水肿变性坏死,肝索紊乱,炎性细胞浸润,纤维组织增生,肝窦区扩张并充血。给予药物干预后,阳性组和实验组大鼠的肝细胞形态结构稍紊乱,肝细胞肿胀减轻,坏死肝细胞减少,结节状也少,纤维组织减少,两组大鼠的肝脏病理学无明显区别,见图1。
2.2 各组肝脏功能以及肝脏指数比较 见表1。与对照组比较,模型组大鼠的ALT、GOT、TBIL以及肝脏指数明显升高(P<0.05)。给予药物干预后,阳性组和实验组的ALT、GOT、TBIL以及肝脏指数明显低于模型组(P<0.05),两组间比较差异有统计学意义(P<0.05)。
表1 各组大鼠ALT、GOT、TBL以及肝脏指数比较(±s)
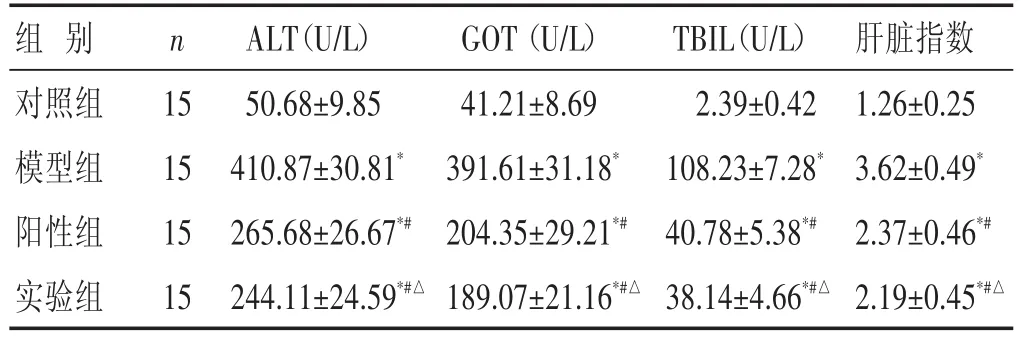
表1 各组大鼠ALT、GOT、TBL以及肝脏指数比较(±s)
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与阳性组比较,△P<0.05。下同
组别对照组模型组阳性组实验组n 15 15 15 15 ALT(U/L)50.68±9.85 410.87±30.81*265.68±26.67*#244.11±24.59*#△GOT(U/L)41.21±8.69 391.61±31.18*204.35±29.21*#189.07±21.16*#△TBIL(U/L)2.39±0.42 108.23±7.28*40.78±5.38*#38.14±4.66*#△肝脏指数1.26±0.25 3.62±0.49*2.37±0.46*#2.19±0.45*#△
2.3 各组氧化应激指标比较 见表2。与对照组比较,模型组大鼠的SOD和GSH含量明显降低,MDA含量明显升高;药物干预后,阳性组和实验组大鼠SOD和GSH含量明显升高(P<0.01),MDA含量明显降低(P<0.05)。阳性组和实验组大鼠的SOD、GSH和MDA含量差异有统计学意义(P<0.05)。
表2 各组大鼠SOD、GSH和MDA含量比较(±s)
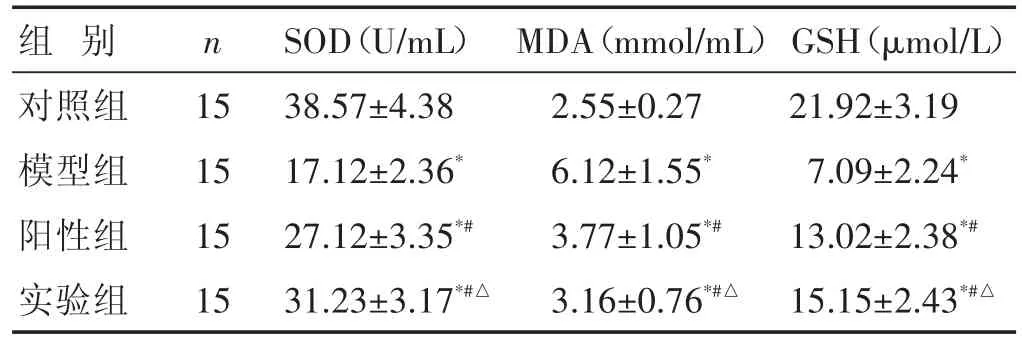
表2 各组大鼠SOD、GSH和MDA含量比较(±s)
组别对照组模型组阳性组实验组n 15 15 15 15 SOD(U/mL)38.57±4.38 17.12±2.36*27.12±3.35*#31.23±3.17*#△MDA(mmol/mL)2.55±0.27 6.12±1.55*3.77±1.05*#3.16±0.76*#△GSH(μmol/L)21.92±3.19 7.09±2.24*13.02±2.38*#15.15±2.43*#△
2.4 各组炎症因子比较 见表3。与对照组比较,模型组大鼠的TNF-α、IL-1β以及IL-6水平明显高于对照组(P<0.05)。给予药物治疗后,阳性组和实验组的TNF-α、IL-1β以及IL-6水平明显低于模型组(P<0.05)。两组大鼠的TNF-α、IL-1β以及IL-6水平比较差异有统计学意义(P<0.05)。
表3 各组大鼠血清中的TNF-α、IL-1β以及IL-6水平比较(±s)
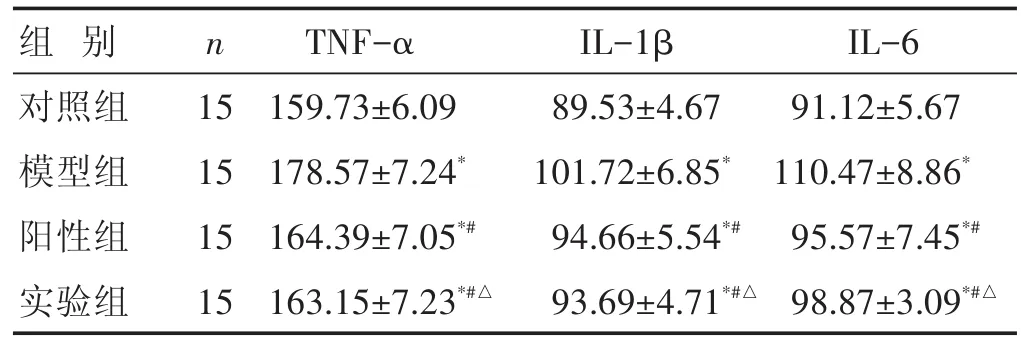
表3 各组大鼠血清中的TNF-α、IL-1β以及IL-6水平比较(±s)
组别对照组模型组阳性组实验组n 15 15 15 15 TNF-α 159.73±6.09 178.57±7.24*164.39±7.05*#163.15±7.23*#△IL-1β 89.53±4.67 101.72±6.85*94.66±5.54*#93.69±4.71*#△IL-6 91.12±5.67 110.47±8.86*95.57±7.45*#98.87±3.09*#△
2.5 各组肝纤维化指标比较 见表4。与对照组比较,模型组大鼠肝纤维化指标明显高于对照组(P<0.05)。给予药物治疗后,阳性组和实验组大鼠的HA、LN、Ⅲ-PC以及Ⅳ-C水平明显低于模型组(P<0.05)。两组大鼠的HA、LN、Ⅲ-PC以及Ⅳ-C水平比较有差异有统计学意义(P<0.05)。
表4 各组大鼠肝纤维化指标比较(ng/mL,±s)
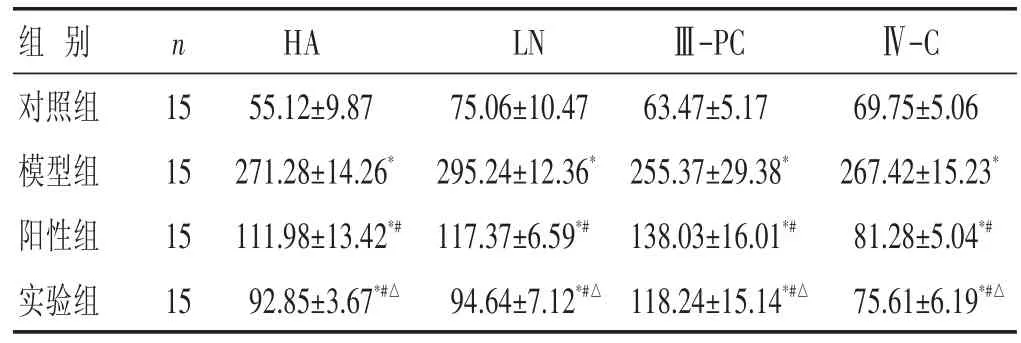
表4 各组大鼠肝纤维化指标比较(ng/mL,±s)
组别对照组模型组阳性组实验组n 15 15 15 15 HA 55.12±9.87 271.28±14.26*111.98±13.42*#92.85±3.67*#△LN 75.06±10.47 295.24±12.36*117.37±6.59*#94.64±7.12*#△Ⅲ-PC 63.47±5.17 255.37±29.38*138.03±16.01*#118.24±15.14*#△Ⅳ-C 69.75±5.06 267.42±15.23*81.28±5.04*#75.61±6.19*#△
3 讨论
目前,AHF具体发病机制尚未完全阐明,但病毒感染、氧化应激、内毒素血症以及细胞因子等因素被认为可导致AHF的发生。腹腔注射D-GalN/LPS诱导AHF大鼠是常用的经典AHF模型。LPS是革兰氏阴性菌内毒素的主要成分,D-GalN可使LPS的急性毒性增强。研究发现[5],LPS可刺激大鼠巨噬细胞产生炎症相关细胞因子的大量释放,导致肝脏氧化应激反应,诱导AHF大鼠肝细胞坏死与凋亡。TNF-α是由活性T细胞和巨噬细胞产生,具有促进炎症细胞聚集活化及释放炎症介质作用,可导致内皮细胞功能失调,加重炎症症状,是炎症反应的起始因子,亦是急性炎症相关指标;IL-1β可通过激活内皮细胞增加诱导细胞间黏附分子表达,诱发炎性发应,是重要的促炎因子之一,介导了炎症的重要过程,与TNF-α的释放相互促进,是引起发热等炎症反应的诱因;IL-6参与多种生物学效应因子,导致神经-内分泌-免疫功能紊乱主要外因之一,直接介导炎症反应的发生。处于氧化应激状态时机体内的ROS和MDA含量上升,可造成肝组织肿胀和坏死处于氧化应激状态时机体内的ROS和MDA含量上升,可造成肝组织肿胀和坏死[6]。ALF是AHF发生发展进程中的重要病理基础之一,其研究是治疗肝脏疾病的一个重要途径。MDA含量可反映组织过氧化损伤程度。GSH含量反映了机体抗氧化和清除自由基的能力。SOD可消除单线态氧,是细胞抗氧化的第一道防线。纤维化是肝病后期的一个重要病理过程,是肝病发生发展进程中的一个重要环节[7-9]。
中医学认为AHF属“急黄”“瘟黄”范畴,其主要病机毒瘀痰,毒为病因,贯穿于疾病的始终,瘀为病变之本,且互为因果,形成恶性循,治疗亦清毒化瘀祛痰。茵虎清肝方具有清热解毒、活血化瘀之功效[10-11]。其组方中虎杖清热解毒退黄、散瘀止痛,茵陈清热解毒、利胆退黄,两药合用清热解毒、化瘀退黄。配以金银花、黄连、白花蛇舌草、蒲公英、野菊花、紫花地丁增强清热解毒之效、丹参、瓜蒌、枳实协同虎杖活血化瘀,甘草、法半夏健脾和胃、止呕,甘草调和诸药。诸药合用起到清热解毒、活血化瘀之功效。现代药理研究表明[12-15],瓜蒌可明显减轻平阳霉素所致的大鼠肺泡炎及纤维化程度,抑制肺组织中炎症因子过度表达;虎杖中虎杖苷对D-gal致肝损伤具有防治作用,其作用机制可能与提高机体的抗氧化能力,抑制炎症反应和抑制肝细胞凋亡有关;蒲公英提取物对LPS激活小鼠腹腔巨噬细胞炎症因子分泌具有明显的抑制作用;丹参多糖具有明显缓解小鼠免疫性肝损伤的作用,其机制可能与拮抗肝脏脂质过氧化反应,降低肝组织中炎症细胞因子。
本研究结果显示,模型组肝细胞排列紊乱、细胞水肿变性坏死,肝索紊乱,炎性细胞浸润,纤维组织增生,肝窦区扩张并充血。给予药物干预后,阳性组和实验组大鼠的肝细胞形态结构稍紊乱,肝细胞肿胀减轻,坏死肝细胞减少,结节状也少,纤维组织减少。结果提示茵虎清肝方可明显改善AHF大鼠的肝脏病理学,降低肝损伤。模型组大鼠的ALT、GOT、TBIL、肝脏指数以及肝纤维化指标明显升高。给予药物干预后,阳性组和实验组的ALT、GOT、TBIL、肝脏指数、HA、LN、Ⅲ-PC以及Ⅳ-C水平明显低于模型组,两组间比较有显著差异。结果提示茵虎清肝方可明显改善AHF大鼠肝功能,可有效防治肝脏纤维化。模型组大鼠的SOD和GSH含量明显降低,TNF-α、IL-1β、IL-6水平和MDA含量明显升高;药物干预后,阳性组和实验组大鼠SOD和GSH含量明显升高,TNF-α、IL-1β、IL-6水平和MDA含量明显降低。阳性组和实验组大鼠的SOD、GSH和MDA含量、TNF-α、IL-1β以及IL-6水平比较有显著性差异。结果提示茵虎清肝方可明显减少AHF大鼠的氧化应激反应,降低炎症因子水平。
综上所述,茵虎清肝方通过抑制炎症反应、减少氧化应激,阻断肝脏纤维化对D-氨基半乳糖脂多糖诱导的大鼠急性肝衰竭发挥保护作用。

