苦参软膏对小鼠湿疹模型的治疗作用及免疫机制分析*
蔡思龙 段亚星
(1.武汉科技大学医院,湖北 武汉 430081;2.湖北省阳新县第三人民医院,湖北 阳新435200)
湿疹特征为红斑和瘙痒性皮疹,影响全球国家约20%的儿童[1-2]。湿疹诱因复杂,不仅包括遗传和环境因素,还包括免疫和皮肤细胞的特征。对外来抗原的超敏反应和免疫系统的异常活动是湿疹的主要原因,众多炎症因子在湿疹中起关键作用[3-4]。Notch1是Notch家族的重要成员,能辅助各种CD4+T细胞的分化,包括TH1、TH2和调节性T细胞(Tregs)[5]。研究表明,抑制Notch信号传导通路可阻断TH1和TH2极化。过量表达Notch1活性形式的转基因小鼠在胸腺和脾脏中具有增高的CD4+、CD25+调节性T细胞水平,并且能增加自身免疫性皮炎的发病率[6]。转化生长因子-β1(TGF-β1)是一种多效抗炎细胞因子,与调节性T细胞分化有关。人和小鼠CD4+、CD25+调节性T细胞可在TGF-β1刺激后从幼稚T细胞产生[7-9]。苦参软膏由苦参总碱组成,具有清热燥湿,杀虫止痒的功效。苦参软膏局部给药可避免胃肠道刺激,降低血液中的药物浓度,减少副作用,还可以提高患者的依从性[10]。多项研究表明[11],苦参软膏可抑制过敏反应,但抗炎作用尚不清楚。本研究拟探讨苦参软膏对小鼠湿疹模型的治疗作用及免疫机制,为湿疹的治疗提供理论依据。
1 材料与方法
1.1 实验动物 BALB/cJ小鼠80只购自华中科技大学实验动物中心,4周龄,体质量18~22 g,实验动物生产许可证号:SCXK(鄂)2016-0009。实验动物使用许可证号:SYXK(鄂)2016-0057。动物质量合格证号:00182316。所有的小鼠于无特定病原体的环境中喂养:温度(21±3)℃、湿度(55±3)%、12 h光照-黑暗循环(光照6∶00~18∶00),自由获取水及饲料。本实验方案经武汉科技大学动物伦理委员会批准,试验严格按照《中华人民共和国实验动物管理条例》进行。
1.2 试药与仪器 苦参软膏(上海宝龙药业有限公司,批号180319);地塞米松软膏(华润三九医药股份有限公司,批号180126);2,4-二硝基氯苯(DNCB)、柠檬酸钠缓冲液(美国Sigma公司,批号147548、401967);SYBR-Green Supermix试剂盒、二氨基联苯胺试剂盒(上海硕美生物科技有限公司,批号PK00810、AB00317);TRIzol试剂(美国Invitrogen公司,批号ac6947);Notch1、TGF-β1一抗(上海玉博生物科技有限公司,批号171209、171216);辣根过氧化物酶缀合的Notch1、TGF-β1二抗(南京森贝伽生物科技有限公司,批号180118、180207);白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)Elisa试剂盒(伊艾博武汉科技股份有限公司,批号180326、171229、180415);磷酸缓冲液(PBS)(上海碧云天生物技术有限公司,批号47458);Zeiss Axio成像仪、NanoDrop 2000核酸定量仪、NanoDrop 2000紫外分光光度计[赛默飞世尔科技(中国)有限公司];QuantStudio 6 Flex Realtime PCR系统(美国Applied Biosystems公司)。
1.3 分组与造模 按随机数字表法分成4组:对照组、模型组、地塞米松组(0.35 g/kg)、苦参软膏组(0.35 g/kg),每组20只,雌雄各半。对照组、模型组、地塞米松组、苦参软膏组小鼠于造模前1 d,在背部选取1.5 cm×1.5 cm面积的皮肤区域剃毛,隔日剃毛区域外涂50 μL的5%2硝基氯苯(DNCB)第1次致敏,1周后剃毛区再次去毛,次日外涂1%DNCB 100 μL激发,第2次致敏,每周致敏1次,连续4周,第4周致敏结束。对照组小鼠背部皮肤操作同模型组、地塞米松组、苦参软膏组,但不外涂DNCB[12]。
1.4 给药方法 致敏结束3 d后取小鼠背部皮肤进行给药干预试验。地塞米松组、苦参软膏组小鼠剃毛区外敷相应药物,并用六层医用小纱布覆盖创面(2 cm×2 cm),予医用纸胶带包扎固定,每天换药1次,对照组、模型组小鼠剃毛区不予处理,持续4周。
1.5 标本采集与监测 1)小鼠湿疹皮肤组织炎症细胞计数。制作小鼠湿疹皮肤组织HE染色切片,计数视野内炎症细胞数目。2)小鼠湿疹皮肤组织Notch1、TGF-β1 mRNA表达水平的测定。根据制造商的说明,用TRIzol试剂从小鼠湿疹皮肤组织中分离总RNA。在测量RNA浓度后,NanoDrop 2000紫外分光光度计检测RNA的完整性,根据制造商的方案将3 μg RNA逆转录成cDNA,使用SYBR-Green Supermix试剂盒进行RT-qPCR,反应条件如下:95℃10秒和60℃32秒,40个循环。β-肌动蛋白为各靶基因的内参基因,使用2-ΔΔCq方法定量,一式3份测量Notch1、TGF-β1表达水平,并计算平均值,β-肌动蛋白用作内部对照。β-肌动蛋白(96 bp)的引物是正向:5′-GATCAGCAGCAG AGTATG-3′(F)和反向:5′-AGAGTGTACGCACTA-3′(R);Notch1(105 bp)的引物是正向:5′-CAGGGTTCCACTTCCAAACA-3′(F)和反向:5′-TGGAGATCAGC TCCCGTATAA-3′(R);TGF-β1(85 bp)的引物是正向:5′-GGAGGAUGAUACAAGUUCA-3′(F)和 反 向 :5′-GAGGCUGCCAUAUCUUUGA-3′(R)。3)小鼠湿疹皮肤组织Notch1、TGF-β1蛋白表达水平的测定。使用两步Envision plus染色技术进行Notch1、TGF-β1的免疫组织化学染色。制作4 μm厚的小鼠湿疹皮肤组织切片,然后将该部分脱石蜡并分别用二甲苯和梯度乙醇再水合,将样本在0.01 mol/L柠檬酸钠缓冲液(pH6.0)中孵育2 min,使用3%过氧化氢阻断内源过氧化物酶活性。将样本与兔抗人小鼠湿疹皮肤组织Notch1(1∶2 500稀释)、TGF-β1(1∶2 500稀释)一抗于4 ℃温育过夜。用磷酸缓冲液(PBS)洗涤样品,在室温下与辣根过氧化物酶缀合的二抗Notch1、TGF-β1孵育30 min,并再次用PBS洗涤。然后将样品进行二氨基联苯胺着色,并用20%苏木精复染在Zeiss Axio成像仪上成像染色。通过计数每个区域的阳性细胞数量来进行定量,对于5个图像,计算5个原始计数的平均值,并表示每个图表的一个数据点,在至少5个视野中使用半定量方法对染色的组织切片进行评分,染色标准为0分表示<5%阳性染色细胞(阴性表达),1分表示5%~20%阳性染色细胞(弱表达),2分表示21%~50%阳性染色细胞(中度表达),3分为>50%阳性染色细胞(强表达)。4)小鼠湿疹皮肤组织IL-2、IL-6、TNF-α蛋白表达水平的测定。用含有蛋白酶和磷酸酶抑制剂混合物的缓冲液制备小鼠湿疹皮肤组织匀浆,在4℃以12 000 r/min离心20 min后,收集上清液,用ELISA法测定IL-2、IL-6、TNF-α蛋白。
1.6 统计学处理 应用SPSS23.0统计软件。计量资料以()表示,多组间比较采用单因素方差分析,两两比较采用t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 各组小鼠皮肤组织炎症细胞计数比较 见表1。与对照组比较,模型组湿疹皮肤组织炎症细胞计数水平明显升高(P<0.05);与模型组比较,地塞米松组、苦参软膏组湿疹皮肤组织炎症细胞计数水平明显下降(P<0.05);地塞米松组、苦参软膏组湿疹皮肤组织炎症细胞计数水平相近(P>0.05)。
表1 各组小鼠皮肤组织炎症细胞计数比较(±s)

表1 各组小鼠皮肤组织炎症细胞计数比较(±s)
与对照组比较,*P<0.05;与模型组比较,△P<0.05。下同
组别对照组模型组地塞米松组苦参软膏组n 20 20 20 20炎症细胞计数(个/mm2)68.29±10.45 144.71±14.45*86.62±13.24△89.88±13.14△
2.2 各组小鼠皮肤组织HE染色比较 见图1。对照组皮肤结构正常,见复层鳞状上皮,有角化物,真皮层无炎细胞浸润;模型组表皮坏死,见瘢痕组织颗粒层、棘层增厚,真皮层血管充血扩张、水肿伴大量炎细胞浸润;地塞米松组、苦参软膏组仍可见中性细胞及嗜酸性细胞浸润,但数量明显较模型组减少,表皮结构清晰趋于正常。

图1 各组小鼠皮肤组织HE染色比较(400倍)
2.3 各组小鼠皮肤组织Notch1、TGF-β1 mRNA水平比较 见表2。与对照组比较,模型组湿疹皮肤组织Notch1、TGF-β1 mRNA明显升高(P<0.05);与模型组比较,地塞米松组、苦参软膏组湿疹皮肤组织Notch1、TGF-β1 mRNA明显降低(P<0.05);地塞米松组、苦参软膏组湿疹皮肤组织Notch1、TGF-β1mRNA水平相近(P>0.05)。
表2 各组小鼠皮肤组织Notch1、TGF-β1 mRNA水平比较(±s)
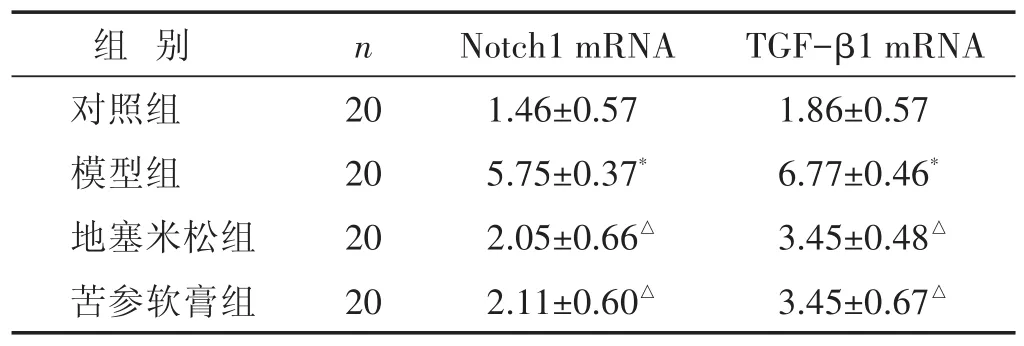
表2 各组小鼠皮肤组织Notch1、TGF-β1 mRNA水平比较(±s)
组 别n Notch1 mRNA TGF-β1 mRNA对照组模型组地塞米松组苦参软膏组20 20 20 20 1.46±0.57 5.75±0.37*2.05±0.66△2.11±0.60△1.86±0.57 6.77±0.46*3.45±0.48△3.45±0.67△
2.4 各组小鼠皮肤组织Notch1、TGF-β1蛋白水平比较 见表3,图2~图3。与对照组比较,模型组湿疹皮肤组织Notch1、TGF-β1蛋白明显升高(P<0.05);与模型组比较,地塞米松组、苦参软膏组湿疹皮肤组织Notch1、TGF-β1蛋白明显降低(P<0.05);地塞米松组、苦参软膏组湿疹皮肤组织Notch1、TGF-β1蛋白水平相近(P>0.05)。免疫组化法下,Notch1、TGF-β1阳性表达为棕褐色,Notch1、TGF-β1阳性表达情况与各蛋白表达水平符合。
表3 各组小鼠皮肤组织Notch1、TGF-β1蛋白水平比较(±s)
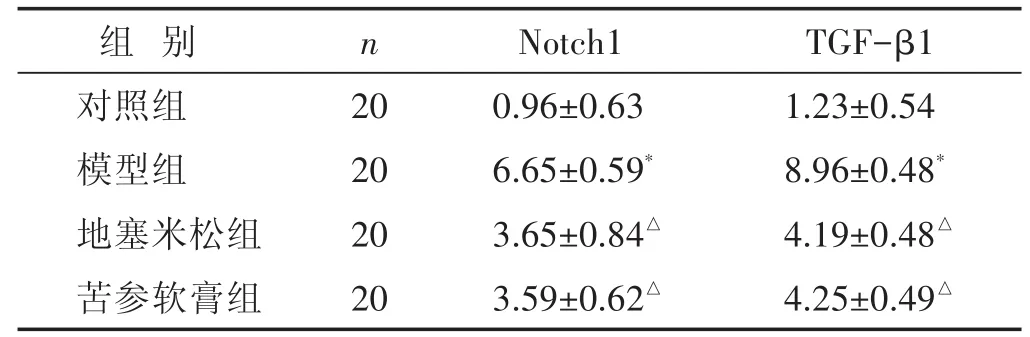
表3 各组小鼠皮肤组织Notch1、TGF-β1蛋白水平比较(±s)
组 别n Notch1TGF-β1对照组模型组地塞米松组苦参软膏组20 20 20 20 0.96±0.63 6.65±0.59*3.65±0.84△3.59±0.62△1.23±0.54 8.96±0.48*4.19±0.48△4.25±0.49△

图2 各组小鼠湿疹皮肤组织Notch1表达(DAB染色,400倍)

图3 各组小鼠皮肤组织Notch1、TGF-β1蛋白水平(DAB染色,400倍)
2.5 各组小鼠湿疹皮肤组织IL-2、IL-6、TNF-α水平比较 见表4。与对照组比较,模型组湿疹皮肤组织IL-2、IL-6、TNF-α水平明显升高(P<0.05);与模型组比较,地塞米松组、苦参软膏组湿疹皮肤组织IL-2、IL-6、TNF-α水平明显降低(P<0.05);地塞米松组、苦参软膏组湿疹皮肤组织IL-2、IL-6、TNF-α水平相近(P>0.05)。
表4 各组小鼠湿疹皮肤组织IL-2、IL-6、TNF-α蛋白水平比较(ng/g,±s)
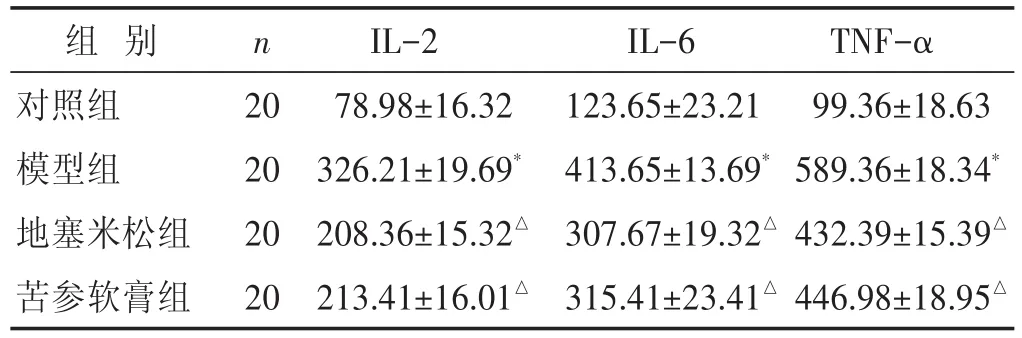
表4 各组小鼠湿疹皮肤组织IL-2、IL-6、TNF-α蛋白水平比较(ng/g,±s)
组别对照组模型组地塞米松组苦参软膏组n 20 20 20 20 IL-2 78.98±16.32 326.21±19.69*208.36±15.32△213.41±16.01△IL-6 123.65±23.21 413.65±13.69*307.67±19.32△315.41±23.41△TNF-α 99.36±18.63 589.36±18.34*432.39±15.39△446.98±18.95△
3 讨 论
近年来,湿疹的治疗主要集中在使用抗组胺药物和局部使用皮质类固醇的对症治疗。然而,长期使用皮质类固醇会导致其显著的副作用,包括皮纹,色素变化和皮肤萎缩[13]。因此,迫切需要开发用于湿疹的新的有效疗法。中草药在治疗湿疹方面具有悠久的历史,在包括婴儿在内的各年龄段中具有相对较少的副作用。口服和/或局部给药,如方风通圣丸,丹皮酚霜等军具有良好的疗效。苦参,为豆科植物苦参的干燥根,春、秋二季采挖,除去根头和小支根,洗净,干燥,或趁鲜切片,干燥。其性苦、寒,有清热燥湿、杀虫、利尿之功,用于热痢、便血、黄疸尿闭、赤白带下、阴肿阴痒、湿疹、湿疮、皮肤瘙痒、疥癣麻风等病症,外治滴虫性阴道炎[14-15]。据报道,苦参具有抗中毒作用,抗炎和抗肿瘤活性[16]。本次研究发现:模型组湿疹皮肤组织炎症细胞计数水平明升高;与模型组比较,地塞米松组、苦参软膏组湿疹皮肤组织炎症细胞计数水平明显下降;地塞米松组、苦参软膏组湿疹皮肤组织炎症细胞计数水平相近。以上结果提示苦参软膏能明显减轻小鼠湿疹炎症反应,这与病理学结果中苦参软膏组仍可见中性粒细胞及嗜酸性细胞浸润,但数量明显较模型组减少,表皮结构清晰趋于正常相符合。
Notch信号在代谢和炎症过程中起关键作用。在巨噬细胞中,Notch1信号通过干扰素调节因子8(IRF8)和核因子-κB转录途径促进促炎极化,而在脂肪细胞中,Notch1信号抑制白色脂肪组织褐变和能量消耗并促进胰岛素抵抗。Notch1是炎症过程中的关键信号分子,可诱导许多促炎细胞因子产生[17-18]。阻断Notch1信号传导可部分减轻由DNCB诱导Th1过敏反应,此外研究证明Notch1下调可导致Th2细胞因子在DNCB诱导的小鼠模型中表达下降。TGF-β1是Notch的下游细胞因子,TGF-β1的激活已被证明在炎症中起关键作用,其通过调节各种炎症介质包括细胞因子,趋化因子和黏附分子表达。过量的TGF-β1可以通过整合TLR家族成员及其相关途径的活性来增强细胞因子的产生。TLR家族蛋白是一类在先天免疫系统中起关键作用的蛋白质[19-20]。TLR4是TLR家族的成员,其在湿疹的炎症反应中起重要作用。本次研究结果显示,与对照组比较,模型组湿疹皮肤组织Notch1、TGF-β1 mRNA、蛋白明显升高;与模型组比较,地塞米松组、苦参软膏组湿疹皮肤组织Notch1、TGF-β1 mRNA、蛋白明显降低;地塞米松组、苦参软膏组湿疹皮肤组织Notch1、TGF-β1 mRNA、蛋白水平相近。以上结果说明,苦参软膏能抑制Notch1、TGF-β1 mRNA、蛋白的表达进而抑制小鼠湿疹模型皮肤炎症反应。
本研究同时也发现,模型组湿疹皮肤组织IL-2、IL-6、TNF-α水平明显升高;与模型组比较,地塞米松组、苦参软膏组湿疹皮肤组织IL-2、IL-6、TNF-α水平明显降低;地塞米松组、苦参软膏组湿疹皮肤组织IL-2、IL-6、TNF-α 水平相近。而 L-2、IL-6、TNF-α 是Notch1信号通路的下游细胞因子,这也提示,苦参软膏能抑制Notch1、TGF-β1 mRNA、蛋白的表达进而抑制小鼠湿疹模型皮肤炎症反应,其机制与抑制IL-2、IL-6、TNF-α的表达有关。
综上所述,苦参软膏能抑制小鼠湿疹模型皮肤炎症反应,其机制与苦参软膏抑制Notch1、TGF-β1 mRNA、蛋白的表达进而抑制IL-2、IL-6、TNF-α的表达有关。

