单碘乙酸诱导SD大鼠膝骨性关节炎模型在不同时间点与疾病进程的评价
肖昆林, 张 蕊, 孙 红, 肖昆太, 马建兵
(1. 广州市花都区人民医院, 广州 510800;2. 西安交通大学附属红会医院, 西安 710054;3. 厦门大学医学院, 厦门 361000)
骨性关节炎(osteoarthritis, OA)是一种可导致患者出现严重残疾的退行性关节疾病,以关节软骨进行性破坏为主要特点,膝关节最常受累[1]。OA动物模型的建立是研究OA发病机制与治疗方法的前提[2]。目前,OA动物模型建立的方法主要有外科手术、关节腔内注射药物和自发性OA 3种[3]。外科手术构建OA模型的方法与临床OA较为接近,但同时存在着创伤大、造模时间长等缺点。自发性OA模型与临床OA最为相似,但其造模时间过长也不适合大力推广。关节腔内注射药物的建模方法所需时间较短,在疾病的研究中应用广泛。常见的注射药物有Ⅱ型胶原酶和碘乙酸盐,碘乙酸盐诱导的大鼠OA模型表现为关节软骨破坏,软骨下骨损伤,以及炎症和关节疼痛等[4]。关节腔注射不同剂量单碘乙酸(MIA)及在不同的时间点, SD大鼠均呈现出OA病变, MIA注射的剂量1~10 mg/kg不等, 注射的时间1~8周不等[5,6]。然而目前为止, 尚无研究报道将OA疾病的进程和关节腔注射MIA的剂量和时间相联系。本研究通过关节腔内注射中等剂量的MIA, 诱导膝OA大鼠模型,分别于注射MIA后1周、2周和4周处死大鼠进行观察、检测和关节软骨组织病理学(OOCHAS)评分,并与临床OA的发病进程相联系,为后期OA发病和治疗机制奠定基础。
1 材料与方法
1.1 实验动物
SPF级2月龄雄性SD大鼠24只,体质量(210±18) g,2月龄购自西安交通大学医学部动物实验中心[SCXK(陕)-2018-001]。动物实验在西安市红会医院转化医学中心进行,[SYXK(陕)2015-002]动物实验通过西安市红会医院伦理委员会审查通过(编号IACUC2017-0819)。
1.2 实验试剂及主要仪器设备
MIA、戊巴比妥均购自美国Sigma公司;微量注射器购自上海高鸽公司;乙二胺四乙酸(EDTA)购自科昊生物公司;质量分数4%多聚甲醛溶液购自Boster公司;OCT购自Tissue-Tek公司;HE染色试剂盒、甲苯胺蓝染色试剂盒均购自Solarbio公司,冰冻切片机、解剖显微镜均购自Leica公司等。
1.3 膝骨性关节炎动物模型的建立
将SD大鼠随机分成2组,即模型组(18只)和对照组(6只)。2组大鼠均用3%的戊巴比妥钠1 mL/kg腹腔注射麻醉后,取右膝关节备皮,模型组大鼠右膝关节腔内注射溶于50 μL生理盐水的2 mg MIA,对照组大鼠右膝关节腔内注射等量的生理盐水, 随后将大鼠放回笼内饲养(每笼3只),自由饮食。
1.4 形态学观察及膝关节OOCHAS大体评分
关节腔内注射1周、2周和4周后,模型组大鼠采用空气栓塞法处死每组各6只大鼠,对照组采用同样的方法处死每组各2只大鼠,解剖取膝关节股骨髁和胫骨平台软骨组织,置于解剖显微镜下观察并拍照。根据关节色泽、平滑度、关节液性状以及关节面的磨损情况进行膝关节OOCHAS大体评分,本研究采用双盲法进行评分。0分:关节面形态正常;1分:关节面具有轻微的纤维化(磨损、龟裂或剥落)或关节面轻微黄染;2分:关节软骨缺损累计软骨浅层和中层;3分:关节面缺损达软骨深层;4分:关节面缺损累计软骨全层,乃至软骨下骨。
1.5 标本处理及切片制作
将关节标本置于质量分数4%的多聚甲醛溶液中固定,72 h后取出,置于质量分数12.5% 的EDTA溶液中脱钙2周,随后放入30%的高糖溶液进行沉糖,48h后取出,用冰冻切片包埋剂(OCT)进行包埋,于冰冻切片机中制作7 μm厚冰冻切片,并放于-20℃冰箱保存。
1.6 组织学染色及OOCHAS组织学评分
将组织切片分别进行伊红-苏木素(HE)及甲苯胺蓝染色,并在光学显微镜下对染色结果进行拍照。根据关节软骨结构、蛋白多糖含量、软骨细胞聚集及数量、潮线完整度等方面,采用双盲法进行OOCHAS组织学评分,累计0~12分为轻中度症状,13~24分为重度症状。
1.7 统计学分析
2 结果
2.1 膝关节面形态学观察
图1结果显示,对照组大鼠膝关节软骨面光滑,外观呈淡紫色,软骨面无充血、裂纹等。模型组大鼠造模1周后关节软骨面略微粗糙,有小的裂隙且色泽灰暗;造模2周后关节软骨面粗糙,光泽度消失,软骨缺损深达软骨中下层;造模4周后软骨缺损累及软骨全层,并深达软骨下骨,股骨髁和胫骨平台软骨剥脱。
2.2 膝关节软骨组织OOCHAS大体评分
对照组大鼠OOCHAS大体评分为0,造模1周和2周大鼠表现为关节软骨的轻度损伤,4周表现为轻重度。单因素方差分析结果显示, 造模后3个时间点大体评分分值差异具有统计学意义(图2)。两组间多重比较结果显示,造模2周和4周相对于1周,4周相对于2周,分值均显著提高,其中4周相对于1周,差异最显著。
2.3 膝关节组织学染色结果
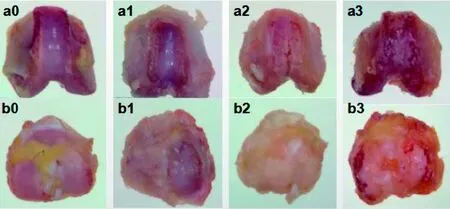
图 1 大鼠膝关节组织形态学观察Figure 1 Morphological observation of rat knee joint
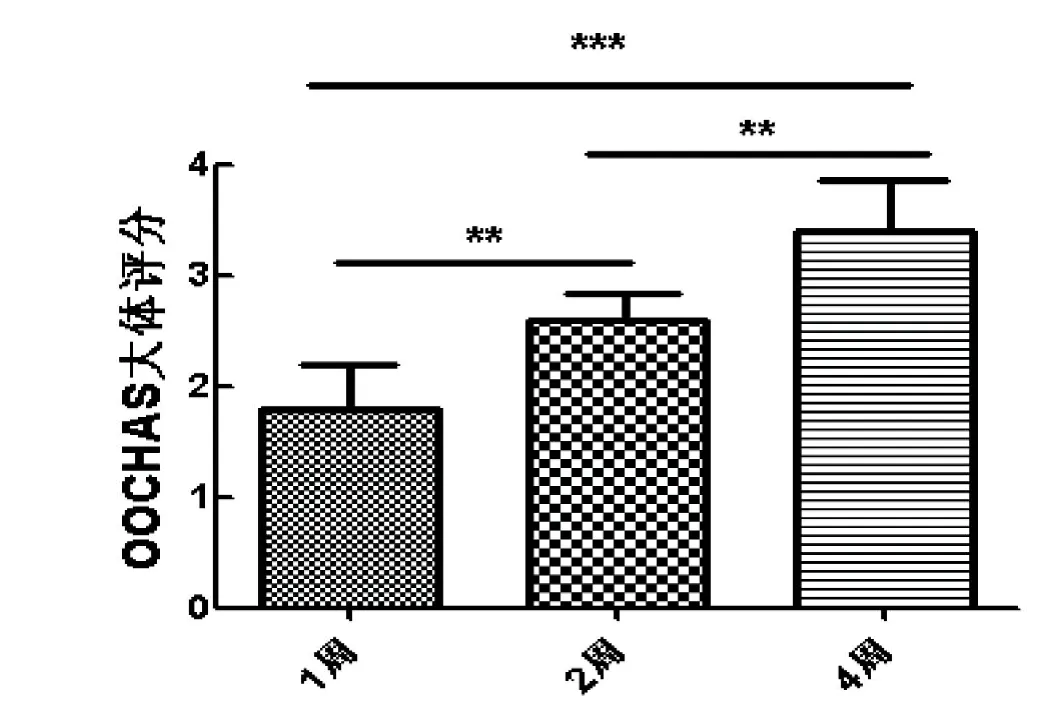
图 2 大鼠膝关节软骨组织OOCHAS大体评分Figure 2 Rat knee joint OOCHAS gross score
对照组大鼠(图3a、图4a)软骨表层无裂隙,表层细胞呈梭形,近似水平排列;中间层细胞为圆形,散在分布;深层细胞呈柱状排列;潮线清晰;钙化层细胞较大,呈散在分布,软骨基质着色基本均匀。造模1周后见大鼠软骨面出现小的裂隙,软骨细胞数量轻度减少,潮线模糊,甲苯胺蓝染色轻度变淡(图3b、图4b)。造模2周后大鼠关节软骨组织破坏明显,软骨细胞数目明显减少,潮线消失,甲苯胺蓝染色明显变淡(图3c、图4c)。造模4周后大鼠关节面缺损深达软骨下骨,潮线周围有新生血管出现,甲苯胺蓝染色显著变淡(图3d、图4d)。
2.4 OOCHAS组织学评分结果
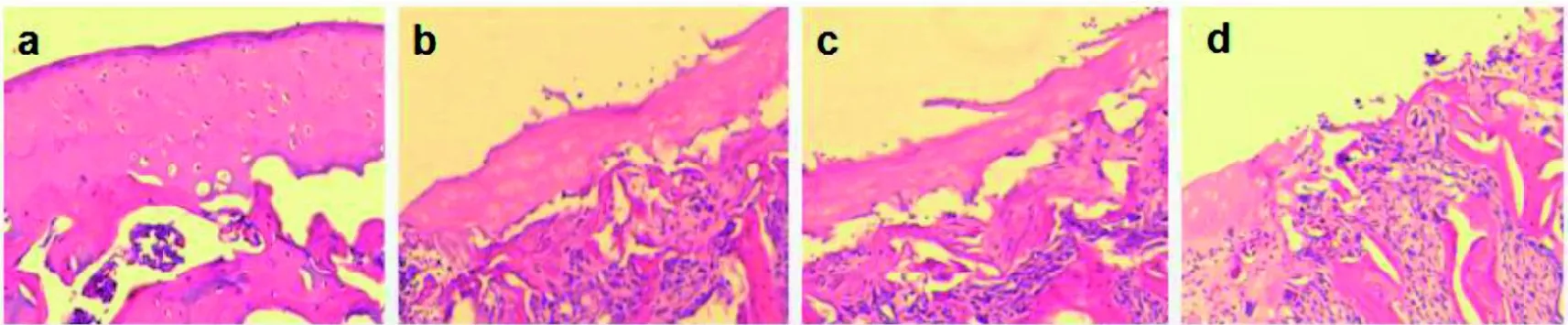
图 3 大鼠膝关节组织 HE 染色结果Figure 3 Representative histological images of HE staining after MIA intraarticular injection
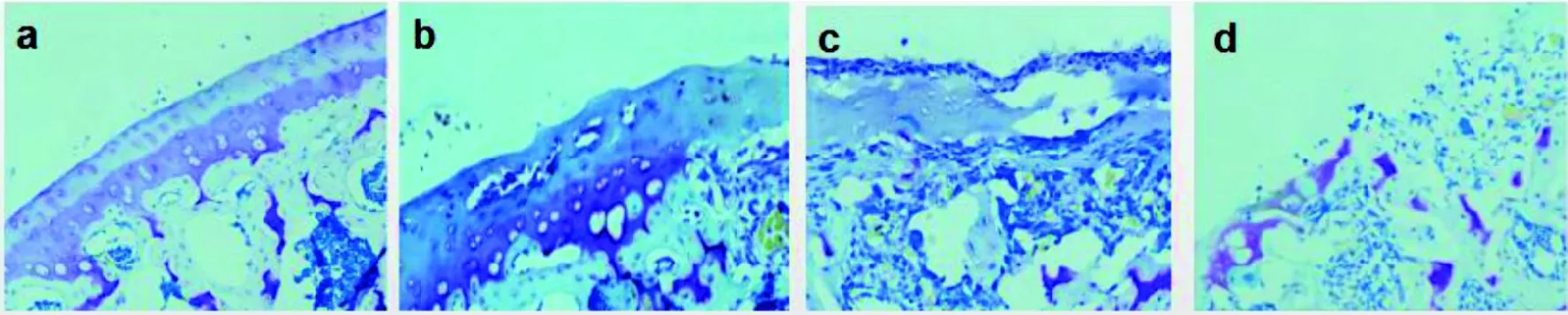
图 4 大鼠膝关节组织甲苯胺蓝染色结果Figure 4 Representative histological images of toluidine blue staining after MIA intraarticular injection
对照组大鼠OOCHAS组织学评分为0,模型组大鼠1周和2周表现为轻中度OA,4周后表为轻重度。单因素方差分析结果显示,造模后3个时间点大鼠OOCHAS组织学评分分值差异具有统计学意义。两组间多重比较结果显示, 造模2周和4周相对于1周,4周相对于2周,分值均显著性提高,其中4周相对于1周,差异最显著,与OOCHAS大体评分结果一致。

图 5 造模后大鼠膝关节OOCHAS组织学评分Figure 5 The result of OOCHAS histological score of rat model after MIA intraarticular injection
3 讨论
本研究通过关节腔内注射MIA的方法诱导OA大鼠模型, 结果显示造模1周和2周后, 大鼠活动量逐渐减少, 关节软骨面出现了大小不一的缺损,股骨和胫骨平台软骨变薄, OOCHAS大体评分和组织学评分显示轻中度OA症状,与临床OA早中期软骨退变的表现相似; 造模4周后,大鼠活动量明显减少,并逐渐出现跛行,关节软骨面破坏加重, 呈糜烂状, 软骨缺损深达软骨下骨层, OOCHAS大体评分和组织学评分显示轻重度OA症状,与临床晚期的软骨退行性变的表现较为接近。
在以往的研究[7]报道中, 软骨的病理损伤被作为评估OA各项指标的“金标准”。Morais等[8]通过关节腔内注射MIA的方法建立OA大鼠模型,发现该OA模型表现出软骨细胞的变性和凋亡,即出现了软骨损伤,最终膝关节间隙变窄,疼痛加重,与人的骨关节炎症状相似。进一步证实了关节腔内注射MIA建立OA大鼠模型是一个良好的方法,可以在相关研究中推广使用。
OOCHAS评分体系由国际骨关节炎学会(OARSI)在1998年根据不同种类动物的OA软骨组织退变特征和病理学特点所构建,是一套专门用于OA的评分体系,该评分系统从关节软骨整体结构、蛋白多糖含量、软骨细胞特性、潮线完整度、骨赘形成等五个方面分不同等级对软骨损伤的程度进行评分,能够实现对OA各个时期的病理损伤进行评价[9]。本研究对膝关节软骨从宏观形态学观察,组织学染色,OOCHAS评分系统采用双盲法进行评分,发现MIA诱导的膝OA大鼠模型,随着时间的延长,膝关节软骨呈进行性退变,软骨细胞外基质蛋白聚糖成分含量逐渐降低,类似于临床膝OA的发病进程。
关节软骨细胞是关节软骨中唯一的细胞类型,通过合成和分解细胞外基质维持软骨细胞外环境的稳定[10,11]。细胞外基质成分主要包括II型胶原和蛋白多糖[12]。Roberto等[5]通过向大鼠胫股关节腔内注射MIA,发现MIA对软骨细胞中甘油醛-3磷酸脱氢酶的活性具有抑制作用,导致糖酵解中断,细胞外基质蛋白聚糖合成的数量和质量下降,从而引起软骨细胞凋亡。软骨细胞的逐渐减少导致关节软骨的组织学和形态学特征改变,最终产生与人OA症状相似的变化[13,14]。另外,用关节腔注射MIA的方法诱导OA动物模型,还具有创伤小、时间短、可重复性强以及相对容易操作等优点,已被应用于许多动物实验[15-17]。虽然MIA诱导OA大鼠模型的方法已被广泛应用,但也存在着一些不足之处,它没有在多个时间点与人OA的发病进程相联系和比较,而本文恰恰弥补了这个不足。
综上所述,本研究通过关节腔内注射单碘乙酸成功诱导了膝OA模型,并将不同时间点的结果与临床疾病进程相联系,为后期功能和机制研究奠定了基础。

