绒毛蛋白1在单侧肾切除Habu肾炎小鼠模型中的作用
蒋红利, 马红叶, 薛瑾虹, 孙凌霜, 陈 蕾
(西安交通大学第一附属医院血液净化科, 西安 710061)
系膜增生性肾小球肾炎(mesangial proliferative glomerulonephritis,MesGN)是中国最常见的肾小球肾炎类型,也是引发终末期肾病的主要病因。MesGN以系膜细胞增殖伴系膜基质扩张为特征,其发生机制被认为与细胞增殖、凋亡和免疫失衡有关。竹叶青蛇毒(Habu snake venom,HSV)诱导的小鼠Habu肾小球肾炎是与人MesGN肾小球病变相似的经典实验动物模型[1-3]。研究[4]显示,单次注射HSV诱导的肾小球改变可在1个月后自愈,然而, 单侧肾切除术(unilateral nephrectomy,UNX)后再行注射抗HSV,将导致更严重的肾损伤和不可逆的肾小球硬化。上述现象表明,UNX可加剧Habu肾炎模型肾功能不全表现,但其机制尚不清楚。
绒毛蛋白1(villin-1, VIL1)是一种细胞骨架蛋白, 广泛存在于哺乳动物中, 具有调节微绒毛肌动蛋白丝重组的作用,参与肌动蛋白成核、肌动蛋白丝束组装、肌动蛋白丝封盖和切断等过程[5], 故而在调节细胞形态、细胞侵袭、细胞迁移和细胞凋亡中发挥重要作用。在肾脏疾病中,VIL1与急性肾损伤密切相关,可作为急性肾小管损伤的新型生物标志物,但其在肾小球肾炎系膜细胞受损过程中的作用及机制尚不清楚。
本研究分别于正常C57BL/6小鼠和UNX的C57BL/6小鼠中建立了HSV诱导的Habu肾炎模型,比较二者在肾功能、细胞增殖及凋亡水平的异同,并采用蛋白质组学方法筛选出在二者中差异表达的VIL1蛋白,探索VIL1在UNX后肾小球肾炎中的作用和相关机制,为进一步阐明此类疾病的发病机制提供新的视角。
1 材料与方法
1.1 动物和细胞
SPF级6周龄雄性C57BL/6小鼠24只,体质量18~20 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0011]),并饲养于西安交通大学医学院实验动物中心[SYXK(陕)2015-002],温度24℃,湿度40%~70%,12 h光照12 h黑暗交替,自由摄取食物和水。动物福利和实验程序严格按照《实验室动物护理和使用指南》(美国国家研究委员会,1996年)执行。
小鼠系膜细胞(MMCs)系SV40 MES 13细胞(ATCC®CRL-1927TM)购自美国ATCC公司。
1.2 主要试剂
HSV购自日本Wako Pure Chemical Industries公司,5%胎牛血清(货号:26140)、ClickiT®EdU Alexa Fluor®555成像试剂盒(货号:C10638)、Hoechst 33342试剂(货号:3570)和Thermo BCA试剂盒(货号:23235)购自美国Invitrogen公司,RPMI 1640培养基(货号: 10-040-CVR-500 mL)购自美国康宁公司,VIL1抗体(货号:16488-1-AP)购自美国Proteintech公司,caspase 3抗体(货号:ab90437)及p21抗体(货号:ab86696)购自英国Abcam公司,Bax抗体(货号:2772S)及 p27 抗体(货号: 2552S)购自美国Cell Signaling Technology公司,β-actin抗体(货号: SAB1305546)购自美国Sigma-Aldrich公司; 辣根过氧化物酶标记山羊抗兔抗体(货号:A0208)、辣根过氧化物酶标记山羊抗小鼠抗体(货号:A0216)购自武汉碧云天生物技术公司; siRNA序列由上海吉玛公司设计合成。
1.3 主要仪器
液相串联质谱分析仪(XEVO QTOF)购自英国Waters 公司;正置光学显微镜(BX43)购自日本奥林巴斯公司,荧光倒置显微镜(TI-E)购自日本尼康公司;UVP凝胶成像系统(EC3-410)购于美国UVP公司。
1.4 实验方法
1.4.1 HSV肾炎模型的建立 将24只小鼠随机分为2组。实验组(n=12)接受UNX:质量分数1%戊巴比妥钠溶液(80 mg/kg)腹腔注射麻醉,麻醉满意后常规备皮、消毒、铺无菌巾,小鼠左侧卧位, 行背部右侧切口, 位置为脊柱右旁开0.5 cm,肋弓下缘起始,长约1 cm竖行切口,暴露右肾,钝性分离肾蒂,1号线结扎肾蒂,从结扎处远端离断肾血管及输尿管, 摘除右肾, 逐层缝合肌层、皮肤。对照组(n=12)仅接受假手术(即背部右侧纵行切口切开缝合术, 不行右肾摘除)。一周后, 上述2组小鼠通过尾静脉注射HSV (2.5 mg/kg)诱导Habu模型(分别标记为HSV组及HSV-UNX组)。2组小鼠均于HSV注射后7 d以 1%戊巴比妥钠溶液(80 mg/kg)腹腔注射麻醉,采用心脏取血法采集血液标本用于生化检测;行腹正中切口,取小鼠肾皮质组织,其中一半固定于体积分数10%甲醛溶液中,用于病理学和免疫组织化学检测;另一半肾皮质组织采用筛网技术分离肾小球并置于液氮保存, 用于后续蛋白组学和Western blotting检测; 取材结束后, 以颈椎脱臼法对小鼠实施安死术。
1.4.2 过碘酸-雪夫染色(PAS染色)观察小鼠肾组织病理改变 将固定于体积分数10%甲醛溶液的肾脏组织常规脱水、石蜡包埋、制片。切片常规脱蜡后,放入1%过碘酸浸泡15 min,Schiff液浸泡20 min,苏木素浸泡3 min染细胞核;1%盐酸乙醇分化数秒,水洗后氨水返蓝,流水充分冲洗;85%、95%、100%乙醇梯度脱水、二甲苯透明,树脂封固;于光学显微镜(×400)下观察肾组织病理改变。
1.4.3 肾组织蛋白组学检测 从HSV组及HSVUNX组分别取6只小鼠的肾组织用于蛋白组学检测。首先, 对肾小球蛋白行二维凝胶电泳分析: 用裂解缓冲液分离肾小球蛋白,采用50 mmol/L NaOH将蛋白pH值调整为8.5,用裂解液将质量浓度调整为5 mg/mL。将2组样品中等量的蛋白质汇集在一起作为内参。每个样品取50 μg蛋白质置于冰上, 采用400 pmol Cy3、Cy5分别标记HSV组及HSV-UNX组蛋白, 用400 pmol Cy2标记内参, 共30 min, 后加入1 μL赖氨酸(10 mmol/L)淬灭。将50 μg 已标记Cy3及Cy5的蛋白混合后,再与50 μg标记Cy2的蛋白混合,再加入2倍体积的缓冲液, 将加入缓冲液后的样本置于23 cm、pH3, 11 (NL) IPG上, 采用IPGphor IEF系统进行等电聚焦。等电聚焦设置为: 30 V共12 h, Grd 200 V共6 h,Grd 500 V共3 h,Grd 10000 V共1 h,64 000 V 共1h。将IPG条带置于12%均质聚丙烯酰胺凝胶的顶部,将0.9%琼脂糖包覆于含溴酚蓝流动缓冲液中,置于15 ℃的Ettan DALT 6电泳系统中电泳过夜。电泳结束后,用Typhoon 9400成像仪扫描二维凝胶。根据说明书, 使用DeCyder 6.0软件(GE Healthcare)对二维凝胶上的蛋白斑点进行分析, 确定2组间存在显著变化的斑点。其次, 对2组间存在显著变化的斑点进行蛋白鉴定: 对具有显著变化蛋白斑点切胶回收并脱色后, 置于10 mmol/L二硫苏糖醇中56 ℃孵育1 h,在55 mmol /L IAM中室温避光45 min。采用离心冻干法冻干凝胶,并用0.05 mg/mL胰蛋白酶过夜消化, 以2%三氟乙酸停止反应。采用二维液相串联质谱分析仪对多肽进行分析。在第一维度使用溶剂A(200 mmol甲酸铵, pH值10.0)和溶剂B (CH3CN),采用Masslynx 4.1自动设置的3个溶剂塞,依次洗脱馏分。在第二个维度,使用nanoACQUITY系统进行肽筛选。程序和数据步骤与先前研究[6]相似。对于得到的数据使用自归一化函数进行归一化,使用NCBI数据库(2012年3月发布)作为参考数据库, 仅保留高置信度蛋白(OK=2)作进一步分析。采用PLGS 2.4进行统计分析, 差异表达蛋白(differentially expressed proteins, DEPs)定义为: P<0.05且Fold Change>1.5。
1.2.4 MMCs培养及siRNA转染 MMCs 置于含5%胎牛血清(购自美国Invitrogen公司)的RPMI 1640培养基中, 在37 ℃,5% CO2恒温细胞孵育箱中培养。稳定培养MMCs,待细胞汇合度超过70%时, 使用0.25% 胰酶消化, 常温1 300 r/min离心5min,弃上清,加入新鲜培养基重悬细胞,细胞计数; 以每孔4×105细胞数接种入6孔板中;将6 μL siRNA(si-VIL1或NC)加入250 μL Opptimedium(每孔), 充分混匀后室温静置5 min,再加入6 μL RNAi Max (每孔),振荡混匀,室温静置15 min后将含siRNA的转染混合液垂直缓慢滴入六孔板中,37 ℃孵育24 h后,更换新鲜培养液,再培养48h收集细胞,待后续检测。
1.2.5 Hoechst染色检测细胞凋亡 将洁净盖玻片置于体积分数70%乙醇溶液中浸泡10 min,取出后放于无菌超净台内吹干, 用细胞培养液洗涤3次后,将盖玻片置于6孔板内,接种MMCs后培养并按照1.2.4中的步骤转染siRNA。转染48 h后,吸尽培养液,加入0.5 mL固定液固定10 min。吸取固定液后每孔加入2 mL PBS,置于摇床上漂洗3 min,共漂洗2次。吸尽PBS后,加入10 μg/mL Hoechst 33342试剂,于37 ℃避光孵育10 min。孵育结束后, 用PBS洗2次,每次3 min。加一滴抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片。在200倍荧光显微镜下,每孔随机选取5个视野,观察细胞核浓缩细胞。通过计算细胞核浓缩细胞占细胞总数的百分比,明确细胞凋亡的程度。
1.2.6 5-乙炔基-2’脱氧尿嘧啶核苷(EdU)染色检测细胞增殖 使用ClickiT®EdU Alexa Fluor®555成像试剂盒对转染48 h的MMCs进行EdU检测,所有步骤严格遵循说明书进行。染色后,EdU阳性细胞的细胞核为红色,在200倍荧光显微镜下,每孔随机选取5个视野,观察并计数EdU阳性细胞及总细胞数。通过计算EdU阳性细胞占细胞总数的百分比,明确细胞增殖程度。
1.2.7 Western blotting检测蛋白表达量 向收集的肾组织/细胞加入裂解液,提取总蛋白,根据Thermo BCA试剂操作手册测定蛋白浓度;根据测定结果加入相应体积的2×SDS Sample Buffer与蛋白质样品混匀,水浴锅95 ℃孵育10 min变性; 利用聚丙稀酰胺凝胶行蛋白电泳,半干法转膜; 以1∶500的比例稀释VIL1抗体, 1∶1 000稀释caspase 3、p21、Bax、p27和β-actin抗体;将相应硝酸纤维素膜条带置于稀释好的抗体中4 ℃过夜孵育;采用TBST室温漂洗膜条带8 min(共3次)后, 将其放入相应种属来源的二抗(1∶1 000)中,室温孵育1 h;孵育后再次使用TBST室温漂洗8 min×3次;混合足量等体积显色试剂(A和B),将膜放于玻璃皿中,向其均匀滴加显色剂,利用UVP成像系统显色成像。
1.2.8 统计学分析 应用SPSS 20.0软件进行统计学分析, 计量资料以x-± s表示, 先进行方差齐性检验, 方差齐者2组间数据比较采用t检验,P<0.05为差异有统计学意义。使用GraphPad Prism 6.0软件生成图表。
2 结果
2.1 小鼠肾功能水平比较
HSV-UNX小鼠组血清肌酐水平(16.18±0.87 μmol/L)显著高于HSV组(52.92±10.74 μmol/L)(P=0.0067); HSV-UNX组小鼠血清尿素氮水平(16.07±0.80 mmol/L)也显著高于HSV组(26.40±2.32 mmol/L)(P=0.0018)。
2.2 小鼠肾脏病理表现比较
在HSV组小鼠肾脏中,可见弥漫性系膜增殖和细胞外基质积累,无明显系膜溶解现象;在HSV-UNX组模型中,均可观察到明显的系膜溶解现象, 且其增殖表现主要为局部细胞增殖(图1)。进一步的半定量分析显示,HSV-UNX组系膜溶解指数(0.100±0.013)与HSV组(0.455±0.025)比较差异显著(P<0.01),系膜增殖指数(1.550±0.054)与HSV组(0.822±0.041)比较差异也显著(P<0.01)。上述结果提示,持续的系膜溶解和系膜增殖修复能力减弱可能影响HSV-UNX组小鼠肾小球结构修复,引起肾功能恶化。
2.3 小鼠肾小球中VIL1表达存在差异
与HSV组相比,HSV-UNX组共有413个蛋白表达下调,92个蛋白表达上调(部分差异蛋白相对表达量见表1),表达下调蛋白较多。在表达下调蛋白中,VIL1为细胞内重要的骨架蛋白,可能参与调节细胞增殖、凋亡过程,故进一步使用Western blotting验证其肾小球蛋白表达量,结果表明,在HSV-UNX模型中,VIL1表达较HSV组显著下调(图2)。
2.4 MMCs中敲低VIL1对细胞增殖及凋亡水平的影响
结果显示,转染48 h后,与NC组(对照组)相比,siVIL1组细胞总数显著减少(图3A)。Hoechst染色结果提示,与NC组相比,siVIL1组细胞凋亡水平明显增高(图3B); EdU试验表明,siVIL1组细胞增殖水平显著低于NC组(图3C)。上述结果表明,敲低MMCs中VIL1的表达,可在促进细胞凋亡的同时降低细胞增殖能力。
2.5 MMCs中敲低VIL1对 caspase 3、Bax、 p21及 p27表达的作用
VIL1低表达可引起caspase 3、Bax、p21及p27蛋白表达水平显著上调(图4)。由于 caspase 3、Bax为经典的促凋亡因子, p21及 p27为细胞抑制因子, VIL1可能通过对上述蛋白的调控影响细胞增殖及凋亡能力,更详细的机制仍需进一步研究。

图 1 HSV组与HSV-UNX组小鼠肾组织PAS染色结果(400×)Figure 1 Periodinate-schiff staining of kidney in HSV group and HSV-UNX group

表 1 蛋白组学鉴定出的部分差异表达蛋白

图 2 HSV组与HSV-UNX组肾小球组织VIL1蛋白表达水平检测Figure 2 The expression level of VIL1 in glomeruli of HSV group and HSV-UNX group detected by Western blotting
3 讨论
本研究通过建立HSV肾炎和HSV-UNX肾炎模型,探讨二者在疾病进展过程中的差异,并借助蛋白质组学方法寻找可能导致其病程差异的重要分子及其作用机制。本研究结果显示,与HSV模型相比,HSV-UNX模型肾损伤更严重,血清肌酐和血尿素氮水平更高; 同时发现, 在HSV-UNX模型中,系膜溶解程度较HSV模型重,而系膜细胞增殖水平较后者轻。上述病理差异可能在HSV-UNX模型中起到加剧肾功能损伤的作用。
众所周知, 在系膜增生性肾炎中, 细胞增殖和凋亡的失衡是导致其病理进展的重要原因[1,7,8]。本研究在HSV模型中发现系膜增殖引起肾小球结构重构, 促进了系膜溶解损伤修复。但在HSV-UNX模型中,系膜细胞增殖能力低于HSV模型,但凋亡水平升高,抑制了系膜溶解的修复,导致局部损伤加重。上述结果表明,在HSV-UNX模型中,系膜溶解修复异常是加重其肾功能损害的重要原因。在临床中,由于各种生理和病理性原因(如先天性“孤独肾”、肾移植供体、肾肿瘤单侧肾切除术、单侧尿路梗阻伴肾功能不全等), 许多患者一侧肾脏缺如或失去功能, 仅保留单侧健康肾脏。在正常情况下, 孤独肾个体(包括人和动物)的存余侧肾脏几乎无病理性改变[9,10]; 然而, 暴露于有害刺激后, 此类个体罹患肾小球疾病的风险和患病严重程度显著增加[11,12]。本研究中, UNX加重Habu肾炎肾功损伤的现象和病理机制为孤独肾患者更易罹患肾小球肾炎的学说增添了新的证据, 为其发生发展的机制提供了新的视角。

图 3 VIL1敲低对MMCs增殖凋亡水平的作用Figure 3 The effect of VIL1 knockdown on the proliferation and apoptosis levels in MMCs
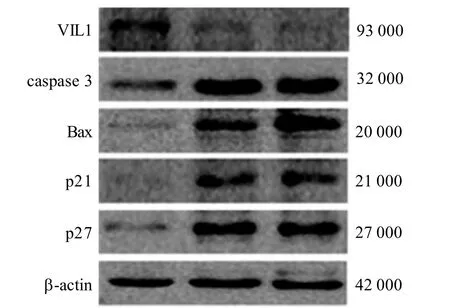
图 4 VIL1敲低对小鼠MMCs中 caspase 3、Bax、 p21及p27蛋白表达的作用Figure 4 The effects of VIL1 knockdown on expressions of caspase 3, Bax, p21 and p27 in MMCs
为进一步明确HSV-UNX模型中系膜溶解修复异常的分子机制,本研究利用蛋白组学方法分析了2个不同模型在蛋白表达方面的差异,筛选出具有显著表达差异的蛋白。通过信号通路富集分析,本研究证实2组间差异蛋白主要与细胞增殖和凋亡机制密切相关。如前所述,在肾小球肾炎中, 细胞增殖与凋亡是影响系膜增殖与溶解的关键调节因素, 结合2组模型的病理表现差异, 本研究进一步表明, 细胞增殖与凋亡异常是HSV-UNX模型损伤后修复不良及肾功恶化的主要分子机制。此外,本研究还发现,与HSV组相比,VIL1蛋白表达量在HSV-UNX组明显降低。VIL1是一种细胞骨架蛋白,既往研究表明,VIL1以钙依赖的方式与肌动蛋白结合[13], 在调节肌动蛋白动力学、维持细胞形态、抗细胞凋亡、细胞增殖和细胞迁移调节和上皮-间质转化等方面具有重要作用,并可通过上述作用参与肝癌、宫颈癌、结肠癌等疾病的发生发展[14-17]。Decuypere等[18]研究显示,VIL1与肾小管细胞死亡密切相关,是急性肾损伤的新型预测因子,但尚未有VIL1在肾小球疾患中作用及机制的研究。本研究则证实,在系膜细胞中, 敲除VIL1可增加p21、p27、Bax和caspase 3的表达, 抑制细胞增殖, 促进细胞凋亡。众所周知, p21和p27是细胞周期的负调控因子[19],二者可与周期蛋白依赖性激酶(cyclin-dependent kinases, CDKs)家族中CDK2/4/6结合并发挥抑制作用,从而使细胞周期阻滞于G1期,抑制细胞增殖。此外,Bax和p21可通过激活caspase 3诱导线粒体相关细胞凋亡[20]。既往研究显示,VIL1在其headpiece域中有一个F-actin结合位点,可以结合并切断F-actin[13],而VIL1的下调可能通过与F-actin相互作用来调控p21、p27、Bax和caspase 3等蛋白表达[21-22],进而影响p53、ERK和AKT信号通路[23-25]。这些信号通路的异常最终可引发系膜细胞增殖和凋亡失衡。因此, VIL1的下调可能通过抑制系膜细胞增殖及促进细胞凋亡,导致系膜溶解修复障碍,最终在UNX术后Habu肾炎模型的肾功能损伤加剧中发挥重要作用。
综上所述,与HSV模型相比,HSV-UNX模型中加剧的系膜溶解和局灶性系膜增生加重了肾功能损害,其中,VIL1在HSV-UNX模型表达下调可能通过抑制细胞增殖和促进细胞凋亡导致肾小球自我修复能力下降,加重肾功能损害。本研究为孤独肾状态下肾小球肾炎进展加剧的学说增添了新的证据,并提出了可能的分子机制,上述结果对于改善肾小球肾炎进展率、防治特殊人群肾小球肾炎具有潜在应用价值。

