O-N-乙酰葡萄糖胺糖基化水平正调控促血管生成素-2表达从而促进小鼠肝癌中肿瘤新生血管形成
王爱红, 王明全, 杜 娟
(1. 延安大学医学院及延安市肿瘤防治研究重点实验室, 延安 716000;2. 延安大学附属医院介入放射科, 延安 716000)
据美国癌症学会在2018年发表的全球癌症统计[1],肝癌在2018年将成为世界上第六大最常见的癌症,也是全球癌症死亡的第四大原因,每年约有841 000例新病例和782 000例死亡。因此,肝癌在全球病例数量排名第五。原发性肝癌包括肝细胞癌(HCC)(含75%~85%的病例)和肝内胆管细胞癌(包括10%~15%的病例)以及其它罕见类型。HCC的主要发病因素与慢性感染乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV),重度酒精摄入、肥胖、吸烟及2型糖尿病等密切相关[2]。
在HCC患者的癌组织中O-N-乙酰葡萄糖胺(O-GlcNAc)糖基化水平表达上调,且其与肿瘤的发生发展以及肝移植后的肿瘤复发密切相关[3,4]。O- GlcNAc糖基化水平的升高与多种代谢异常相关,如糖尿病、肥胖以及肿瘤相关的代谢[5]。O-GlcNAc糖基化是O-GlcNAc单糖修饰,不存在糖链的延伸。O-GlcNAc糖基化也是一种动态的蛋白质修饰过程。O-GlcNAc修饰基团的添加和去除分别是由O-GlcNAc糖基转移酶(O-GlcNAc transferase,OGT)和N-乙酰氨基葡萄糖苷酶(OGlcNAcase,OGA)来完成[6]。肝癌的形成需要充足的血液供应,新血管的形成对肝癌的进展、侵袭和转移至关重要[7],因此,血管生成是肝癌研究和治疗中的一个重要过程。血管生成素包括血管生成素1(angiopoietin-1,Ang-1)和血管生成素2(angiopoietin-2, Ang-2),Ang-1能够促进血管的稳定生成, 而Ang-2则作为Ang-1的竞争拮抗剂发挥作用, 降低血管生成的稳定性[8,9]。有研究表明,Ang-2的表达在肝癌和肝硬化患者中升高[10],并且Ang-2高表达与预后不良显著相关[11]。因此,Ang-2与肝癌的发生发展密切相关。在肝癌的发生发展过程中, O-GlcNAc糖基化水平升高, Ang-2表达水平也明显上升,但二者之间是否有相互促进或抑制的关系尚不明确。因此,本课题组拟初步探讨在肝癌发生发展过程中, O-GlcNAc糖基化水平升高与Ang-2表达上升是否有明确关系。
1 材料与方法
1.1 实验动物
SPF级雄性C57BL/6小鼠,2周龄,购自第三军医大学大坪医院实验动物中心[SCXK(渝)2012-0001]。饲养于第四军医大学实验动物中心SPF动物室,光照-黑暗12 h交替,自由饮水进食,室温维持在20℃左右。
1.2 实验细胞
人肝癌细胞HepG2,购自上海细胞库;人脐静脉内皮细胞(HUVEC),购自协和医院基础医学研究所细胞中心。
1.3 主要试剂、抗体及仪器
二乙基亚硝胺(DEN)购自美国Sigma公司;OGA抑制剂(Thiamet, ThG)购自美国Tim Tec公司;四氧嘧啶(Alloxan) OGT抑制剂购自江苏恒瑞医药公司;Western blotting O-GlcNAc抗体,购自美国Santa Cruz公司;sc-59623和免疫组织化学O-GlcNAc抗体均购自美国Pierce Biotechnology公司; Ang-2抗体(ab155106); CD31抗体(ab28364)购自美国Abcam公司; Transwell小室购自美国Coming-Constar公司。
Mini-protean Tetra System电泳仪, Trans-Blot®SD Cell 转印系统,Imark酶标仪购自Bio-Rad公司。
1.4 实验方法
1.4.1 动物模型建立 肝癌小鼠模型的构建及样品采集: 小鼠适应性喂养3 d后,将小鼠随机分为正常对照组与模型组,每组20只。于实验第1日,模型组小鼠腹腔注射给予二乙基亚硝胺(DEN)溶液,给药剂量为20 mg/kg,对照组小鼠给予等体积生理盐水。实验第5周,模型组小鼠的饮水中添加浓度为10 mg/L的DEN溶液,至实验第9周改为正常饮水。对照组小鼠在实验过程中正常饮水[12]。每2 d监测一次体质量和观察精神状态。于实验11个月时处死各组小鼠,质量分数4%多聚甲醛溶液固定部分肝脏组织或肝癌组织用于病理观察,剩余肝脏组织保存于-80℃备用。
1.4.2 免疫组织化学分析肝癌模型小鼠中Ang-2、O-GlcNAc糖基化及CD31的表达水平 将组织切片置于室温30 min后, 4 ℃丙酮溶液中固定10 min,PBS洗涤2次(每次洗涤5 min)。然后,内源性过氧化物过氧化氢(H2O2) 孵育10 min,37 ℃下正常山羊血清封闭20 min,5% BSA稀释抗体(Ang-2,1∶500;O-GlcNAc,1∶200,CD31,1∶50),4 ℃过夜。第2日,PBS冲洗3次,每次5 min。滴加生物素标记二抗工作液及辣根酶标记链酶卵白素工作液,各37 ℃孵育30 min。最后,滴加DAB显色液显色。自来水冲洗,苏木素复染,封片,用光学显微镜拍片。使用Image Pro Plus软件进行分析。黄色的区域反映靶蛋白的阳性表达。以积分吸光度SUM/Area的比值对Ang-2,O-GlcNAc糖基化的表达进行定量。通过CD31阳性染色确定的血管数量,并在8个视野中计数取微血管密度平均值。
1.4.3 细胞培养和转染 人HUVEC细胞及HepG2细胞用含10%胎牛血清的DMEM培养, 并放置于37 ℃, 5% CO2培养箱中, 并使用5 mmol/L的Alloxan与ThG分别干预HUVEC细胞及HepG2细胞。以不含Alloxan药物或ThG培养基常规培养的HUVEC细胞及HepG2细胞作为各自的对照组。
1.4.4 qRT-PCR和Western blotting检测O-GlcNAc糖基化及Ang-2的mRNA和蛋白水平 qRT-PCR:取手术切除的肝癌组织,采用TRIzol法提取组织总RNA,在37℃,30 min,85℃,5s的条件下进行反转录,获得cDNA,采用 SYBR green实时定量PCR法进行扩增和检测。
Western blotting:将收集的细胞采用全蛋白提取试剂盒提取蛋白,BCA蛋白含量检测试剂盒测蛋白浓度。用10% SDS-PAGE凝胶分离蛋白样品,转移到PVDF膜上,一抗孵育4 ℃过夜(一抗浓度,O-GlcNAc: 1∶500, Ang-2,1∶2000)。二抗在室温下孵育1.5 h(浓度均为1∶2 000),ECL显影后,Bio-RAD仪器扫描,Image Lab进行条带分析,目的蛋白灰度值/GAPDH灰度值为目的蛋白的相对表达量。
1.4.5 MTT法检测O-GlcNAc糖基化水平对HepG2细胞增殖的影响 细胞长满至80%时消化并计数,将每种细胞分别接种200 μL混悬液约3 000个于96孔板,每组细胞做5个复孔,共2块板,分别培养24h,48h。待细胞贴壁后,把配好的OGT抑制剂及OGA抑制剂分别加入到不同的培养孔中,开始对细胞培养时间计时,等到各个时间点依次收板,避光条件下加入MTT试剂20 μL于每孔中,此时设置调零孔,继续放入培养箱中孵育4 h后避光取出,去培养基和MTT试剂混合液,加入DMSO 150 μL于每孔中,置于室温摇床上混匀10 min,用酶标仪490 nm检测吸光度(A)值。
1.4.6 Transwell检测O-GlcNAc糖基化水平对HUVEC细胞迁移侵袭能力的影响 HUVEC细胞消化后,置于0.1% BSA的培养基中,并计数,取1×109/L细胞100 μL加入Transwell小室中的上室,并分别加入5 mmol/L的OGT抑制剂及OGA抑制剂,下室中加入400 μL 0.1%小牛血清培养基,37 ℃,5% CO2条件下培养24 h后,去除上层细胞,下层细胞用95%乙醇溶液固定,并用台盼蓝染色。于镜下计数,以迁移细胞数目表示细胞的迁移能力。
1.5 统计方法
2 结果
2.1 模型小鼠大体表现
在造模过程中,观察到模型组小鼠饮食量减少、行动缓慢、精神萎靡、且体质量明显下降。造模11个月时脱颈处死小鼠, 取肝脏拍照(图1)并称重。对照组小鼠肝脏表面光滑, 色泽暗红且有光泽,而使用DEN干预的模型组小鼠的肝脏体积明显增大,表面粗糙,显示出许多大小不同的肿瘤, 颜色暗淡成淡黄色, 且在大部分肝脏区域可见。模型组小鼠肝脏重量(2.78±1.25 g)约为正常组小鼠(0.92±0.19 g)的3倍(P<0.05)。模型组最终发生肝癌的小鼠有17只,肝癌发生率为85%。
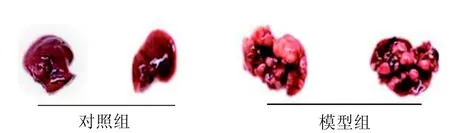
图 1 各组小鼠肝组织形态
2.2 小鼠肝脏病理形态变化及Ang-2,O-GlcNAc糖基化蛋白表达水平
HE染色结果显示,对照组肝细胞排列整齐且有规则,肝细胞大小均匀。而模型组小鼠肝细胞变大,大小不一,有炎细胞浸润,细胞核变大,肝细胞形态结构不清晰且排列紊乱(图2)。免疫组织化学结果显示,与对照组中Ang-2蛋白表达水平(0.15±0.05)和O-GlcNAc蛋白表达水平(0.13±0.05)相比,模型组中Ang-2在细胞质中高表达水平为0.36±0.17, O-GlcNAc在细胞核中高表达水平为0.28±0.14, 组间差异具有统计学意义(P<0.01), 即肝癌模型组中, Ang-2与O-GlcNAc的表达均是上调的。与对照组CD31阳性染色的微血管密度(43±16)相比,模型组CD31阳性染色的微血管密度为107±23,其差异具有统计学意义(P<0.01),表明模型组小鼠肝脏组织中血管数量明显上升。

图 2 小鼠肝癌模型病理变化及免疫组织化学结果 (×400)
2.3 O-GlcNAc糖基化及Ang-2 mRNA表达水平
结果表明,Ang-2表达水平受到O-GlcNAc糖基化表达水平的影响(表1)。
2.4 O-GlcNAc糖基化和Ang-2的蛋白表达水平
如图3所示,使用OGT抑制剂感染HepG2细胞抑制O-GlcNAc的表达后,Ang-2的表达也随之降低;而使用OGA抑制剂感染HepG2细胞使O-GlcNAc高表达后,Ang-2的表达水平也明显上升。以上结果显示,在肝癌细胞中,OGlcNAc可能是Ang-2的上游蛋白,其表达的变化能引起Ang-2的变化。

表 1 两组小鼠OGA、OGT、Ang-2 mRNA相对表达量
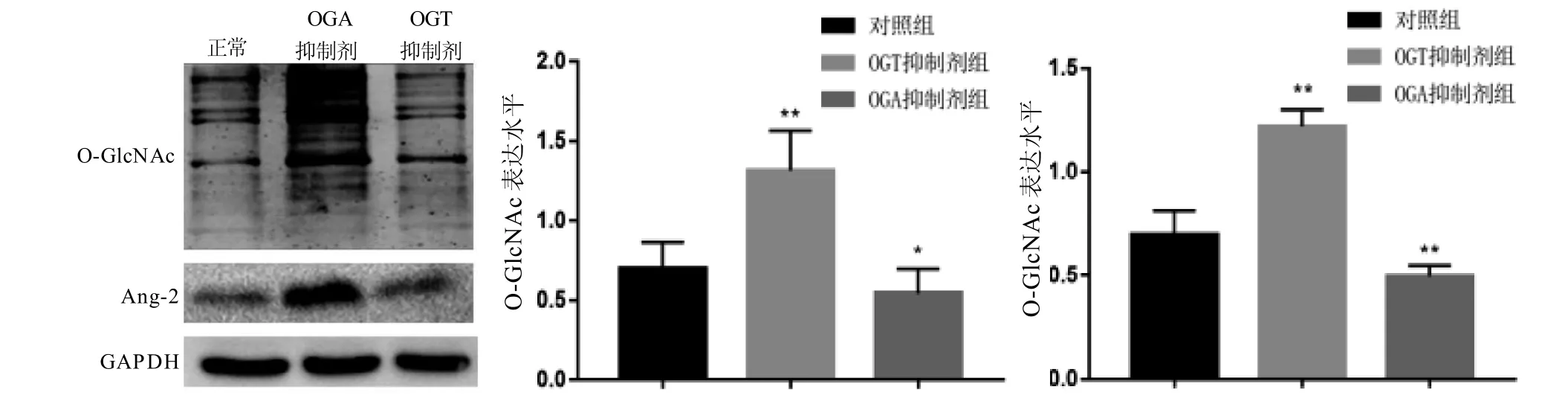
图 3 HepG2细胞分别添加OGT抑制剂及OGA抑制剂后O-GlcNAc及Ang-2蛋白表达
2.5 O-GlcNAc糖基化水平能促进肝癌细胞增殖
在添加OGT抑制剂24 h后,与对照组相比,细胞的增殖能力明显受到抑制(P<0.05)。而添加OGA抑制剂24 h后,肝癌细胞增殖能力有所增加(P<0.05)。48 h时, 添加了OGT抑制剂组较24 h对肝癌细胞增殖抑制效果明显增强(P<0.01),而OGA抑制剂组能够明显提高细胞的增殖能力(P<0.01)(图4)。这些结果说明,O-GlcNAc糖基化水平增高可以促进肝癌细胞的增殖能力。
2.6 O-GlcNAc糖基化水平对HUVEC细胞和HepG2细胞迁移侵袭能力的影响
Transwell结果显示(图5~8),经5 mmol/L的Alloxan干预HUVEC细胞和HepG2细胞24 h后,干预组穿膜细胞数与对照组相比明显减少(P<0.01); 而经5 mmol/L的ThG干预HUVEC细胞和HepG2细胞24 h后,干预组穿膜细胞数较对照组显著增加(P<0.01)。结果说明, HUVEC细胞及HepG2细胞迁移侵袭能力明显受到O-GlcNAc糖基化水平影响,且与O-GlcNAc糖基化水平呈正相关。

图 4 O-GlcNAc表达的变化对肝癌细胞HepG2增殖影响
3 讨论

图 5 三组HUVEC细胞迁移侵袭能力比较

图 6 O-GlcNAc糖基化水平对HUVEC细胞迁移侵袭能力的影响
HCC是多中心、多阶段、多病因以及连续的发展过程[13]。在化学因素诱导肝癌动物模型的实验中,其中以DEN诱发肝癌模型为最常见,DEN是一种化学致癌物质,由细胞色素P450生物活化(CYP)酶存在于肝脏中,导致DNA化合物通过烷基化机制形成。DEN诱发的肝癌体现了类似于人类HCC的基因表达谱[14],其最经典的方法是“饮水法”建立肝癌动物模型。成功建模后的肿瘤特点兼具肝炎、肝硬化的背景,与人类肝癌形成过程十分类似,为肝癌的研究提供了很好的借鉴方法[15]。本文以DEN诱导的小鼠肝癌模型和人肝癌细胞HepG2作为研究对象,研究肝癌中O-GlcNAc糖基化水平与Ang-2的关系。

图 7 三组HepG2细胞迁移侵袭能力比较
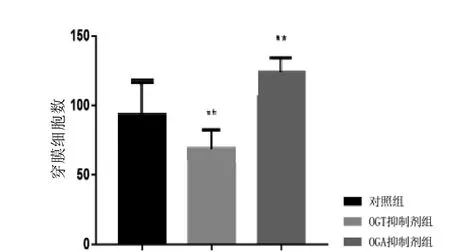
图 8 O-GlcNAc糖基化水平对HepG2细胞迁移侵袭能力的影响
在HCC患者肝癌组织中,蛋白质O-GlcNAc糖基化可促进肝癌细胞的增殖和转移。肝癌患者肝脏移植后, 肝癌复发的组织中蛋白质O-GlcNAc糖基化水平显著高于肝脏移植后肝癌未复发的组织,而肝癌复发的组织中OGA蛋白表达水平显著低于肝癌未复发的组织,OGT的表达水平在肝癌复发和未复发患者之间没有差异。Ang-2参与肝癌发生发展过程,其通过破坏血管的稳定性,增强血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,促使新生血管的生成。Ang-2与肿瘤血管形成的数目以及肿瘤的预后关系密切[16]。有研究[17]表明,Ang-2的表达不仅在肝癌组织上调,且在肝癌患者血清中其浓度也明显上升,以Ang-2作为靶点的药物治疗可明显抑制人肝癌细胞的生长。
在本研究中,我们在DEN诱导的动物模型中观察到,O-GlcNAc糖基化水平与Ang-2在肝癌肿瘤组织中表达均明显上升,且微血管密度也显著上升。通过OGA、OGT、Ang2 mRNA的检测,结果显示,O-GlcNAc糖基化水平变化影响Ang2 mRNA的表达水平;而且O-GlcNAc糖基化和Ang-2的蛋白表达水平之间也呈现相关关系,当使用OGT抑制剂后,O-GlcNAc糖基化水平明显下降,HepG2细胞的增殖受到抑制,Ang-2的表达水平也随之下降;使用OGA抑制剂后,Ang-2的表达水平随着O-GlcNAc糖基化水平上升也明显升高,且HepG2细胞的增殖能力明显增强;最后,我们使用Transwell法检测发现,HUVEC细胞的迁移侵袭能力明显受到O-GlcNAc糖基化水平的调控。这些结果说明,在肝癌的发生发展过程中,O-GlcNAc糖基化水平逐渐上升,且Ang-2的表达水平可能受到O-GlcNAc糖基化的正调控,从而促进肿瘤新生血管的生成。本研究提示, 在肝癌进展中, Ang-2受到O-GlcNAc糖基化正调控, 可为未来肝癌的预防及治疗提供新的思路。但是,本研究中O-GlcNAc糖基化调控Ang-2的具体机制仍未清楚, 有待继续深入探讨。

