BALB/c小鼠经不同途径感染单纯疱疹病毒Ⅱ型的病理学比较分析
程继帅, 牟唐维, 柳 蕾, 吴化叶, 李琦涵
(中国医学科学院/北京协和医学院医学生物学研究所, 昆明650118)
单纯疱疹病毒Ⅱ型(HSV-2) 感染是最常见的性传播感染之一,其为疱疹病毒科α病毒亚科成员,主要引起外生殖器感染和新生儿感染[1-3]。全世界年龄在14岁到49岁的人群中有超过5亿人被感染[4]。HSV-2是一种具有生命周期的疱疹病毒, 周期性地脱落, 在没有病灶的情况下, 携带者也可能会在生殖道脱落HSV-2[5]。HSV-2是复发性生殖器疱疹的主要原因,并且HSV-2携带者感染人类免疫缺陷病毒(HIV)的风险增加了3倍[6]。与HSV-1感染相似,原发性感染后HSV-2可扩散至神经系统,潜伏病毒可在感染个体的骶神经节内长期存在,复发性感染通过激活潜伏在骶神经节中的病毒而发生[7]。
尽管HSV-2感染成年人引起的疾病通常是轻微的,但它对新生儿和免疫功能低下的人群来说可能是危及生命的,现已成为全球重要的公共卫生问题之一[8,9]。目前,治疗HSV-2疾病的主要方法是系统地抗病毒,如阿昔洛韦等嘌呤核苷类似物可以部分降低HSV的传播风险,但不能完全抑制病毒脱落[10]。因此,了解HSV-2的发病机制对防止病毒传播、降低疾病发病率以及靶向抗病毒药物和抗HSV-2疫苗的研制至关重要。
目前,研究人员[11-13]多采用眼角膜、后肢足垫、阴道、鼻腔等接种方式感染实验用小鼠,对其感染HSV-2后的免疫反应进行研究,少部分的研究人员[14]在猕猴模型中进行HSV-2感染后生殖道黏膜的免疫学研究, 也有部分研究人员[15,16]在豚鼠及猕猴模型中进行HSV-2疫苗的临床前研究。尽管HSV-2感染可引起致命性的神经性疾病,但对神经系统的研究较少。本研究拟采用不同的攻毒方式使成年雌性BALB/c小鼠感染HSV-2,观察感染后小鼠的临床表现,同时对攻毒部位和神经组织进行病理学分析,并对神经组织的病毒载量进行检测,以期为HSV-2感染引起的神经性疾病的发病机制研究提供理论基础。
1 材料与方法
1.1 实验动物
SPF级雌性BALB/c小鼠,4~6周龄,体质量14~20 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],饲养于本所SPF级屏障设施内[SYXK(滇)K2014-0007]。实验操作在本所SPF级屏障设施内进行,并通过中国医学科学院医学生物学研究所动物实验伦理委员会审查[DWSP201805012],遵循实验动物使用的3R和福利伦理原则。
1.2 主要试剂与仪器
主要仪器有: 高速低温离心机(22R Centifuge),购自美国贝克曼库尔特有限公司;荧光定量PCR仪(CFX96 Touch),购自美国伯乐生命医学产品有限公司;酶标仪(Eon),购自美国伯滕仪器有限公司等。主要试剂有:Premix Ex TaqTM(Probe qPCR),购自宝日医生物技术(北京)有限公司;AxyPrep病毒DNA/RNA试剂盒,购自康宁生命科学(吴江)有限公司;PBS,购自Gibco公司; 通用型组织固定液(中性),购自武汉赛维尔生物科技有限公司。
1.3 毒株
HSV-2 (病毒滴度2.5×106pfu/mL),由本所病毒免疫室提供。
1.4 实验方法
1.4.1 动物分组 小鼠随机分为4组, 每组30只。阴道组、鼻腔组、眼角膜组分别经阴道、鼻腔、眼角膜进行攻毒,剂量为20μL/只;对照组则经阴道注射PBS。
1.4.2 临床表现 攻毒后,每日观察小鼠的临床体征(如是否弓背倒毛)、活动情况、精神状态、死亡情况等,持续观察15 d,并监测各组的体质量变化。
1.4.3 组织病理分析 分别在感染后1 d、3 d、5 d和7 d, 每组取1只小鼠, 采用腹腔注射戊巴比妥钠(150~200 ng/g体质量)方法施行安死术, 然后取其阴道、鼻腔、眼周皮肤; 在感染后3d、7d, 每组取1只小鼠, 施行安死术后取其脑和脊髓, 置于质量分数4%多聚甲醛溶液中固定3~5 d。固定好的组织经脱水、透明、石蜡包埋、切片、HE染色、封固后, 显微镜下观察组织的病理变化情况。
1.4.4 病毒载量的检测 在感染后1 d、3 d、5 d、7 d,每组分别取3只小鼠,施行安死术后取其脑和脊髓,称重记录,加入250 μL PBS缓冲液,组织匀浆后13 400×g离心5 min, 取上清200 μL转入1.5 mL离心管中,用AxyPrep病毒DNA/RNA试剂盒提取组织中的病毒DNA。按照Premix Ex TaqTM(Probe qPCR) 配制反应体系,上机进行QPCR,利用HSV-2标准品标准曲线换算样品病毒DNA分子拷贝数[17]。
2 结果
2.1 临床表现
阴道组小鼠感染5 d后表现外阴炎, 甚至外阴溃烂(图1A); 眼角膜组小鼠感染5 d后表现角膜炎,甚至失明(图1B)。鼻腔组小鼠未表现明显的临床症状。与对照组相比,3个实验组小鼠体质量均有下降,阴道组小鼠的体质量在5 d、6 d显著下降,而鼻腔组和角膜组小鼠的体质量10 d后趋于稳定(图2)。阴道组小鼠在感染后9 d时,存活率已降为0; 鼻腔组小鼠在9 d时,存活率降为25%,之后未再继续下降;而角膜组小鼠在9 d时存活率仍大于75%,且并未继续下降(图3)。
2.3 神经组织病理变化

图 1 BALB/c小鼠感染HSV-2后的临床症状

图 2 BALB/c小鼠感染HSV-2后的体质量监测
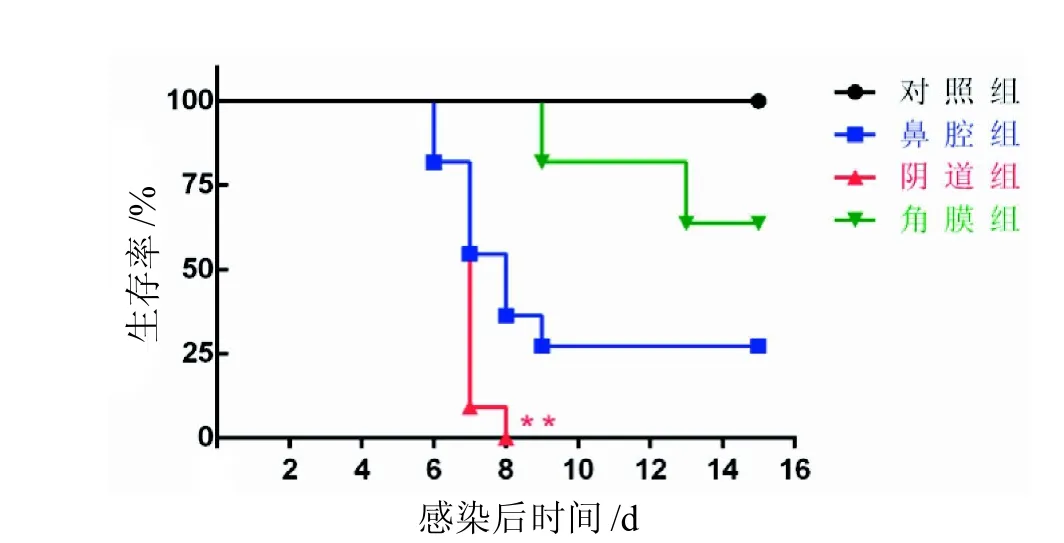
图 3 BALB/c小鼠感染HSV-2后的存活情况
阴道组小鼠感染HSV-2后7 d可见脑组织局部神经元间质结构疏松,大量神经元细胞核固缩深染, 小范围可见坏死液化, 伴有少量出血(图5C);脊髓组织在感染后7 d可见血管周围少量神经元细胞和血管平滑肌细胞坏死, 血管腔中可见少量白细胞,组织小范围出血(图5D)。角膜组小鼠感染后脑和脊髓组织未见明显病理变化(图5E、5F)。鼻腔组小鼠仅HSV-2感染后7 d的脑组织可见明显的组织损伤及结构破坏并伴有出血,大量神经元细胞核固缩深染(图5G),而脊髓组织未见明显的病理变化(图5H)。
2.4 脑和脊髓组织病毒载量
各组小鼠脑组织中的病毒载量随着感染时间的增加而增加,感染后7 d脑组织中的病毒载量最高,与对照组相比,3个实验组小鼠的检测结果差异均有统计学意义(图6)。与脑组织相似,脊髓组织中的病毒载量随着感染时间的增加而增加,在感染后7 d达到最大值,与对照组相比,感染后7 d的病毒载量均显著上升(图7)。
3 讨论
HSV-2感染在全球多个地区高度流行,其传播与年龄、性别、种族、性伴人数、文化程度、HIV感染等社会人口学因素有关[18,19]。HSV-2不仅可以经性生活而且还可以经唾液、生殖道分泌物进行传播。无典型临床表现而存在间歇性病毒排放现象的感染者是目前最重要的传染源[20]。本研究采用3种不同的攻毒方式使成年雌性BALB/c小鼠感染HSV-2,观察感染后小鼠的临床表现以及攻毒部位和神经组织的病理变化,并对神经组织的病毒载量进行检测分析。

图 4 BALB/c小鼠感染HSV-2后攻毒部位的病理变化(HE×200)
本研究中HSV-2分别经鼻腔、阴道、眼角膜感染小鼠, 临床症状观察发现, 阴道组和角膜组均出现了不同程度的皮肤黏膜感染症状(如外阴炎、角膜炎), 而鼻腔组未观察到明显的临床症状。攻毒部位的病理分析结果同样佐证了临床症状的观察结果。鼻腔组鼻周皮肤切片未见明显的病理变化, 而阴道组和角膜组分别在其攻毒部位表现出随着感染时间的增加而加重的病理变化。有研究发现, HSV-2不仅可以引起生殖系统感染, 也可引起其他皮肤黏膜(如口腔、鼻腔、眼睛等)的感染[21]。本研究中经眼角膜感染HSV-2后引起了眼周皮肤的病理损伤, 同样也证实了上述的研究观点。
神经组织的病理分析可以看到,鼻腔组和阴道组的脑组织感染后7 d均表现出明显的组织损伤、结构破坏、出血、细胞坏死等病理变化,且阴道组的脊髓组织也出现了相似的病理变化,而角膜组的神经组织并未发现明显的病理变化。神经组织病毒载量的检测结果显示, 与对照组小鼠相比,感染HSV-2后各组小鼠脑和脊髓中HSV-2的病毒载量均显著升高,且随感染时间的增加而升高。尽管角膜组小鼠脑组织中的病毒载量高于鼻腔组和阴道组小鼠,但其脑组织并未出现明显的病理变化;而阴道组小鼠脊髓组织中的病毒载量高于鼻腔组和角膜组小鼠,且其脊髓组织表现出明显的病理变化。HSV-2病毒感染除了可以引起皮肤黏膜的感染,也会侵入神经组织引起神经组织的病理变化。病毒载量的检测结果也可看到,鼻腔组和角膜组小鼠脑组织中的病毒载量较高于阴道组小鼠,而阴道组小鼠脊髓组织中的病毒载量较高于角膜组和鼻腔组,这就说明病毒载量的高低可能与攻毒部位具有一定的联系。小鼠存活情况也可知,阴道组在观察周期尚未结束时存活率已为0,而鼻腔组小鼠在观察周期结束时尚有27.27%,角膜组小鼠在观察周期结束时仍有63.64%。结合神经组织的病理学分析可知,病毒侵入神经组织以及病毒造成神经组织的病理损伤是导致小鼠死亡的重要原因。
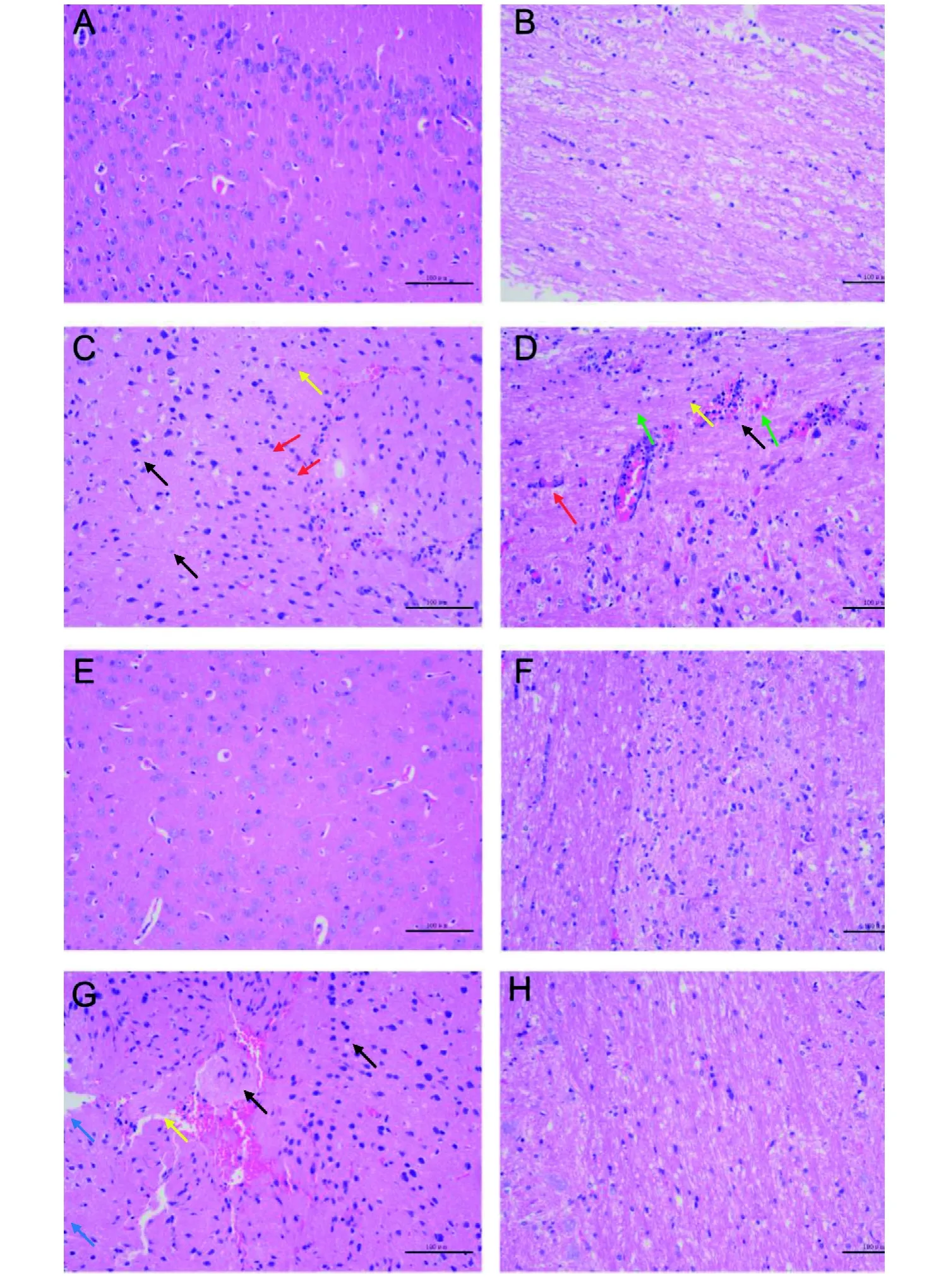
图 5 BALB/c小鼠感染HSV-2后神经组织的病理变化 (HE×200)
本研究中,阴道组和角膜组小鼠均能较好地模拟HSV-2感染人后急性期表现出的皮肤和黏膜组织病理损伤的临床症状,而鼻腔组小鼠感染后并不表现明显的急性感染期症状,但在其神经组织中有着较高的病毒潜伏,这与HSV-2病毒的潜伏感染特点相吻合。HSV-2感染后不仅能够引起机体皮肤和黏膜的感染,同时也可侵入神经组织,造成致死性的神经组织病理变化。本研究为HSV-2感染的发病机制研究、治疗药物的药效评价以及预防疫苗的临床前研究提供了理论基础。

图 6 BALB/c小鼠感染HSV-2后脑组织中的病毒载量

图 7 BALB/c小鼠感染HSV-2后脊髓组织中的病毒载量

