急性缺血性卒中合并脑微出血的危险因素及预后研究
王丹妮,陆小林,陈丽芳,林志伟,马琪林,鲁丛霞
(厦门大学附属第一医院神经内科,福建厦门361003)
脑微出血(cerebral microbleeds,CMBs)是发生在脑小动脉、微动脉、小静脉及毛细血管的一种常见的脑小血管疾病[1]。影像学及病理学的相关研究表明,CMBs为血脑屏障破坏后血液漏出,在小血管周围形成的局灶性含铁血黄素沉积[2]。目前认为CMBs最主要的发病机制是高血压所致小动脉粥样硬化、脂质透明变性和脑淀粉样病变[3-5]。因CMBs显示了基础的血管病变,具有出血倾向,提示CMBs可能与卒中相关[6]。一项系统性研究结果显示,CMBs在缺血性卒中人群的患病率较健康人群高,可达33.5%,且在复发性卒中者进一步增高,复发性缺血性卒中达44%,复发性出血性卒中甚至高达83%[7]。然而,目前已报道的文献针对合并CMBs是否会增加急性缺血性卒中患者的不良预后仍存在争议[8-13]。现阶段基于缺血性卒中合并CMBs患者的预后研究较少关注CMBs对缺血性卒中急性期抗栓治疗效果的影响。缺血性卒中患者急性期具有高复发风险[14],尽早启动抗栓治疗可明显降低缺血性卒中复发的风险,但同时亦增加了出血事件的发生[15]。因此,对于合并CMBs的缺血性卒中患者,权衡急性期抗栓治疗在防治复发性缺血性卒中与出血转化风险之间的利弊尤为重要。本研究通过开展回顾性病例对照研究和历史队列研究,运用对CMBs具有高敏感性的磁敏感加权成像(sensitivity weighted imaging,SWI)序列检查[16]对急性缺血性卒中患者进行评估和分析,旨在明确急性缺血性卒中患者合并CMBs的独立危险因素,并探讨急性缺血性卒中合并CMBs是否增加缺血性脑卒中患者急性期治疗的不良预后。
1 资料和方法
1.1 临床资料
连续性收集2018年1月-2018年12月于厦门大学附属第一医院神经内科住院治疗的急性缺血性卒中患者。收集纳入患者详细的临床资料,包括人口学特征(性别、年龄)、既往史(高血压病、糖尿病、房颤、缺血性心脏病、高脂血症)、个人史(吸烟史、饮酒史)、实验室检查指标[甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、纤维蛋白原(FIB)、尿酸(UA)、尿素氮、血肌酐(GRE)]、入院时美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分、住院期间神经功能症状加重时的NIHSS评分,以及颅脑影像学检查(颅脑CT、颅脑MRI)结果。同时记录急性期使用的抗栓治疗方案。
1.2 入组标准
符合中国急性缺血性脑卒中诊治指南2018中急性缺血性卒中的诊断标准[17];年龄≥18岁;发病3 d内入院;颅脑磁共振弥散加权成像(diffusion weighted imaging,DWI)检查证实存在与此次发病症状及体征相关的责任病灶;既往无脑出血、缺血性卒中等脑血管病变病史;发病前未曾长期(大于2周及以上)使用抗血小板聚集治疗;获得患者的知情同意。
1.3 排除标准
接受静脉溶栓、血管内治疗的患者;合并严重肝肾功能损害者;有心肌梗死、严重心律失常、心力衰竭、脑血管畸形、颅内动脉瘤、烟雾病、肿瘤疾病的患者;近3个月有活动性出血,或有血液系统疾病的患者。
1.4 抗栓治疗方案
单抗治疗:单独使用阿司匹林或氯吡格雷抗血小板治疗;双抗治疗:联合使用阿司匹林和氯吡格雷抗血小板聚集治疗;抗凝治疗:使用华法林或低分子肝素或新型口服抗凝药治疗;中性治疗:未予抗血小板聚集治疗或抗凝治疗。
1.5 影像学检查评价标准
所有图像分析判定均由两名神经内科临床医师进行。CMBs的诊断采用颅脑磁共振SWI序列扫描图像显示结果。CMBs的诊断标准参考Greenberg SM等[18]提出的标准,梗死灶内的CMBs均不纳入分析,具体诊断标准:在颅脑SWI呈直径2~10 mm的圆形或类圆形、边界清晰的黑色或低信号区域;在常规T1加权像(T1 weighted imaging,T1WI)、常规T2加权像(T2 weighted imaging,T2WI)和液体衰减反转恢复(fluid attenuation inversion recovery,FLAIR)序列上均无异常信号;至少一半被脑实质包绕;周围无明显水肿,无发育异常静脉包绕。运用Fazekas评分对脑白质疏松症的严重程度进行分级。首先采用四分法分别对脑室旁白质高信号(periventricular hyperintensity,PVH)和深部脑白质高信号(deep white matter hyperintensity,DWMH)进行评分。PVH评分:0级为无病变或缺失;1级为帽状、铅笔样或线样的薄层病变;2级为病变呈光滑的晕圈;3级为不规则的侧脑室周围病变并延伸到深部白质(不超过侧脑室旁10 mm)。DWMH评分为:0级为无病变或缺失;1级为点状病灶(5~10 mm);2级为病灶融合(>10 mm);3级为大面积融合病灶[19-21]。按DWMH评分和PVH评分总分计算出Fazekas评分。脑白质疏松症的严重程度分为正常或轻度脑白质疏松症(Fazekas评分≤1分)和中重度脑白质疏松症(Fazekas评分≥2分)。腔隙性脑梗死是在颅脑T2WI或FLAIR图像上,分布于大脑半球白质、基底节区或脑干的直径为3~20 mm的圆形或卵圆形的类似脑脊液的高信号区[22-23]。
1.6 神经功能急性期预后评价标准
所纳入患者均根据中国急性缺血性脑卒中诊治指南2018使用标准的治疗方案[17]。在急性期住院期间,若患者出现神经功能缺损症状及体征加重,NIHSS评分较入院时增加≥4分且复查颅脑CT未见出血,定义为神经功能缺失症状加重。若患者出现神经功能缺失症状及体征加重或新发神经功能缺失症状及体征时,复查颅脑CT提示梗死病灶出血转化,定义为出血转化。
1.7 统计学方法
采用SPSS 22.0统计软件进行数据的统计与分析。计量资料用均数±标准差(±s)表示,两组之间比较采用t检验,计数资料用频次(率)表示,两组资料之间比较采用χ2检验或Fisher精确检验。单因素分析中P<0.1的变量进一步行多因素Logistic回归分析,分析结果用比值比(odds ratio,OR)及95%可信区间(confidence interval,CI)表示。P<0.05表明差异具有统计学意义。
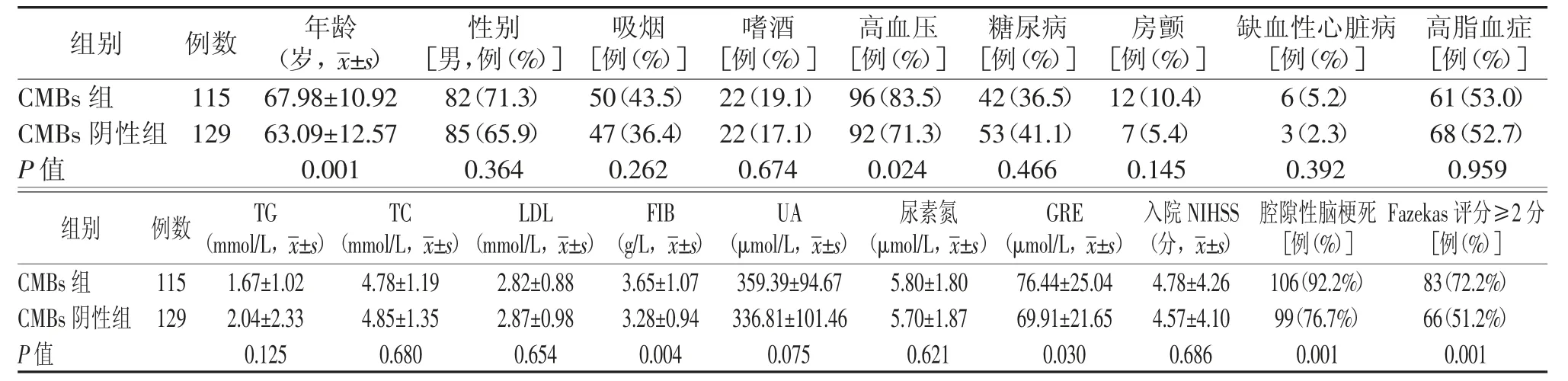
表1 急性缺血性卒中合并脑微出血的单因素分析
2 结果
2.1 一般情况
本研究最终共纳入244例急性缺血性卒中患者,男167例(68.4%),女77例(31.6%),平均年龄(65.39±12.05)岁。急性缺血性卒中合并CMBs组115例(47.1%),CMBs阴性组129例(52.9%),其中1≤CMBs<5有83例(34.0%),CMBs≥5有32例(13.1%)。
2.2 单因素分析
急性缺血性卒中合并CMBs组较CMBs阴性组年龄更大,高血压患者更多,纤维蛋白原值更高,血肌酐值更高,合并腔隙性脑梗死者更多,合并中重度脑白质疏松症者也更多(P<0.05)。而两组在性别、吸烟史、嗜酒史、糖尿病、缺血性心脏病、房颤、高脂血症、TC、TG、LDL、UA、尿素氮、入院NIHSS评分比较差异无统计学意义(P>0.05)。结果见表1。
2.3 多因素分析
进一步将单因素分析中P<0.1的因素进入多因素的Logistic回归分析中发现,FIB(OR=1.362,95%CI,1.039~1.786,P<0.05)、腔隙性脑梗死(OR=2.915,95%CI,1.288~6.601,P<0.05)、中重度脑白质疏松症(OR=2.005,95%CI,1.148~3.501,P<0.05)是急性缺血性卒中合并CMBs的独立危险因素。结果见表2。
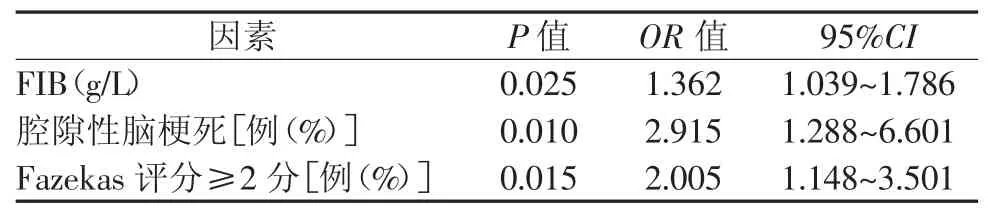
表2 多因素Logistic回归分析
2.4 急性期预后评估
急性期出现神经功能缺失症状加重者共12例,其中合并CMBs组5例(4.3%),CMBs阴性组7例(5.4%),两组比较差异无统计学意义(P>0.05)。发生出血转化者共5例,合并CMBs组4例(3.5%),CMBs阴性组1例(0.8%),两组比较差异无统计学意义(P>0.05)。结果见表3。

表3 急性缺血性卒中合并脑微出血急性期预后比较
3 讨论
本研究通过回顾性病例对照研究分析了急性缺血性卒中合并CMBs的危险因素。运用较磁共振T2-GRE序列具有更高敏感度的SWI序列对纳入的急性缺血性卒中患者进行检查。所纳入的244例急性缺血性卒中患者中,有47.1%的患者合并CMBs,且有13.1%的患者合并≥5 CMBs,表明急性缺血性卒中合并CMBs的概率明显较一般人群高[24]。本研究中,伴有腔隙性脑梗死、中重度脑白质疏松症和FIB升高的急性缺血性卒中患者更常见合并CMBs,此3个因素是急性缺血性卒中合并CMBs的独立危险因素。同样作为脑小血管病变,伴有腔隙性脑梗死的急性缺血性卒中患者发生CMBs的风险是不伴腔隙性脑梗死的急性缺血性卒中患者的2.915倍。既往多项研究支持腔隙性脑梗死与CMBs的发生密切相关[25-27]。研究也证实,腔隙性脑梗死是CMBs发生的独立危险因素,尤其是深部CMBs与腔隙性脑梗死的数目及严重程度相关[28]。目前研究已证实在腔隙性脑梗死的梗死灶周围可形成血管水肿,同时活化血管内皮细胞的血浆标志物升高,可致血管内皮功能紊乱和血液漏出,从而促进CMBs的发生[29-31]。不仅腔隙性脑梗死,伴有中重度脑白质疏松症亦明显增加了急性缺血性卒中患者合并CMBs的风险(OR=2.005)。脑白质疏松症因动脉硬化、小血管淀粉样变等效应累及深部白质小动脉,致血脑屏障破坏及缺氧低灌注而形成CMBs[32-34]。本研究中,FIB升高是急性缺血性卒中患者合并CMBs发生的独立危险因素。FIB及分解产物与血脑屏障功能障碍相关[35]。研究证实了高纤维蛋白原可协同炎症因子促进血管粥样硬化和血脑屏障的破坏,促进CMBs的发生[36]。
目前关于CMBs对急性缺血性卒中患者住院治疗急性期预后影响的研究较少见。本研究发现在标准抗栓治疗过程中,急性缺血性卒中合并CMBs并未引起急性期住院期间神经功能缺失症状加重或增加出血转化风险。急性缺血性卒中合并CMBs组与CMBs阴性组相比,在抗栓治疗方案两组间无明显差异的情况下,其住院期间发生神经功能症状加重和出血转化事件的差异无统计学意义。前瞻性研究发现,合并CMBs组与CMBs阴性组在急性缺血性卒中急性期使用抗栓治疗2 d后出血转化的发病率上无明显差异[37]。Ozbek D等[38]观察急性缺血性卒中患者1周内出现出血转化情况时,发现CMBs与出血转化无明显相关。同时一项基于合并房颤或风湿性心脏病的缺血性卒中患者的前瞻性研究结果也显示,CMBs的存在未明显增加患者急性期住院期间使用抗栓治疗后发生出血转化的风险[39]。由此可见,本研究结果与既往研究均表明合并CMBs不影响急性缺血性卒中患者在急性期抗栓方案实施。但是上述研究仅将CMBs分为有无合并CMBs两组,目前已报道的研究中均未评价CMBs数量分层后对急性缺血性卒中患者急性期治疗的影响。未来有必要开展前瞻性研究,根据CMBs具体数量评估合并多发CMBs是否会影响急性缺血性卒中患者急性期抗栓治疗的预后。
本研究基于回顾性病例对照和历史队列研究存在选择性偏倚和信息偏倚;有待扩展样本量进行前瞻性队列研究进一步对研究结果进行验证。
综上,本研究表明高纤维蛋白原血症、腔隙性脑梗死、中重度脑白质疏松症是急性缺血性卒中合并CMBs的独立危险因素。在住院治疗急性期,急性缺血性卒中患者合并CMBs并未加重神经功能缺失症状或增加出血转化风险。

