高考试题认知目标分类研究:工具、方法及意义
朱志江
摘要: 以布卢姆教育目标分类学为指导,以分类表为工具,通过对典型高考试题解答所需知识及思维过程的分析,阐释认知目标分类的方法。试题认知目标分类研究,对高考试题评价标准研制具有借鉴意义,对学生自我评价促进备考学习具有指导意义,对核心素养评价试题改革具有启发意义。
关键词: 高考试题; 认知目标; 分类研究
文章编号: 1005-6629(2020)02-0077-04
中图分类号: G633.8
文献标识码: B
1 工具运用
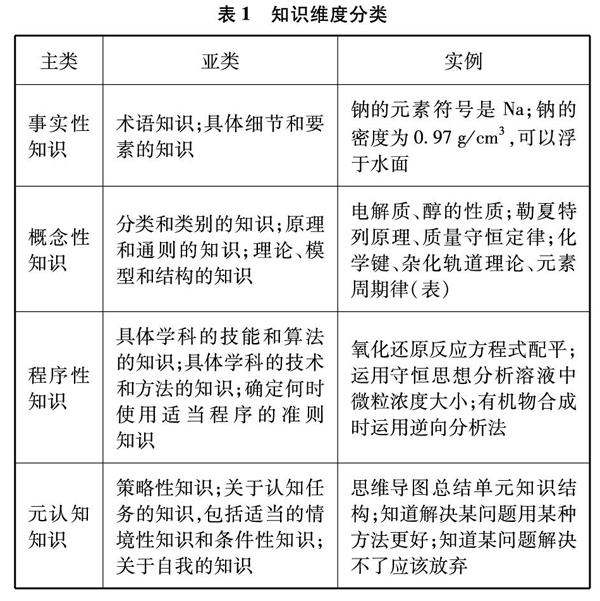
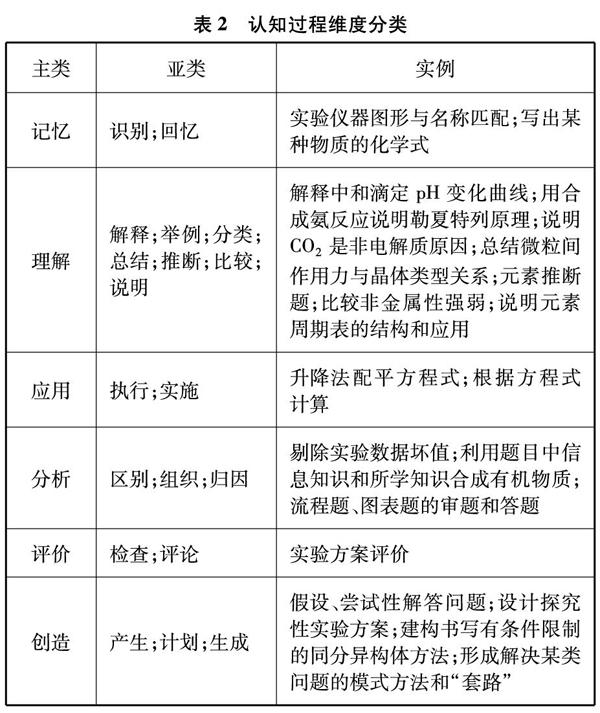
《布卢姆教育目标分类学(修订版): 分类学视野下的学与教及其测评》一书,在教育认知目标领域构建了教、学、评的工具框架,其核心观点关于知识分类和认知过程分类的思想架构为测验设计提供了基本依据[1]。现以化学具体知识和学习认知过程为例,用两个表格呈现该理论对知识和认知分类的内涵依据(见表1和表2)。
将上面两个表格结合产生一个二维表格,表格的行和列分别由知识类别和认知类别构成,两个维度相交处就是认知目标表现的结果。分析高考试题考查的知识类型和认知过程类型,试题的认知目标就可以大致显示出来。为了更进一步理解这种分类依据的内涵要素,现以2018年江苏高考实验综合题为例,进行分类过程的描述和方法说明。
2 分类方法和过程
具体做法是将问题编号,对照标准答案和解答说明,对答题所需知识和认知类别与分类依据进行比对识别,把结果汇总于分类表格中。
2.1 题目及问题编号
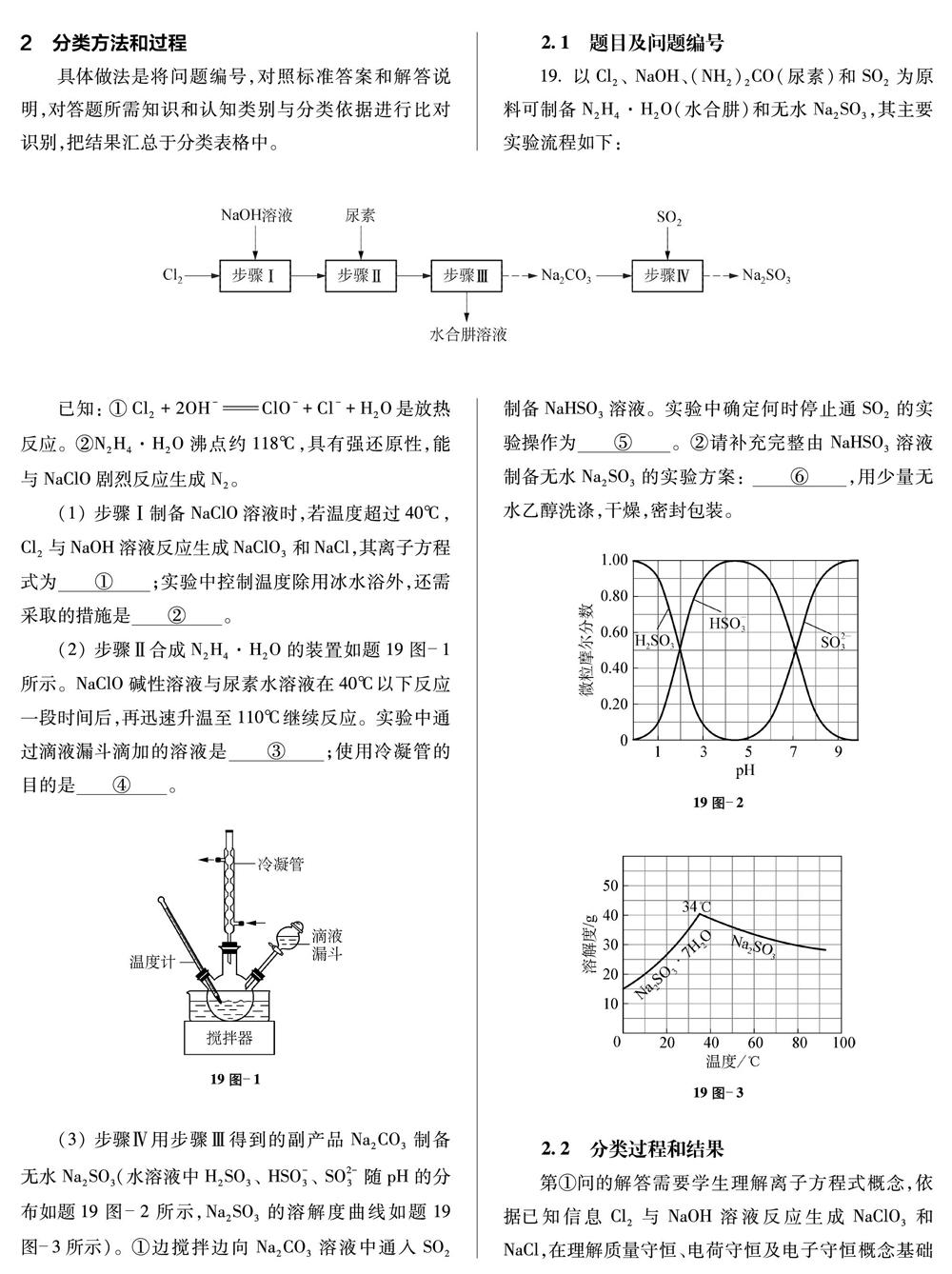
19. 以Cl2、 NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
已知: ①Cl2+2OH-ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1) 步骤Ⅰ制备NaClO溶液时,若温度超过40℃, Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为 ① ;实验中控制温度除用冰水浴外,还需采取的措施是 ② 。
(2) 步骤Ⅱ合成N2H4·H2O的装置如题19图-1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是 ③ ;使用冷凝管的目的是 ④ 。
19图-1
(3) 步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、 HSO-3、 SO2-3随pH的分布如题19图-2所示,Na2SO3的溶解度曲线如题19图-3所示)。①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为 ⑤ 。②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: ⑥ ,用少量无水乙醇洗涤,干燥,密封包装。
19图-2
19图-3
2.2 分类过程和结果
第①问的解答需要学生理解离子方程式概念,依据已知信息Cl2与NaOH溶液反应生成NaClO3和NaCl,在理解质量守恒、电荷守恒及电子守恒概念基础上,应用守恒思想分析元素守恒补上产物H2O后,书写出陌生离子方程式并检查正误: 3Cl2+6OH-△5Cl-+ClO-3+3H2O,以上任务完成还建立在“書写”和“检查”两个程序性知识的创造和运用上。
第②问要求学生具有影响化学反应速率因素的概念知识,具体指“温度升高反应速率加快”;具有反应热效应的概念知识,即反应必然要放热或吸热;具有影响反应速率的“情境性知识”,也是解答该问的关键性知识,即要知道“化学反应系统自身变化会带来影响速率因素的改变”,如“反应热效应会带来温度改变、温度或环境变化会带来催化剂性能改变,以及随着反应进行反应物浓度变小”等,这种暗藏着的影响化学反应速率变化的隐蔽性因素分析,是属于一种不明情境知识,学生如果具有并能够运用这些知识,才具备解决类似问题的知识基础。学生知道在这样的问题中需要运用该类知识,这也是解决问题的必需条件,属于解决该类问题的条件性知识。还有一个知识是获取情境信息的元认知知识,即意识到题目中给出的“已知”是有用的,并要用来对接问题分析,打通信息知识与问题答案之间的关联通道。在具有上述知识的基础上,挖掘“Cl2+2OH-ClO-+Cl-+H2O是放热反应”的信息意义,结合速率影响因素概念知识的理解分析得到正确答案“缓慢通入Cl2”。
第③问中,学生要通过元认知确定“N2H4·H2O与NaClO会剧烈反应”是答题必要信息,属于元认知知识应用;要具有并理解“滴液漏斗可控滴加物数量”的概念知识,此处是滴液漏斗原理的分析应用。此处关键要能够生成出“两种反应物滴加方式不同导致反应物的‘量的情况不同,反应结果不同”这个概念,才能回答出滴液漏斗中的试剂应该是“NaClO碱性溶液”。
第④问的评价目标相对简单,是冷凝管用途事实性知识回忆和在该实验情境条件中的理解和应用。学生要回忆起冷凝管用途是“冷凝”这个知识点,通过元认知认识到“N2H4·H2O沸点约118℃”和“升温至110℃继续反应”的信息价值,在理解沸点概念基础上分析得出答案是“减少水合肼的挥发”。
第⑤问要求学生熟悉相关化学反应概念知识,理解、分析和应用微粒摩尔分数曲线图概念的意义,得出“测量溶液的pH,若pH约为4时停止通入SO2”的正确答案。
第⑥问比较复杂,主要有NaHSO3性质的概念應用,微粒摩尔分数曲线图和溶解度曲线图的理解、分析和应用,还有从溶液中如何获得晶体的实验程序、方法、知识的理解、分析和应用,以及能够把以上各个要素进行正确关联、组织,然后科学化描述给出的策略方法。最后是对设计方案进行评价检查。该问题解决需要清晰的思维方法路径,概念原理知识在思维层面运作产生的步骤方法就是程序性知识的创生,第⑥问的解决需要的创生的程序性知识是:“确定制备Na2SO3的反应原理——初步画出实验制备流程图——对照流程图精致文字正确表述”,其中细节知识包括确定反应原理的方法思路、画好流程图的关键要领以及表述答案的注意事项等,如果没有这样的知识基础和思维程序想正确解答此问是非常困难的。具有了以上知识和认知水平后才可能得到相对标准的答案:“边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH, pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤”。
将以上认知目标分类汇总,见表3。
2.3 分类结果与评价标准比对
从表3分类结果看,试题考查的认知目标中有1个事实性知识的1~4层次认知活动,6个问题都考查了概念知识的理解、分析和应用的认知目标,属于高级学习技能范畴[2]的分析、评价、创造类认知目标考查共出现了11次,强化了理解化学学科的素养能力要求[3]考查。有3个问题要求学生具有元认知知识进行信息应用。此外,对实验装置图、摩尔分数坐标图、溶解度坐标图等概念知识分析和应用的大量考查,充分体现了江苏高考注重形成信息素养[4]的能力要求,其中“反应物滴加方式不同即反应物‘量不同”的概念生成、“陌生离子方程式书写及检查正误”和“综合实验方案设计”的程序性知识创生,都强化了学生解决化学问题[5]的素养能力要求。整个试题以陌生素材、流程图形式的综合实验来评价学生学会实验探究[6]的素养能力水平,体现了江苏化学高考“以考查学生的科学素养和化学学科能力为主旨”的指导思想。此题代表了江苏高考试题认知目标考查中的高标准类型,符合考试说明中“素养和能力”的评价目标要求[7]。
2.4 认知目标分类标准的认定说明
运用教育目标分类学进行分类操作时,也许会因个人理解误差带来分类结果偏差,但严格遵照分类中规定的主类和亚类的意义内涵进行,这样的偏差不会构成对分类结果的整体影响。如表3中第①问写离子方程式,分类中为什么有“创造”认知?是因为学生要有陌生离子方程式书写的程序方法,“确定主要物质——化合价升降相等——电荷守恒、原子守恒——补上缺少物质——配平并检查”。从学生方面来看,该思维过程当然属于“创造”认知,但如果学生此前已经习得并掌握了该离子方程式,那么此时就属于程序性知识的“应用”认知,而不属于创造认知。对目标分类时不能依据千差万别的学生个体认知结构水平来认定,而要按照既定的分类标准进行,这就是布卢姆的分类依据。
3 试题认知目标分类的意义
3.1 制定目标标准,有利标准稳定
基于理论的高考试题认知目标水平分析研究并不常见。寻求科学理论的指导,运用具体工具和操作方法对试题评价目标进行精细划分确定,既可以保证评价目标制订依据的科学性,又可以保证评价目标的稳定性。在还没有更科学精确的认知目标分类工具出现之前,布卢姆的认知目标“二维分类法”,对确定试题认知目标的精准性和保证试题评价标准的稳定性都有借鉴意义。
3.2 明示试题目标,指导高考教学
目标分类有助于明确试题考查目标,分析结果可以帮助学生反思自己知识结构和认知结构,学习中既要掌握核心事实性知识,还要能够理解分析应用必要的概念知识,并要进行高阶的评价和创造性认识活动,而不能习惯于低层次的机械记忆训练学习。更重要的是,通过策略性知识学习,丰富元认知学习,加强程序性知识的创造应用,可以改变和发展原认知结构,实现学生个体认知水平对高考认知目标的超越。
3.3 启发高考改革,提高评价质量
运用布卢姆认知目标分类法对一套试题或者某个试题进行分析,可以看出试题考查目标的指向性和规律性。由于高考具有一定的社会稳定性要求,稳定就会导致试题的模型固化,试题的模式化可能导致模式化应试教学的发生。认知目标分类学给我们的启示是: 在即将到来的核心素养评价过程中,既要研制出符合新课程目标层次的试题,又要避免认知目标的模式固化可能带来新的应试教学的发生。
参考文献:
[1]洛林·W. 安德森等编著. 蒋小平等译. 布鲁姆教育目标分类学[M]. 北京: 外语教学与研究出版社, 2009: 序.
[2]R.M.加涅等著. 王小明等译. 教学设计原理[M]. 上海: 华东师范大学出版社, 2018: 61.
[3][4][5][6][7]江苏省教育考试院. 2019年江苏省高考考试说明(化学)[M]. 南京: 江苏教育出版社, 2019: 28~34.

