碳点荧光探针的表征及其对Fe(Ⅲ)检测的应用
温金熙,汪沁,齐嘉欣,周兴平
(东华大学化学化工与生物工程学院,上海 201620)
自2004年Xu等人[1]在制备单壁碳纳米管时发现碳点以来,科研人员对其进行了大量的研究。随着研究的深入,发现碳纳米点是直径在10 nm以下的零维材料,拥有光致发光和下转换发光等特性[2]。此外碳量子点具有低毒性、优异的生物相容性、良好的光学性能和金属离子特异性淬灭等诸多优点,使得其在生物荧光成像,离子浓度检测等领域具有广泛的应用前景[3-4]。
因环境污染的加剧,人们对于水中重金属离子的检测更加重视,研制一种便捷、高效的金属探针显得尤为必要。而相对于ICP、化学滴定法等传统的金属离子检测方法,利用碳点合成的荧光探针具有检测快速、使用方便等诸多优点。且相关研究表明,碳点作为金属荧光探针对目标离子的灵敏度和选择性完全满足实用要求。例如,Zhou等人[5]发现碳纳米点作为一种新型荧光检测平台对Hg2+具有良好的淬灭效应,并且碳点荧光强度与溶液中Hg2+浓度呈线性关系。Xu等人[6]发现所合成的碳点对Cu2+具有淬灭效果,能检测溶液中铜离子含量。
本文使用壳聚糖作为碳源合成碳点,并对其结构和光学性能进行表征;同时将所合成碳点作为荧光探针检测溶液中Fe3+含量,并建立相应检测体系。
1 材料与方法
1.1 试剂与仪器
壳聚糖、氯化钙、硫酸铜、硝酸银、氯化钾、硫酸镁、氯化钠、氯化铵、硝酸银、硫酸铅和氯化铁均为分析纯,购自国药集团化学试剂有限公司;去离子水为实验室自备。
透析袋3500Da,美国viskase有限公司;Avatar380红外光谱仪,美国热电集团;V-530紫外分光光度计,日本分光株式会社;F-4500荧光仪,日立公司;D/max-2550PC X射线粉晶衍射光谱仪,日本Rigaku。
1.2 实验方法
1.2.1 碳点的制备
将1 g壳聚糖倒入聚四氟乙烯高压反应釜中,同时加入50 mL去离子水,搅拌使反应物质均匀分散。将反应釜置于烘箱中在180 ℃条件下反应5 h,反应结束后取出反应釜并冷却至室温。将反应所得的深棕色溶液转移至离心管中,后使用离心机并以12 000 r/min 的转速离心 10 min,离心结束后取出离心管并分离上清液与杂质,并使用0.22 μm微孔滤膜对上清液进一步过滤以除去较大颗粒物质,将过滤后的溶液进行冷冻干燥后得到棕黄色CDs粉末。
1.2.2 金属离子选择性检测
用NaOH和HCl调节去离子水pH为3左右,随后分别加入等量金属离子Zn2+、Ca2+、Cu2+、Ag+、K+、Mg2+、Ni2+、Pb2+、NH4+和Fe3+,并使得金属离子的浓度均为10-4mol/L,随后加入碳点配置成CDs浓度为1 mg/mL的溶液,静置5 min后取出并使用稳态/瞬态荧光光谱仪测试,设置激发波长为350 nm,分析CDs和FHGF在不同金属溶液中的荧光数据,以此确定其唯有对Fe3+具有选择性淬灭。
1.2.3 金属离子敏感性测试
将CDs配置成浓度为1 mg/mL、pH为3的溶液待用,加入FeCl3配置成不同Fe3+浓度梯度(0 μmol/L、0.2 μmol/L、0.4 μmol/L、0.6 μmol/L、0.8 μmol/L和1.0 μmol/L),后使用稳态/瞬态荧光光谱仪测试每个样品的荧光强度,设置激发波长为350 nm。并利用Stern-Volmer方程对上述两个实验的荧光猝灭进行定量分析,方程如(1)所示。

式中F0和F分别是CDs在不添加和添加Fe3+时的荧光强度,ksv是斯特恩-沃尔默猝灭系数,C是被分析物Fe3+的浓度。检出限使用3σ/s进行测试,其中σ代表10次空白测量的标准偏差,s代表校准曲线的斜率。
2 结果与讨论
2.1 CDs的紫外光谱分析
图1为CDs的紫外光谱图,从图中可以看出CDs在345 nm处出现一个很强的吸收峰,这可能是由于C=O键的n-π*跃迁[7]。样品在紫外光照射下,CDs溶液呈现明亮的蓝光,这说明其发射光范围应在400~480 nm。并且由稳态/瞬态荧光光谱仪测试可得其绝对荧光量子产率为15.2%。
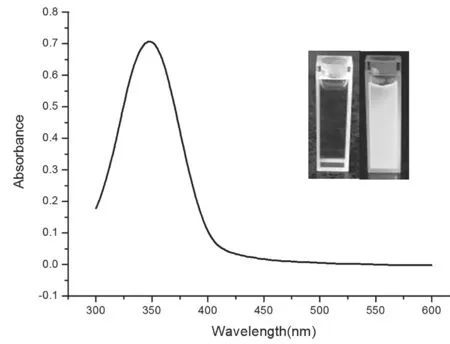
图1 CDs的紫外光谱图及紫外光照射实物图
2.2 CDs的荧光光谱分析
图2为CDs在不同激发光下的发射谱图。从图中可以看出,随着激发波长的增大,发射波长出现明显的红移现象,这可能是由于CDs存在激发依赖效应。并且从图中可以看出碳纳米点属于下转换发光(碳纳米点的激发波长小于发射波长)。图3为CDs的最佳激发-发射荧光谱图。从图中可知,碳点的最佳激发峰在345 nm附近,而最佳发射峰位置在445 nm附近,属于蓝光区域。并且从SEM图中可知CDs的平均粒径为8.3 nm。
2.3 CDs的XRD谱图
图4为壳聚糖和CDs的XRD谱图。从图中可以看出壳聚糖在10°左右有一个平滑的峰,在20°附近有一个清晰且尖锐的衍射峰,这表明壳聚糖存在分子内氢键且具有一定晶型结构。然而,CDs在23°附近有一个宽的衍射峰,这表明所产生的碳点主要是非晶碳的形式[8]。
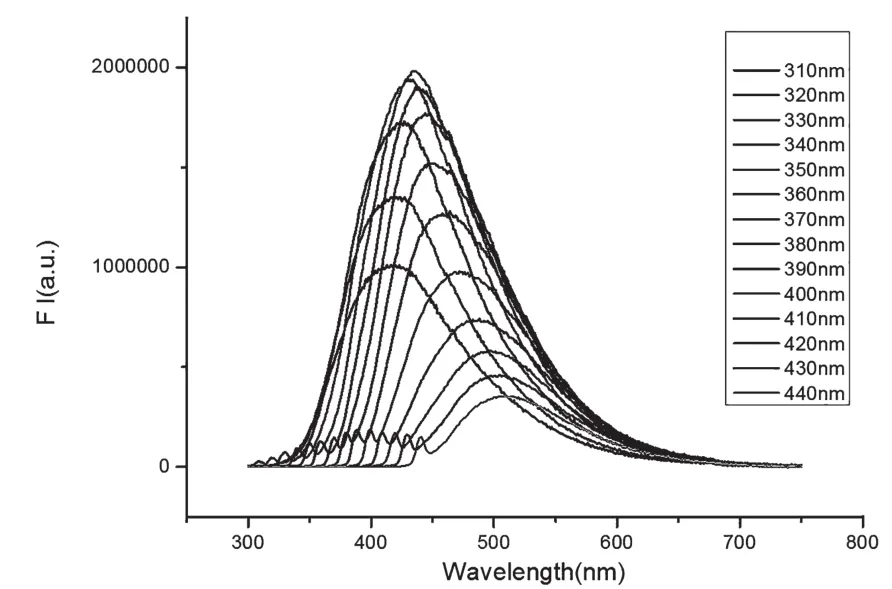
图2 CDs在不同激发光下的荧光发射谱图
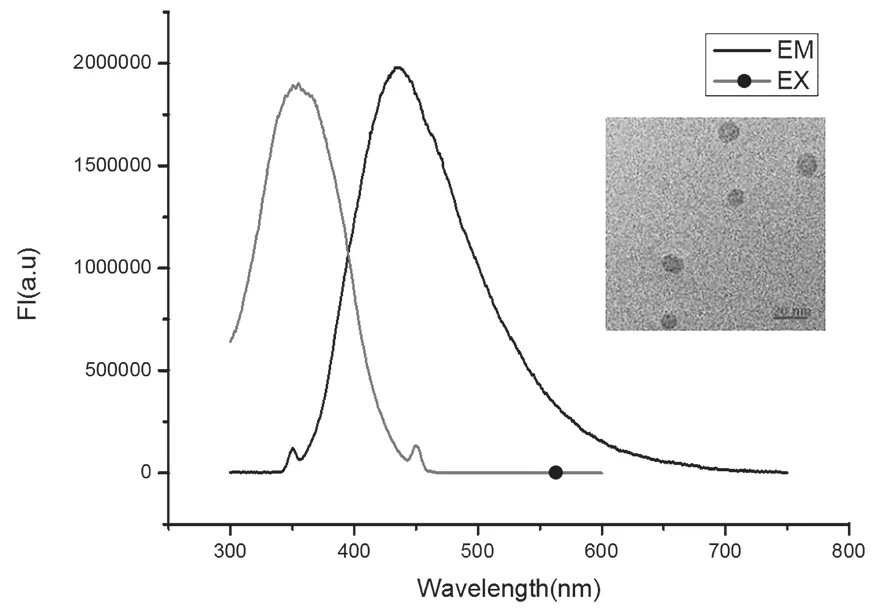
图3 CDs的激发-发射谱图及SEM图
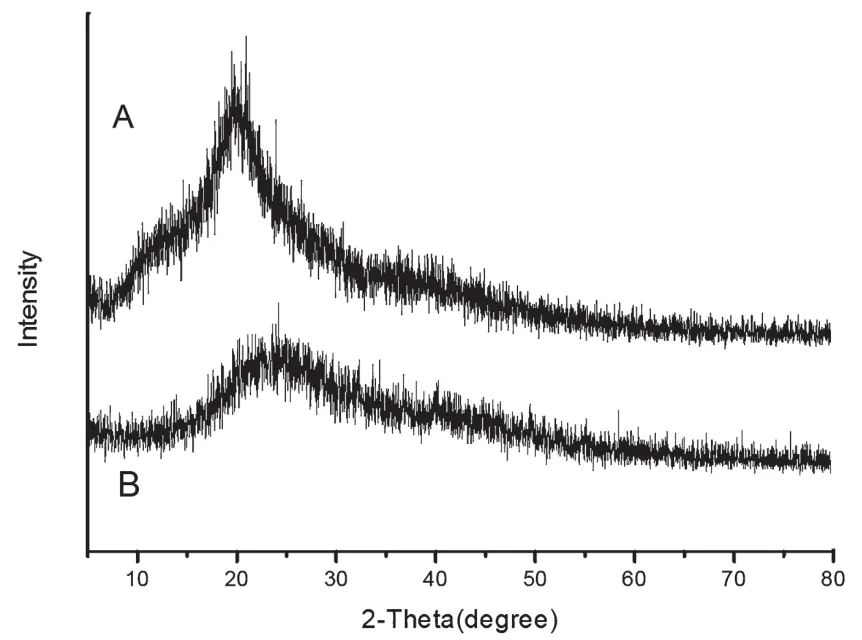
图4 壳聚糖(A)和CDs(B)的XRD谱图
2.4 CDs的红外光谱分析
图5为壳聚糖和CDs的FT-IR谱图。与壳聚糖的红外谱图对比,可发现 CDs在 3 308 cm-1和 3 177 cm-1处有明显的吸收峰,这分别是由-OH和-NH两个基团的伸缩振动所产生的特征峰,说明制备的CDs很可能存在酰胺基,并且作为主要发光基团。同时对比壳聚糖的样品,可以发现在3 177 cm-1附近出峰强度大大增加,且出峰位置出现红移,这可能是由于在高温作用下形成更多-OH与-NH基团,并且其摆脱原来化合物结构的束缚,从而使得出峰增强,而红外光谱发生红移的主要原因是分子内氢键的形成使得化合物结构趋于稳定,降低了基团振动频率。而2 951 cm-1、1 649cm-1、1 441cm-1和 1 112 cm-1处的吸收峰分别对应的是-CH、C=O、-CH2-和-C-O-C-的特征吸收峰[9]。进一步分析可知,以壳聚糖原料制备CDs后,壳聚糖大部分的结构都被破坏并生成许多新的基团,并且相对于壳聚糖无法溶于水溶液,因壳聚糖具有-OH和-NH等亲水基团,使得其成为水溶性碳点。
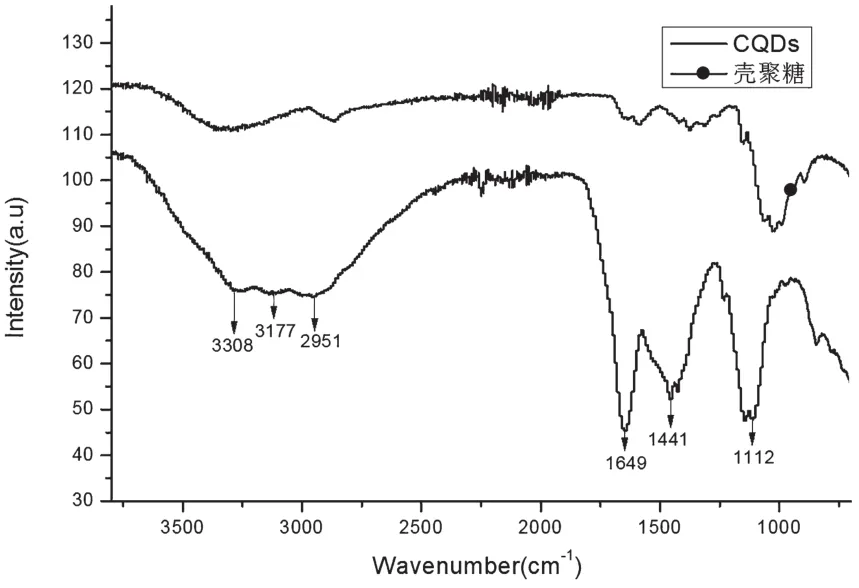
图5 壳聚糖和CDs的FT-IR谱图
2.4 CDs对金属离子选择性分析
从图6可以看出CDs与相同浓度(10-4mol/L)的不同金属离子(将不同盐溶于去离子水中所得金属离子溶液)混合在一起后,发现唯有加入Fe3+后的样品出现荧光淬灭的现象,Cu2+能够使得CDs溶液荧光强度降低45%左右,而加入其他金属离子的CDs溶液荧光强度并未受到较大影响,这可能是由于CDs与价位较高的Fe3+容易结合生成稳定的配合物,从而使得CDs发生荧光淬灭现象,这证明CDs对于Fe3+具有一定的选择性。
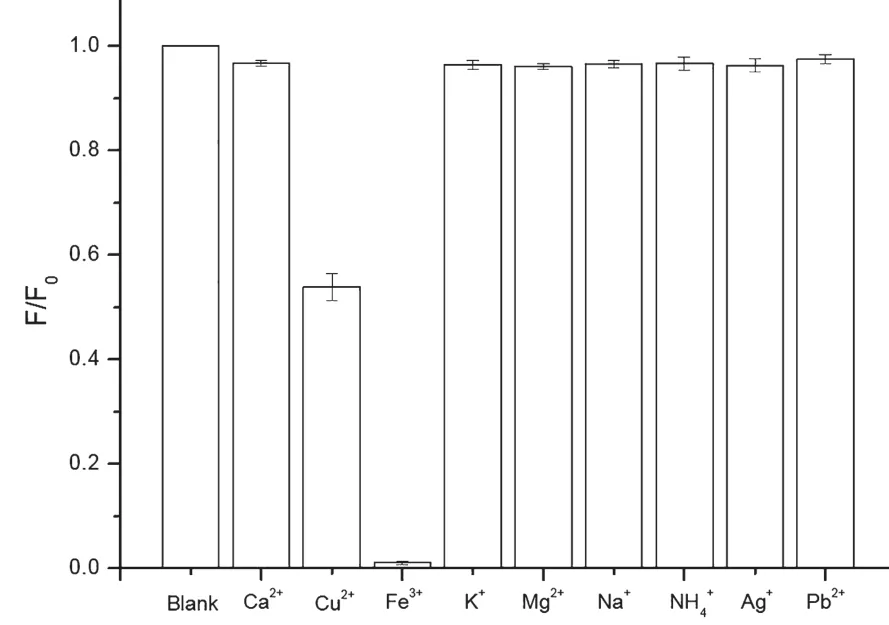
图6 不同金属离子对CDs荧光强度的影响,
2.5 CDs对金属离子敏感性分析
图7是CDs对Fe3+的敏感性测试,从图中可以发现随着Fe3+金属离子的浓度增加,CDs溶液的荧光强度呈现递减趋势,此外利用Stern-Volmer方程对所得数据进行拟合,以F0/F-1作为纵坐标,Fe3+浓度作为横坐标,发现荧光强度与Fe3+金属离子浓度在一定范围(0~1.0μmol/L)内呈线性关系,其线性方程为 F0/F -1=0.02131C(R2=0.990 1),这表明此类技术能够定量分析溶液中Fe3+金属离子浓度。通过计算,Fe3+的检出限为 0.021 6 μmol/L,故 CDs对 Fe3+的检出限非常低,具有一定的实用价值。
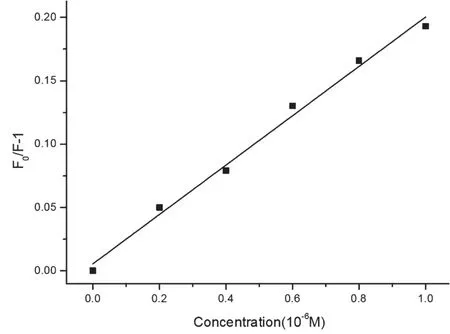
图7 CDs的F0/F-1和Fe3+浓度间的关系
3 结论
以壳聚糖为碳源合成的CDs光学性能优异,在紫外光下能产生明亮的蓝光,其平均离子粒径为8.3 nm。CDs与溶液中的Fe3+具有线性关系,其检出限为0.021 6 μmol/L,比一般检测方式的检出限更低,说明CDs具备作为新型Fe3+检测平台的可行性。

