电穿孔法转染人乳腺癌细胞MCF-7的条件优化研究
闫东科,许凤霞,吕平,李冬
(天津职业大学生物与环境工程学院,天津 300350)
乳腺癌是世界范围内常见的一种女性癌症。2017年全球统计数据表明,乳腺癌的发病率高达30%,排在首位,且乳腺癌的死亡率为14%,仅次于肺癌[1]。在我国,乳腺癌是导致女性癌症患者死亡的首要原因[2]。随着分子生物学的快速发展,寻找用于乳腺癌早期诊断和治疗的分子靶标已成为当前乳腺癌研究的热点。例如,针对人类表皮生长因子受体2(human epithelial growth factor receptor-2,HER-2)靶标的重组人源化单克隆抗体帕妥珠单抗[3](Pertuzumab,商品名Perjeta,帕捷特),已于2018年12月被我国国家食品药品监督管理总局(CFDA)批准上市,用作HER-2阳性转移性乳腺癌的靶向治疗药物。
而在癌症治疗分子靶标研究中,细胞转染技术是研究特定基因表达调控的重要技术手段之一。其中,电穿孔法作为一种常用的细胞转染技术,具有转染效率高、转染操作程序简单、快捷、实验重复性好、样本处理量大、无残留毒性以及适用范围广泛等优点,不仅可用于对干细胞、原代细胞、细胞系的转染,而且可用于对类器官、受精卵(胚胎)、活体(离体)组织器官[4]、昆虫[5]和藻类[6]以及植物种子[7]、花粉、原生质体等的转染。电转染是利用高于某一阈值的外加电脉冲刺激细胞膜,导致细胞膜磷脂双分子层结构重排,形成瞬时性孔洞,从而使外源生物大分子通过孔洞导入细胞的过程。也有研究认为,电脉冲对生物大分子与细胞膜的结合起促进作用,生物大分子是通过细胞膜的内吞作用进入细胞的[8]。影响电转染效率的因素众多,不同细胞系最佳电转染条件也不尽相同。本次实验以目前常用的乳腺癌细胞模型人乳腺癌细胞系MCF-7为研究对象,研究电转染时的电压、电脉冲时长、电脉冲次数、质粒浓度和细胞传代时间对其电转染效率的影响。
1 材料与方法
1.1 实验材料
1.1.1 质粒、菌株和细胞
pcDNA3.1(+)-EGFP质粒购自丰晖生物科技有限公司;大肠杆菌感受态菌株DH5α为本实验室保存;人乳腺癌MCF-7细胞购自碧云天生物技术有限公司。
1.1.2 主要试剂
无血清培养基Opti-MEM(即电转Buffer)和DMEM培养基均购自美国Gibco公司;胎牛血清购自美国HyClone公司;牛胰岛素购自康朗生物科技(上海)有限公司;去内毒素质粒大提试剂盒购自德国Qiagen公司;胰蛋白酶购自美国Sigma公司;酵母提取物、胰蛋白胨和氯化钠均购自美国Oxiod公司;氨苄青霉素购自天根生化科技(北京)有限公司。
1.1.3 主要仪器
电穿孔仪(NEPA21 Super Electroporator)及 2 mm电转杯购自日本 NEPA GENE 公司;Nano Drop 2000超微量分光光度计、CO2培养箱和高速冷冻离心机均购自美国 Thermo Fisher Scientific公司;倒置荧光显微镜购自日本Olympus公司;细胞计数仪购自博大博聚科技(深圳)有限公司;恒温细菌培养箱购自昕仪仪器仪表(上海)有限公司;恒温细菌培养摇床购自圣科仪器设备(上海)有限公司。
1.2 实验方法
1.2.1 转染质粒的准备
利用Ca2+诱导转化法将pcDNA3.1(+)-EGFP质粒导入DH5α感受态细胞,并将菌体涂布在LB平板(氨苄青霉素浓度为100 μg/mL)上,37 ℃恒温细菌培养箱内培养过夜,挑取单克隆菌落至5 mL LB液体培养基(氨苄青霉素浓度为100 μg/mL)中,37 ℃恒温细菌摇床中培养过夜,按照质粒大提试剂盒说明书提取扩增后的质粒。利用分光光度计测定质粒浓度,A260/A280为 1.8~1.9,测得质量浓度为 1.176 μg/μL。
1.2.2 细胞复苏与培养
从液氮罐中取出装有MCF-7细胞的冻存管,于37 ℃水中摇晃融化,加 4~5 mL DMEM 培养基混匀,1 000 r/min 离心 4 min,弃上清,加 1~2 mL 培养基重悬细胞,接种于 T25培养瓶中,加含 10% FBS、0.01 mg/mL牛胰岛素的 DMEM 培养基 6~8 mL,于 37 ℃、饱和湿度、5% CO2培养箱中培养,每隔1 d换液 1次,每2~3 d按1∶4比例传代1次。
1.2.3 MCF-7细胞的电转染
融合度为80%~90%的MCF-7细胞在经0.25%胰蛋白酶(含0.01% EDTA)消化完全后,用电转Buffer Opti-MEM重悬细胞2遍以除去消化终止液中的血清,而后用细胞计数仪计数。NEPA21电穿孔仪(2 mm电转杯)悬浮电转时,要求100 μL的电转混合液中细胞数量不低于106个,质粒质量不少于10 μg。电转染时,将装有电转混合液的电转杯放入电转杯腔,按下“Ω”键测定电阻值(应处于30~50 Ω),按下“start”键执行电转程序,每组电转程序重复3次。电转完成后,细胞转入预热的培养皿中,置于CO2培养箱中培养,48 h后观察EGFP表达情况,计算电转染效率。
1.2.4 电转染效率观察
每组转染的MCF-7细胞培养48 h后,经0.25%胰蛋白酶(含0.01% EDTA)消化收集,制成相同体积的细胞悬液,于荧光显微镜下固定1个视野计算出可见光下细胞数,然后转换为荧光光源,计算出发绿色荧光的细胞数,按公式1计算转染效率。

1.2.5 不同条件对细胞转染效率的影响
分别在不同电压(100 V、125 V、150 V、175 V、200 V)、不同电脉冲次数(1~4次)、不同电脉冲时长(2.5 ms、5.0 ms、7.5 ms)、不同质粒浓度(0.377 μg /μL、0.565 μg/μL、0.778 μg/μL、0.985 μg/μL、1.176 μg/μL)、不同细胞状态(传代后 0 h、24 h、48 h、72 h)条件下对MCF-7细胞进行电穿孔转染,转染48 h后,分别计算细胞的转染效率。
1.2.6 统计学分析
利用SPSS 19.0软件对转染效率数值进行统计分析。相同条件下每组实验重复3次,所有组间数据都以平均数±标准差表示,两组间数据比较采用独立样本t检验,多组间数据比较采用单因素方差分析,P<0.05表示差异有显著性意义。
2 结果与分析
2.1 电压对转染效率的影响
当电脉冲次数为2次,电脉冲时长为5 ms,质粒浓度为1.176 μg/μL,按照表1中的电压值进行电转实验。由单因素方差分析可知,150 V电压条件下获得最大转染效率为66.20%±2.48%;从图1中可观察出电压自100 V增加至150 V时,转染效率呈递增趋势,但当电压升高至200 V时,由独立样本t检验分析可知,转染效率显著降低(P<0.05)。
当电压自100 V增加至150 V时,细胞膜上形成的瞬时性孔洞不断增多,MCF-7细胞获取外源质粒DNA的量不断增大,但当电压升至175 V和200 V时,电脉冲对细胞的损伤程度较大,细胞死亡率上升,表现为转染效率下降,从而使MCF-7细胞在150V时具有最大转染效率为(66.20±2.48)%。

表1 不同电压条件下人乳腺癌细胞MCF-7的电转染率

图1 不同电压条件对人乳腺癌细胞MCF-7电转染效率的影响
2.2 质粒浓度对转染效率的影响
当电脉冲次数为2次,电脉冲时长为5 ms,电压值为150 V,按照表2中的质粒浓度进行电转染实验。由单因素方差分析可知,质粒浓度为1.176 μg/μL条件下获得最大转染效率为66.20%±2.48%;从图2中可观察出随着质粒浓度的不断提高(0.377~0.985 μg/μL),转染效率相应提高,但当质粒浓度为1 μg/μL左右(0.985~1.176μg/μL)时,由独立样本t检验分析可知,质粒浓度的变化对细胞转染效率的影响不显著(P>0.05),提示电转染时质粒浓度存在饱和性问题,1 μg/μL很可能是其阈浓度。

表2 不同质粒浓度条件下人乳腺癌细胞MCF-7的电转染率
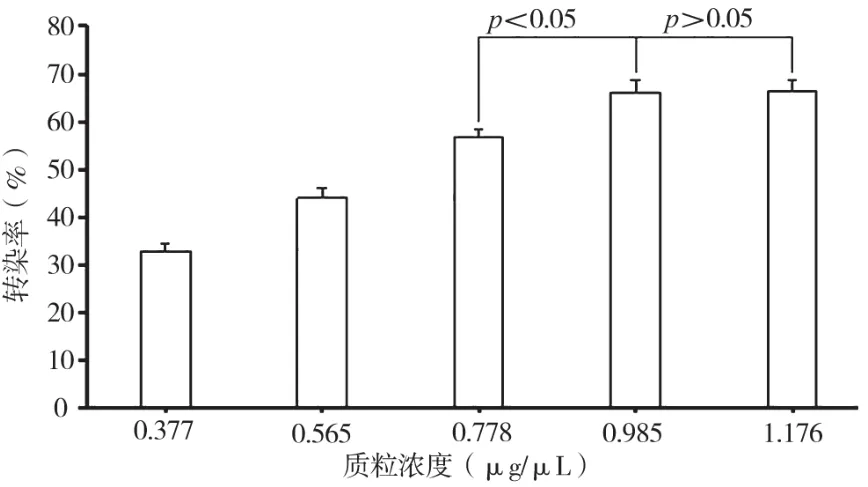
图2 不同质粒浓度条件对人乳腺癌细胞MCF-7电转染效率的影响
2.3 电脉冲次数对转染效率的影响
当电脉冲时长为 5 ms,质粒浓度为 1.176 μg/μL,电压值为150 V,按照表3中的电脉冲次数进行电转实验。由单因素方差分析可知,脉冲次数为2次时获得最大转染效率66.20%±2.48%;由图3和独立样本t检验分析结果可知,脉冲次数为2时与1次及3次时的转染效率差异均有显著性意义(P<0.05)。

表3 不同脉冲次数条件下人乳腺癌细胞MCF-7的电转染率

图3 不同脉冲次数对人乳腺癌细胞MCF-7电转染效率的影响
2.4 电脉冲时长对转染效率的影响
当电脉冲次数为2,质粒浓度为1.176 μg/μL,电压值为150 V,按照表4中的电脉冲时长进行电转实验。由单因素方差分析可知,脉冲时长为5 ms条件下获得最大转染效率66.20%±2.48%;由图4和独立样本t检验分析结果可知,脉冲时长为5 ms时与2.5 ms及7.5 ms时的转染效率差异均有显著性意义(P<0.05)。
电脉冲时长过短或电脉冲次数过少,细胞膜上无法形成或形成的瞬时孔洞不足,导致转染效率低下;电脉冲持续时间过长或电脉冲次数过多,电穿孔时产生热量过多,细胞死亡率升高或后续培养时失去生物学功能。电脉冲时长为5 ms,脉冲数为2次时,电转染MCF-7细胞可获得最大转染效率。

表4 不同脉冲时长下人乳腺癌细胞MCF-7的电转染率
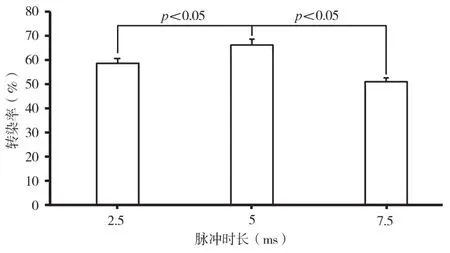
图4 不同脉冲时长对人乳腺癌细胞MCF-7电转染效率的影响
2.5 细胞状态对转染效率的影响
当电脉冲次数为2,脉冲时长为5 ms,质粒浓度为 1.176 μg/μL,电压值为 150 V,按照表5中的细胞传代后培养时间进行电转实验。由单因素方差分析可知,传代时间为24 h条件下获得最大转染效率66.20%±2.48%;由图5和独立样本t检验分析结果可知,传代时间为24 h时与48 h及72 h时的转染效率差异均有显著性意义(P<0.05)。

表5 不同细胞状态下人乳腺癌细胞MCF-7的电转染率

图5 不同细胞状态对人乳腺癌细胞MCF-7电转染效率的影响
3 结论
本研究结果表明,在电压150 V、质粒浓度1 μg/μL左右、脉冲数2次、脉冲时长5 ms、传代时间 24 h时,电穿孔人乳腺癌细胞MCF-7可获得最大转染效率。本研究通过优化MCF-7细胞的电转染条件,显著提高了MCF-7细胞的转染效率,为MCF-7细胞株的相关基础研究和乳腺癌临床靶向治疗提供了实验参数。

