粗壮脉纹孢菌固态发酵对菜籽粕营养品质的改善
于新颖 魏长浩 余诚玮 范亚苇 邓泽元
(南昌大学 食品科学与技术国家重点实验室 南昌330047)
菜籽粕是菜籽经榨油后剩下的富含蛋白的副产物,是一种优良的植物蛋白源。菜籽粕蛋白含量约35%~42%[1],其它营养成分含量也十分丰富,是一种优秀的饲料来源[2-3]。我国每年生产菜籽粕约700万t[4],产量大,营养价值高,目前主要应用于饲料。菜籽粕含有较高抗营养因子,如硫甙、单宁、植酸等。使用未脱毒的菜籽粕喂养家禽家畜,不但影响日粮适口性,蛋白质、碳水化合物等营养物质的吸收利用,而且可能使仔猪出现腹泻,甚至造成脏器的损伤,限制了菜籽粕作为饲料的应用[5-6]。微生物发酵菜籽粕不仅能降低抗营养因子,提高粗蛋白含量,还能将高分子质量蛋白降解为小分子的肽类,发酵产生的氨基酸在某种程度上平衡氨基酸的比例,发酵产生的各种消化酶可提高饲料中营养成分的利用率,因此微生物发酵菜籽粕具有广泛的应用前景[7-8]。
粗壮脉纹孢菌是本实验室从江西传统食品中提取、纯化得到的菌种[9]。该菌有较强的生产类胡萝卜素的和降解粗纤维的能力[10],且菌体生长所需的条件简单,原料成本低,发酵周期短,实际生产过程易控制,极具开发价值[11-12]。粗壮脉纹孢菌对农副产物蛋白质降解的研究甚少,是否对菜籽粕的抗营养因子有降解作用也不了解。本试验工作人员利用粗壮脉纹孢菌固态发酵菜籽粕,通过测定菜籽粕在发酵过程中蛋白质等营养成分、抗营养因子含量的变化,探讨通过粗壮脉纹孢菌提高菜籽粕的利用价值。
1 材料与方法
1.1 材料与试剂
菜籽粕由八维生物科技有限公司提供;粗壮脉纹孢菌(Neurospora crassa CGMCC3088)由本实验室筛选保存。
牛血清蛋白,北京索莱宝科技有限公司;植酸二钾,sigma试剂公司;氯化钯,天津市化学试剂研究所;盐酸,天津市大茂化工试剂厂;丙酮,上海瑞捷化学试剂有限公司;无水乙醇,西陇科学股份有限公司;磺基水杨酸,天津市恒兴化学试剂制造有限公司;考马斯亮蓝,上海蓝秀科技发展有限公司;柠檬酸铁铵,西陇化工股份有限公司。上述试剂均为分析纯级。
1.2 仪器与设备
海能K9860全自动凯氏定氮仪,山东海能科学仪器有限公司;F600粗纤维测定仪,山东海能科学仪器有限公司;722E型可见分光光度计,上海光谱仪器有限公司;L-8900氨基酸分析仪,日本日立公司;马弗炉,上海佳展仪器设备有限公司;HH-4数显恒温水浴锅,常州国华电器有限公司;BSD-YF2200智能精密摇床,上海博讯实业有限公司医疗设备厂;HPX-160BSH恒温恒湿箱,上海新苗医疗器械制造有限公司。
1.3 方法
1.3.1 发酵菜籽粕的制备 菜籽粕需粉碎过60目筛,称取10 g原料与16mL水充分混合,灭菌后加入4mL菌体密度为1.305×106个/mL的孢子悬液,搅拌均匀。在30℃、70%湿度下培养,发酵至96 h,每隔12 h取样1次,于45℃烘干至恒重,粉碎后过60目筛,备用。
1.3.2 营养成分的测定
1.3.2.1 粗蛋白含量的测定 采用凯氏定氮法(GB 5009.5-2010)测定。
1.3.2.2 粗纤维的测定 采用国标GB/T6434-2006饲料中粗纤维的含量测定[12]方法。
1.3.2.3 类胡萝卜素含量的测定[13]取0.5 g原料用0.8mol/L HCl溶液润湿,后用水洗至中性,离心取滤渣。加入10mL丙酮,浸提30min,离心取上层清液,重复提取1次,合并两次提取液,用丙酮定容25mL,在461 nm处测定吸光度。类胡萝卜素含量的计算公式:
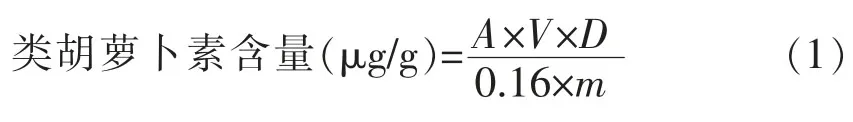
式中:A——类胡萝卜素最大吸收波长处的吸光值;V——提取所用的丙酮体积(mL);D——测定试样时的稀释倍数;m——培养物的质量(g);0.16——类胡萝卜素的克分子消光系数。
1.3.2.4 可溶性蛋白含量的测定 采用考马斯亮蓝G-250染色法[14]测定。取样品0.5 g于研钵中,加入5.0mL蒸馏水研磨均匀,离心吸取1.0mL上清液,加入5.0mL考马斯亮蓝G-250溶液,放置5min后于595 nm处测定吸光度。
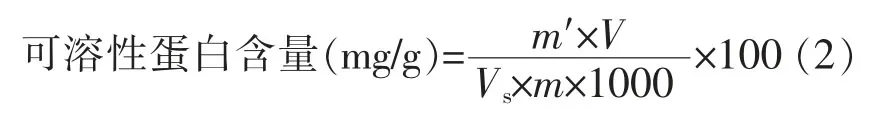
式中:m′——从标准曲线查得蛋白质的质量(μg);V——样品提取液总体积(mL);Vs——测定时所取样品提取液体积(mL);m——样品质量(g)。
1.3.2.5 酸溶性蛋白含量的测定 采用GB/T 22492-2008测定。
1.3.2.6 氨基酸组分的测定 酸处理、碱处理的前处理方法参照GB/T 18246-2000,用全自动氨基酸分析仪测定样品中的氨基酸含量。
1.3.3 抗营养因子的测定
1.3.3.1 植酸含量的测定 采用三氯化铁比色法[15]测定。称取样品0.5 g,加入1.2%HCl和10%Na2SO4混合液20mL,25℃浸提2 h,离心取上清液2mL,加入15%三氯乙酸2mL于4℃静置2 h。静置后,离心取上清液2mL,用0.75mol/L NaOH溶液调节pH值6.0~6.5。用蒸馏水稀释至30mL,取3mL稀释液加入0.03%FeCl3·6H2O和0.3%磺基水杨酸混合液1mL,混合均匀后于500 nm处比色。植酸含量计算公式:
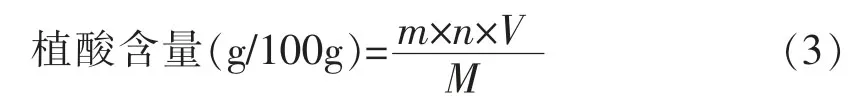
式中:m——利用标准曲线计算样品中植酸的质量(g);n——稀释倍数;V——提取液体积mL;M——样品干重(g)。
1.3.3.2 单宁含量的测定 采用GB/T15686-2008测定。称取0.5 g样品,加入10mL 75%二甲基甲酰胺溶液,浸提1 h,离心取1mL上清液,加入6 mL水和1mL 8 g/L氨溶液,混匀后,取1mL上清液,加入5mL蒸馏水和1mL 3.5 g/L柠檬酸铁铵溶液,振荡10 s,加入1mL 8 g/L氨溶液振荡10 s。室温下静置10min后,于525 nm处以水为空白对照,测定吸光度。式样的吸光值为添加柠檬酸铁铵的数值减去未加柠檬酸铁铵的数值。

式中:X——干物质中单宁酸的质量分数(%);c——从标准曲线得出的提取液中单宁酸的质量浓度(mg/mL);m——式样质量(g);H——样品水分含量(%)。
1.3.3.3 硫甙含量的测定 采用氯化钯显色法[16]测定。称取样品0.1 g,于90℃烘2 h,然后在沸水浴中干蒸10min。干蒸后向试管中加入7mL蒸馏水,继续蒸煮1 h。之后将样品冷却至25℃并定容10 mL。离心取2 mL上清液,分别加入4 mL 0.15%羧甲基纤维素钠溶液和2mL 8mmol/L氯化钯显色剂,在25℃下放置2 h,于540 nm处测定其吸光值A1。同时吸取2mL滤液,将2mL氯化钯溶液改成加入2mL水,其余步骤与上述相同,得到吸光值A2。
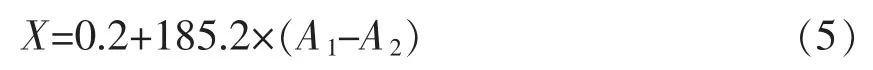
式中:X——硫甙的含量(μmol/g);185.2——根据多次试验得到的结果等经计算得出的一个常用的系数;0.2——修正值。
1.3.4 菜籽粕蛋白的SDS-PAGE分析
1)样品制备 称取菜籽粕0.5 g,用0.05 mol/L Tris-HCl缓冲液(pH 7.0)10mL浸提2 h,于5 000 r/min,4℃离心10min,取上清液测定蛋白质浓度,4℃保存备用。
2)蛋白的SDS-PAGE分析 SDS-PAGE电泳的分离胶12%,浓缩胶5%,电泳时,取40μL样品加入10μL上样缓冲液,混匀后在沸水中水浴5min。上样量20μL,样品在浓缩胶时电压80 V,进入分离胶后上升至120 V,当溴酚蓝距离下缘0.5~1.0 cm 时结束电泳。胶片用考马斯亮蓝R-250染色[17]。
2 结果与分析
2.1 菜籽粕在发酵过程中各种营养成分的变化
2.1.1 粗蛋白含量的变化从图1可知,新鲜菜籽粕粗蛋白含量为(44.62±0.28)g/100g,发酵96 h粗蛋白含量上升至(50.20±0.29)g/100g,提高了12.51%,且各时间段所测粗蛋白含量相对于原样(发酵0 h)中粗蛋白含量均存在极显著性的增加(P<0.01)。发酵0~12 h,粗蛋白质含量急剧上升,其原因可能是因粗壮脉纹孢菌大量繁殖,快速分解蛋白质和淀粉等成分,并转化为菌体蛋白[18];发酵12~84 h,粗蛋白质含量呈现缓慢增加的趋势;发酵84~96 h粗蛋白质含量又快速升高,这阶段粗壮脉纹孢菌已停止生长[19]。在发酵过程中消耗了菜籽粕中的脂质、糖类等碳源,相应增加了粗蛋白的比例[20]。
2.1.2 粗纤维含量的变化从图2可知,发酵96 h后菜籽粕粗纤维素含量由(20.70±0.02)g/100g降至(15.84±0.17)g/100g,粗纤维降解率达23.48%。从24 h开始粗纤维含量相对于原样(发酵0 h)中粗纤维含量均存在极显著性的下降(P<0.01),原因是粗壮脉纹孢菌生长的同时产生纤维素酶,降解样品中的粗纤维。
2.1.3 类胡萝卜素含量的变化 粗壮脉纹孢菌生长繁殖过程中增加了菜籽粕中的类胡萝卜素含量。如图3所示,0~84 h,类胡萝卜素含量整体呈上升趋势,在84 h时类胡萝卜素含量达到最大值(64.68±1.42)μg/100g。84~96 h类胡萝卜素含量开始下降,可能是因为菌体进入衰亡期,类胡萝卜素性质不稳定,部分类胡萝卜素被氧化,使得其含量开始下降[12]。
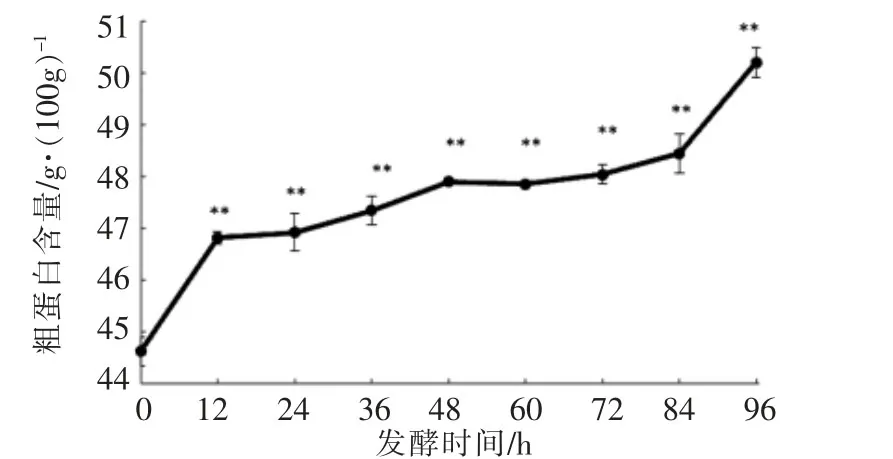
图1 发酵过程中粗蛋白含量的变化Fig.1 The changes of crude protein contents during fermentation

图2 发酵过程中粗纤维含量的变化Fig.2 The changes of crude fiber degradation contents during fermentation
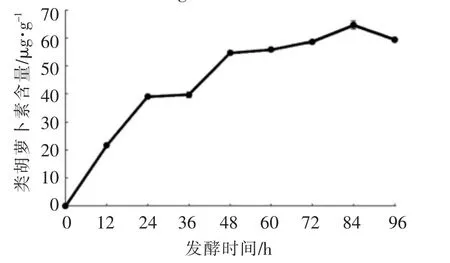
图3 发酵过程中类胡萝卜素含量的变化Fig.3 The changes of carotenoid contents during fermentation
2.1.4 可溶性蛋白含量的变化从图4可知发酵96 h,可溶性蛋白含量从(11.93±1.18)mg/g升至(39.67±2.54)mg/g,提高232.52%。各时间段可溶性蛋白含量相对于原样(发酵0 h)中可溶性蛋白含量存在极显著性的增加(P<0.01)。发酵0~36 h,可溶性蛋白含量急速增加,是因为粗壮脉纹孢菌为满足自身生长繁殖,大量分解底物的蛋白质,使其分解成氨基酸、多肽等物质。发酵36~72 h,可溶性蛋白基本保持不变。发酵72~96 h,可溶性蛋白含量又呈现上升趋势,可能是发酵后期,底物被大量消耗的同时菌体死亡并破裂,菌体的内源性蛋白等物质流出。
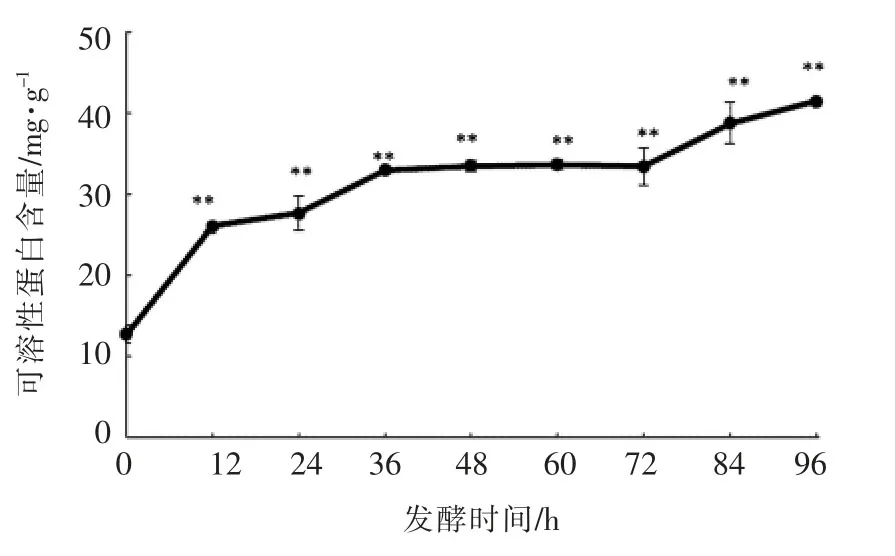
图4 发酵过程中可溶性蛋白含量的变化Fig.4 The changes of soluble protein contents during fermentation
2.1.5 酸溶性蛋白含量的变化 各时间段酸溶性蛋白含量相对于原样(发酵0 h)中酸溶性蛋白含量均极显著性地增加(P<0.01)。从图5可知,菜籽粕原料中酸溶性蛋白含量仅(6.33±0.03)g/100g,发酵24 h后酸溶性蛋白含量达到最大值(25.86±0.04)g/100g,提高了232.52%。发酵24~36 h酸溶性蛋白含量下降,原因是发酵过程中酸溶蛋白含量达到最高后,再延长发酵时间,粗壮脉纹孢菌可将蛋白质降解成肽类和氨基酸等,并可能继续降解为氨等挥发性成分,从而使发酵产品中酸溶蛋白含量下降[21],36 h后基本保持稳定。
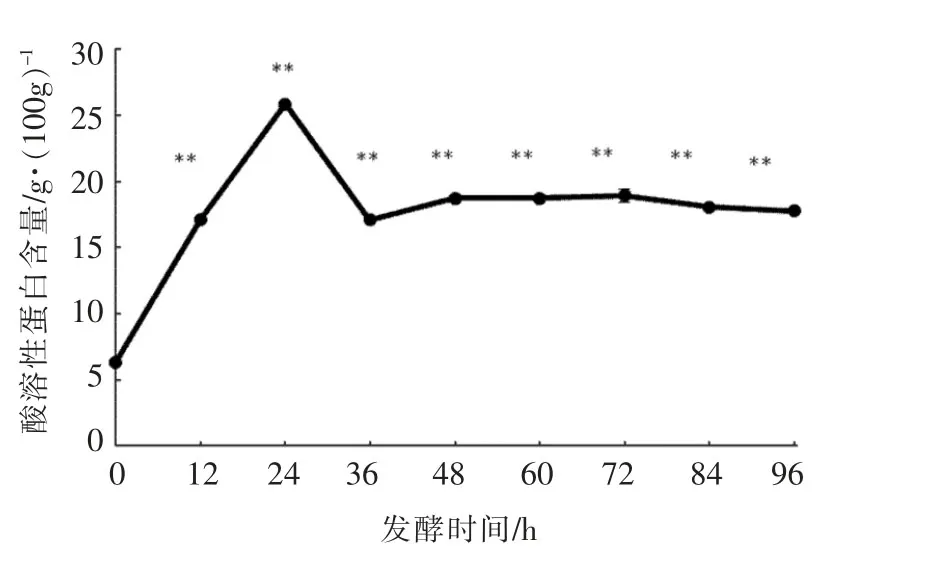
图5 发酵过程中酸溶性蛋白含量的变化Fig.5 The changes of acid soluble protein contents during fermentation
2.1.6 游离氨基酸含量的变化 由表1可知,发酵可大幅度提高菜籽粕中大部分游离氨基酸的含量,发酵前为2.60mg/g,发酵96 h后为21.41mg/g,提高了18.81mg/g。其中,谷氨酸变化最大,提高了6.65mg/g,总必需氨基酸的含量发酵后较发酵前提高了6.64mg/g。
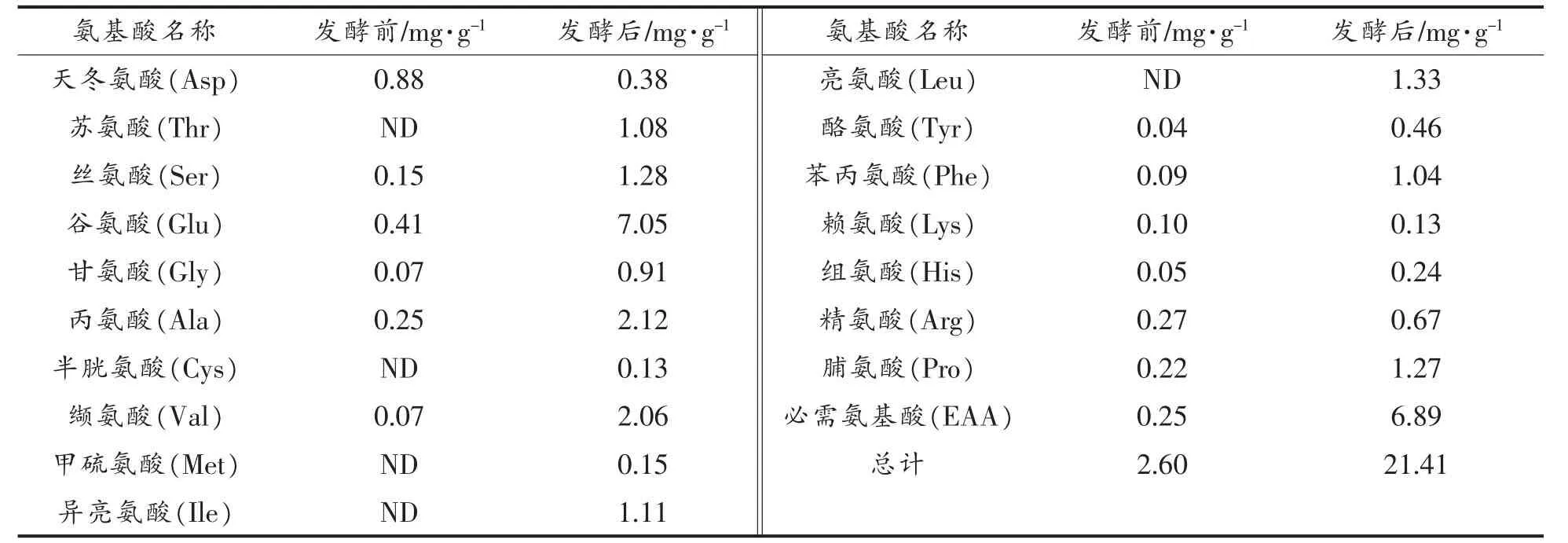
表1 游离氨基酸含量的变化Table1 The changes of free amino acid contents
2.2 抗营养因子含量的变化
发酵过程中单宁、植酸、硫甙含量均呈下降趋势,且存在显著性差异(P<0.05),表明粗壮脉纹孢菌固态发酵菜籽粕有减少菜籽粕中抗营养因子的作用。单宁降解率为24.98%,相对于肖萌[22]使用益生菌发酵菜籽粕单宁降解率为5.40%,Wang等[23]利用产芥子酸的真菌发酵菜籽粕单宁的降解率15.80%来说高出很多。植酸的降解率为10.20%,与肖萌[22]用益生菌发酵菜籽粕的植酸降解率10.10%相近,而低于孙林等[24]利用枯草芽孢杆菌发酵菜籽粕后植酸降解率为90.15%和陈娟等[25]利用多菌发酵使植酸降解率为43.90%。硫甙降解率为14.79%,与孙林等[24]利用蜡样芽孢杆菌发酵菜籽粕的硫甙降解率13.56%相近。相比于肖萌[22]利用混合益生菌发酵菜籽粕的降解率42.50%以及李燕[26]用多菌进行混菌发酵使硫甙脱除率达到92.12%要低,采用混菌发酵可能更有效降低菜籽粕中的抗营养因子。
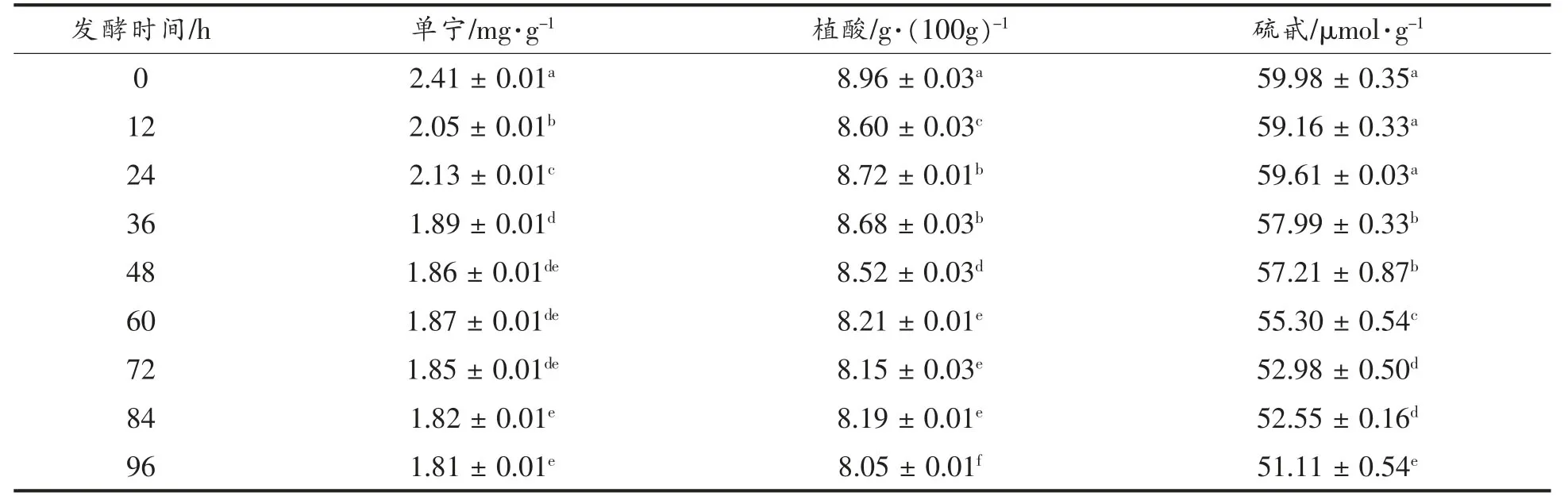
表2 抗营养因子含量的变化Table2 The changes of anti-nutritional factor contents
2.3 菜籽粕蛋白的SDS-PAGE分析
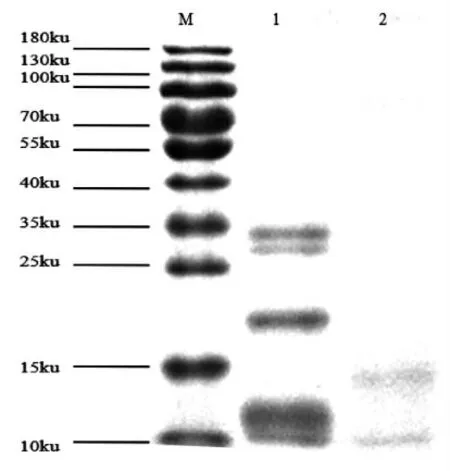
图6 SDS-PAGE分析Fig.6 SDS-PAGE analysis
从图6可看出,原料菜籽粕蛋白主要集中在10~35 ku,接种粗壮脉纹孢菌后,由于微生物开始利用菜籽粕中的营养物质生长,使得蛋白质降解,发酵96 h后,蛋白质分子质量降到15 ku以下,说明原料中的大分子蛋白经发酵被降解成小分子,这些小分子蛋白或多肽有利于动物胃、肠道的吸收利用[27]。
3 结论
粗壮脉纹孢菌固态发酵菜籽粕可使菜籽粕中的粗蛋白、酸溶性蛋白、类胡萝卜素,可溶性蛋白、总氨基酸含量增加,这些都利于动物的消化和吸收;同时也可使粗纤维含量以及单宁、植酸、硫甙等抗营养因子含量下降,有效解决了未经处理的菜籽粕用于饲料的安全性问题。本方法简单实用,可用于大批量菜籽粕饲料的生产,提高菜籽粕的利用价值和经济效益。

