碳源对manA基因突变大肠杆菌代谢的影响
李晓霞 王 欢 孙京利 张红星 谢远红
(北京农学院食品科学与工程学院 农产品有害微生物及农残安全检测与控制北京市重点实验室食品质量与安全北京实验室 北京102206)
甘露糖-6-磷酸异构酶(Mannose-6-phosphate isomerase)广泛存在于微生物中,如嗜糖假单胞菌(Pseudomonas saccharophi)[1]、放射形土壤杆菌(Agrobacter aerogenes)[2]、链霉菌(Streptomyces aerocolonigenes)[3]、大肠杆菌(Escherichia coli)[4]等。甘露糖-6-磷酸异构酶在植物遗传转化中作为选择性标记PMI/甘露糖系统也被广泛利用[5-7]。大肠杆菌中,甘露糖-6-磷酸异构酶在糖代谢系统中主要负责催化甘露糖-6-磷酸和果糖-6-磷酸之间的可逆性转化[8-9]。大肠杆菌通过甘露糖PTS系统磷酸化将甘露糖、果糖等转运至体内,甘露糖6-磷酸异构酶进一步将甘露糖-6-磷酸异构化成果糖-6-磷酸,从而促进糖的代谢:甘露糖的羟基从C-1位转移到C-2位,使甘露糖-6磷酸由醛式转变成酮式的果糖-6-磷酸,其C-1位上即形成自由羟基。果糖-6磷酸进入中心代谢途径被代谢吸收[10]。研究发现甘露糖-6-磷酸异构酶具有将甘露糖-6-磷酸转化为果糖-6-磷酸的能力,是糖酵解途径的中间体[11],甘露糖-6-磷酸异构酶在糖代谢中发挥着重要作用。然而甘露糖-6-磷酸异构酶在大肠杆菌不同碳源代谢过程中发挥的功能目前未见报道。
本研究采用二型内含子逆转录突变方法[12-14]构建manA基因突变大肠杆菌,分析manA基因突变菌株对碳源的利用情况以及对大肠杆菌糖代谢途径关键基因表达的影响,以探讨甘露糖-6-磷酸异构酶对大肠杆菌糖代谢的影响。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 大肠杆菌BL21(DE3)【基因型:F-ompT hsdS(rB-mB-)gal dcm(DE3)】菌株为本实验室保存。
pADC4k-C(kanrand chlr)载体,Sigma公司(TargeTronRBacterial Gene Knockout System Kit TA0100-3EA)。
1.1.2 培养基
1)LB培养基(g/L)氯化钠20 g,胰蛋白胨20 g,酵母浸粉10 g,固体培养基加入15 g琼脂。
2)甘露糖-LB培养基(g/L)氯化钠20 g,胰蛋白胨20 g,甘露糖10 g。
3)果糖-LB培养基(g/L)氯化钠20 g,胰蛋
白胨20 g,果糖10 g。
4)葡萄糖-LB培养基(g/L)氯化钠20 g,胰蛋白胨20 g,葡萄糖10 g。
5)淀粉-LB培养基(g/L)氯化钠20 g,胰蛋白胨20 g,淀粉10 g。
1.1.3 试剂与仪器 细菌基因组DNA提取试剂盒DP302-02、细菌质粒提取试剂盒DP103-02,天根生化科技(北京)有限公司;反转录试剂盒AK4302、Hind III和BsrG I限制性内切酶,宝生物大连有限公司;EZ-10柱式PCR产物纯化试剂盒B610363,生工生物工程(北京)股份有限公司;IPTG,北京全式金生物技术有限公司;TargeTronR基因敲除试剂盒TA0100-3EA,Sigma公司产品。超微量核酸蛋白测定仪,Analytikjena公司;7500 Fast荧光定量PCR仪,ABI公司;WBS-100微生物比浊法测定仪,北京先驱威技术开发公司产品。
1.2 研究方法
1.2.1 大肠杆菌manA基因Group II intron片段PCR扩增 根据GenBank中大肠杆菌甘露糖-6-磷酸异构酶(CAQ32089.1)基因序列,在sigmaaldrich.com/targetronaccess上进行manA基因Group II intron引物设计,引物序列见表1,引物由生工生物(上海)股份有限公司合成。
IBS-manA、EBS1d-manA、EBS2-manA、EBS Universal引物混合,混合体系见表2。
以TargeTronR基因敲除试剂盒中的Group II intron为模板,采用PCR方法扩增manA基因Group II intron片段,PCR扩增体系见表3。PCR扩增程序如下:预变性94℃,2min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,共30个循环;72℃,延伸2min。扩增的manA基因的Group II intron的PCR产物使用EZ-10柱式PCR产物纯化试剂盒纯化,纯化产物送生工生物工程(上海)股份有限公司测序。

表1 ManA基因Group II intron PCR引物Table1 ManA gene Group II intron PCR primers

表2 引物混合体系Table2 Primer mixing systems
1.2.2 基因突变重组载体的构建 PCR纯化产物(25 ng/μL)使用限制性核酸内切酶Hind III(20 U/mL)和Bsr G I(10 U/mL)在37℃,30min;60℃,30min;80℃,10min条件下酶切。酶切后使用EZ-10柱式PCR产物纯化试剂盒回收manA基因Group II intron酶切产物。

表3 ManA基因Group II intron PCR扩增反应体系Table3 PCR reaction system of manA gene amplification
使用T4 DNA连接酶将manA基因Group II intron酶切产物与线性化载体pADC4k-C按物质的量比3∶1在4℃连接12 h。采用热激法将连接产物转化大肠杆菌DH5α[11],在含100μg/mL氯霉素的LB固体培养基上筛选阳性转化菌落。挑取阳性转化菌落至含100μg/mL氯霉素的LB液体培养基,37℃震荡培养12 h。采用细菌质粒提取试剂盒DP103-02提取阳性转化菌株质粒,所得manA基因突变重组质粒命名为pADC4k-C-manA。
1.2.3 ManA基因突变大肠杆菌的构建 将pADC4k-C-manA重组质粒采用热激转化方法转化大肠杆菌BL21(DE3)[15]。在37℃恒温培养1 h,取100μL转化物加入3mL 25mg/mL氯霉素和1%葡萄糖的LB液体培养基中,37℃,180 r/min培养至OD600为0.2,加入2 mL含0.5 mmol/L IPTG的LB液体培养基中,30℃培养30min。将培养产物加入1mL 1%葡萄糖LB液体培养基中,30℃振荡培养1 h。取上述培养物涂布于含25μg/mL卡那霉素的LB固体培养基,30℃恒温过夜培养。
1.2.4 ManA基因突变大肠杆菌的鉴定 挑取阳性菌落在含25μg/mL卡那霉素的LB液体培养基中,37℃,180 r/min振荡培养过夜。采用细菌基因组DNA提取试剂盒DP302-02提取突变株基因组DNA。以提取基因组DNA为模板,使用特异性引物〔manA F(5′-CGGCGTTGACTGAACTTTA-3′)和manA R(5′-GAACAGACCGCTGTCTTCC-3′)〕进行PCR扩增,扩增程序如下:95℃变性2 min;94℃变性30 s,56℃退火30 s,72℃延伸90 s,共35个循环;72℃,5min。采用琼脂糖凝胶(1%)电泳法检测PCR扩增产物。确定manA基因突变的大肠杆菌命名为BL21(DE3)ΔmanA。
1.2.5 不同碳源培养基中大肠杆菌生长曲线测定将大肠杆菌BL21(DE3)和BL21(DE3)ΔmanA以108CFU/mL[16]的初始接菌量接种于含1%不同碳源(甘露糖、果糖、葡萄糖、淀粉)的LB液体培养基中,在微生物比浊法测定仪上37℃,180 r/min振荡培养12 h。每间隔2 h检测菌液OD600值,绘制生长曲线。
1.2.6 荧光定量PCR 大肠杆菌BL21(DE3)和BL21(DE3)ΔmanA以108CFU/mL[15]的初始接菌量接种于LB液体培养基中,在37℃,180 r/min条件下振荡培养12 h,采用玻璃珠-酚仿法[17]提取大肠杆菌BL21(DE3)和BL21(DE3)ΔmanA的总RNA,使用反转录试剂盒反转录合成cDNA。采用Real-time PCR方法检测大肠杆菌糖代谢相关基因的表达,引物序列见表4。Real-time PCR反应程序:95℃变性2min;95℃变性15 s,60℃退火1min,共40个循环。溶解曲线:从60℃到95℃,每1℃5 s的增量,确定引物特异性[18]。

表4 Real-time PCR引物序列Table4 Real-time PCR primer sequence
2 结果与分析
2.1 ManA基因Group II intron片段PCR扩增结果
通过设计特异性引物IBS-manA、EBS1dmanA、EBS2-manA、EBS Universal,采用PCR方法扩增manA基因Group II intron片段,结果如图1所示。通过PCR扩增到一条长度约为350个碱基的基因条带,与预期Group II intron片段产物长度一致。DNA测序结果表明该片段为大肠杆菌manA基因的Group II intron片段。
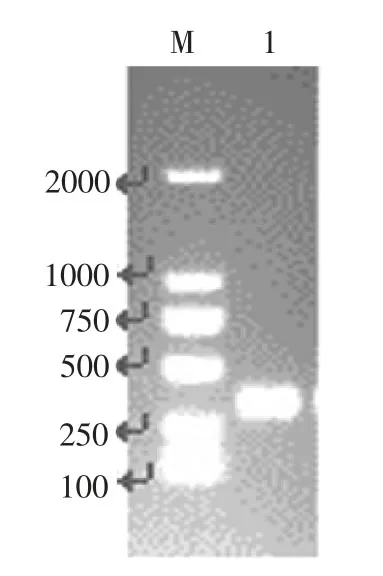
图1 ManA基因Group II intron片段PCR扩增Fig.1 PCR amplification of manA gene Group II intron fragment
2.2 BL21(DE3)ΔmanA 鉴定结果
根据大肠杆菌manA基因序列,设计特异性引物,采用PCR的方法验证基因突变。如图2所示,野生型大肠杆菌BL21(DE3)PCR扩增到长度为610 bp的基因片段,BL21(DE3)ΔmanA突变菌株PCR得到长度约为2.6 kb的DNA片段,表明BL21(DE3)ΔmanA菌株基因组manA编码基因中插入了Group II intron片段。DNA测序结果表明,Group II intron插入位点在manA基因读码框的277~278个碱基处,表明BL21(DE3)△manA菌株构建成功。
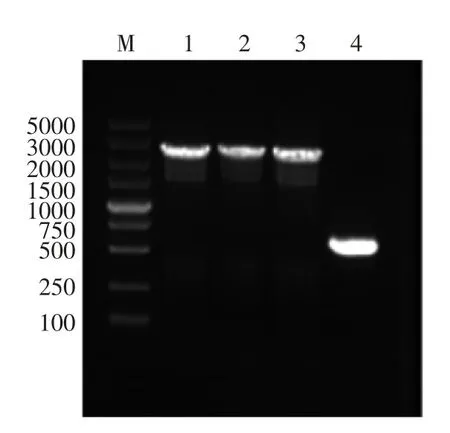
图2 PCR鉴定大肠杆菌manA基因突变Fig.2 PCR identification of Escherichia colimanA gene mutation
2.3 BL21(DE3)ΔmanA 在甘露糖培养基中的生长曲线
大肠杆菌BL21(DE3)ΔmanA和BL21(DE3)在含甘露糖LB液体培养基中的生长曲线如图3所示。在0~2 h内,BL21(DE3)和BL21(DE3)ΔmanA的生长曲线相似,细胞生长无显著性差异性(P<0.05)。与BL21(DE3)菌株相比,BL21(DE3)ΔmanA菌株在4~12 h时细胞生长能力下降,生长趋势明显低于BL21(DE3)(P<0.05)。当进入稳定期,BL21(DE3)ΔmanA菌株的光密度显著低于BL21(DE3)菌株(P<0.05),表明manA基因的突变显著影响大肠杆菌对甘露糖的利用,导致突变菌株的生长能力下降。
2.4 BL21(DE3)ΔmanA 在果糖培养基的中生长曲线
如图4所示,0~4 h内,BL21(DE3)和BL21(DE3)ΔmanA菌株的生长无显著性差异(P<0.05);6~12 h,BL21(DE3)ΔmanA菌株的细胞生长能力显著性低于BL21(DE3)(P<0.05),对果糖的利用率低。
2.5 BL21(DE3)ΔmanA菌株在葡萄糖培养基中的生长曲线
如图5所示,当BL21(DE3)ΔmanA菌株在含葡萄糖的LB液体培养基中生长时,BL21(DE3)ΔmanA菌株在对数期和稳定期对葡萄糖的利用与对照菌株BL21(DE3)无显著性差异(P<0.05),表明编码甘露糖-6-磷酸异构酶基因的突变不影响大肠杆菌对葡萄糖的利用。
2.6 BL21(DE3)ΔmanA菌株在淀粉培养基中的生长曲线
在以淀粉为碳源的LB液体培养基中生长时,0~2 h,BL21(DE3)ΔmanA菌株和BL21(DE3)对淀粉的利用没有显著性变化(P<0.05)。在4~12 h,BL21(DE3)ΔmanA菌株快速利用淀粉并加速细胞的生长,使得BL21(DE3)ΔmanA菌株对淀粉的利用显著高于BL21(DE3)(P<0.05),说明manA基因突变导致大肠杆菌对淀粉的利用率提高。
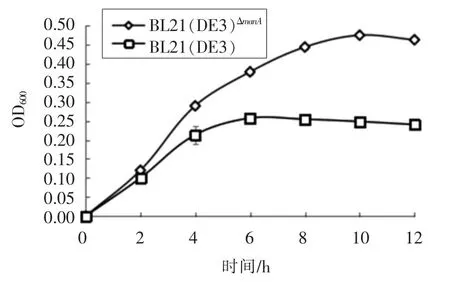
图3 BL21(DE3)ΔmanA菌株与BL21(DE3)在甘露糖-LB中的生长曲线Fig.3 The growth curve of BL21(DE3)ΔmanA and BL21(DE3)in mannose-LB
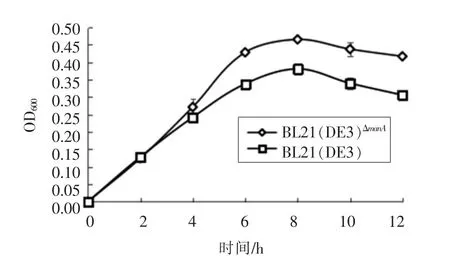
图4 BL21(DE3)ΔmanA菌株与BL21(DE3)在果糖-LB中的生长曲线Fig.4 The growth curve of BL21(DE3)ΔmanA and BL21(DE3)in fructose-LB
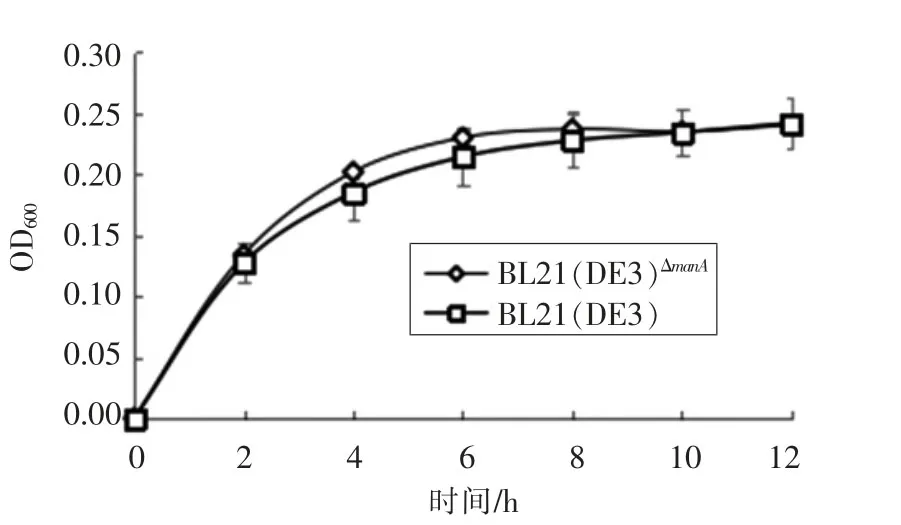
图5 BL21(DE3)ΔmanA菌株与BL21(DE3)在葡萄糖-LB中的生长曲线Fig.5 The growth curve of BL21(DE3)ΔmanA and BL21(DE3)in glucose-LB
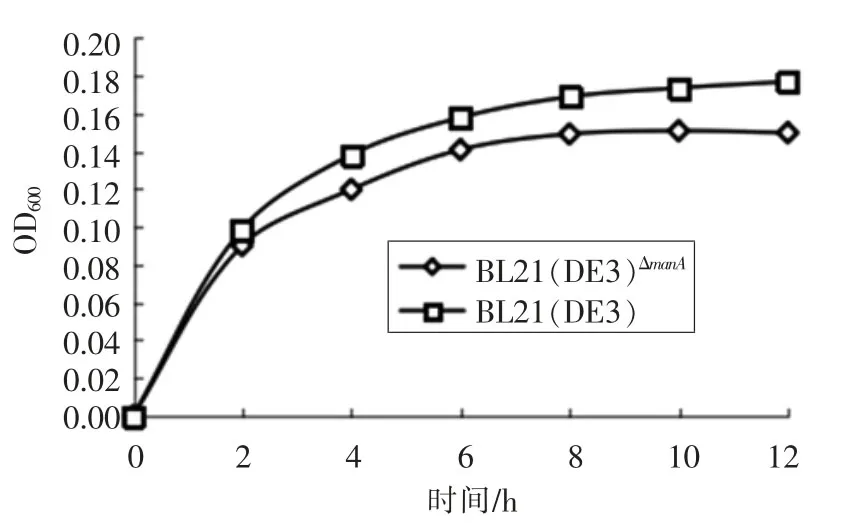
图6 BL21(DE3)ΔmanA菌株与BL21(DE3)在淀粉-LB中的生长曲线Fig.6 The growth curve of BL21(DE3)ΔmanA and BL21(DE3)in starch-LB
2.7 BL21(DE3)ΔmanA菌株糖代谢关键基因表达
采用Real-time PCR检测BL21(DE3)ΔmanA菌株中糖代谢相关基因的表达,结果见图7。大肠杆菌manA基因突变导致在转录水平上,manA基因表达极显著降低(P<0.05)。同时,manA基因突变导致编码大肠杆菌甘露糖磷酸转移酶IIABMan、IICMan、IIDMan亚基的manX、manY和manZ基因的表达量全部显著性下调。甘露糖代谢过程中的两个关键酶,D-甘露酸脱水酶/甘露酸脱水酶编码基因uxuA和果糖还原酶编码基因uxuB表达的显著降低,表明甘露糖-6-磷酸异构酶的功能缺失造成甘露糖磷酸转移酶PTS系统的变化;同时,manA基因的突变引起6-磷酸果糖激酶I亚基的编码基因(pfkA)的低表达(P<0.05),并且水解淀粉的α-淀粉酶编码基因malS的显著性上调表达(P<0.05),促进manA突变菌株对于淀粉的高效利用。
3 讨论
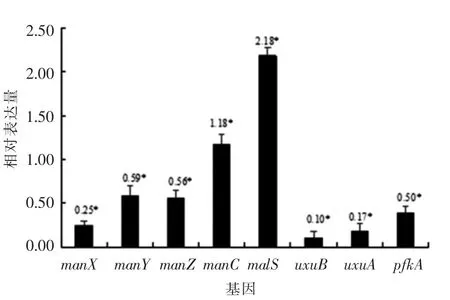
图7 BL21(DE3)ΔmanA 大肠杆菌糖代谢相关基因的表达Fig.7 Expression of glucose metabolism genes in Escherichia coli
大肠杆菌中,甘露糖-6-磷酸异构酶在碳源的代谢过程中负责糖的异构化[19]。采用II型内含子逆转录突变方法突变编码甘露糖-6-磷酸异构酶的manA基因,发现BL21(DE3)ΔmanA菌株在LB培养基中的生长状况与原始菌株无显著性差异(结果未显示),而对甘露糖的利用率显著性降低(图3)。在大肠杆菌中,甘露糖的代谢主要是由PTS系统中亲水亚基IIAB负责磷酸化,疏水亚基IIC负责內质化,甘露糖被甘露糖-6-磷酸异构酶异构化成6-磷酸果糖[10]。当编码甘露糖-6-磷酸异构酶的基因突变后,在LB培养基中虽不影响菌株的生长,但在突变株中糖代谢相关基因的表达量不同(图7)。糖酵解的中间体合成受到抑制,代谢过程中必要的磷酸激酶基因的表达量显著降低(图7),造成甘露糖的利用率降低。当编码甘露糖-6-磷酸异构酶的基因被突变后,引起甘露糖PTS系统的3个亚基的编码基因(manX,manY,manZ)表达量下降(图7),表明manA基因的突变造成甘露糖PTS系统发生变化。Rhiel等[20]的研究也有相似结果,IIABMan,IICMan和IIDMan3个亚基通过甘露糖磷酸转移酶系统调节甘露糖、葡萄糖、N-乙酰氨基葡萄糖和相关的己糖转运,甘露糖-6-磷酸异构酶促进其对糖的磷酸化吸收。在果糖的代谢中也检测到和甘露糖类似的结果(图4),由于果糖的代谢通过甘露糖PTS系统被磷酸化和运输,因此,果糖的后期代谢吸收与甘露糖的代谢途径相同[21]。
ManA突变菌株虽然引起糖酵解过程中的6-磷酸果糖激酶的基因(pfkA)的显著性低表达(图7),但对于葡萄糖的利用没有发生显著性变化(图3)。当manA基因被突变后,C-1位或C-2位的修饰发生变化,EII对于C-6位点修饰的葡萄糖和甘露糖具有高的磷酸化水平,相反,C-1或C-2位点的修饰能够抑制其被磷酸化[18]。葡萄糖的异构化虽然受到影响,但葡萄糖的代谢利用主要通过EIIGlc和葡萄糖透性酶作用消化吸收碳源和维持葡萄糖代谢的平衡[22]。然而,manA基因突变使得编码α-淀粉酶的malS基因上调2.18倍,α-淀粉酶的主要作用与α-1,4糖苷键水解淀粉[23],使淀粉被细胞代谢利用(图6)。
4 结论
采用II型内含子逆转录突变方法成功构建manA基因突变菌BL21(DE3)ΔmanA。通过研究BL21(DE3)ΔmanA菌株和野生型大肠杆菌的糖代谢吸收及糖代谢相关基因的表达,发现当以甘露糖和果糖为碳源时,菌株生长受到显著抑制;而以淀粉为碳源时,BL21(DE3)ΔmanA菌株的生长明显优于野生型大肠杆菌;当以葡萄糖为碳源时,manA基因突变对大肠杆菌生长无显著影响。进一步研究糖代谢基因表达,发现BL21(DE3)ΔmanA菌株中甘露糖代谢相关基因(manX,manY,manZ)的表达显著性降低;果糖代谢途径中6-磷酸果糖激酶I亚基的编码基因(pfkA)的表达显著降低;水解淀粉的α-淀粉酶的编码基因(malS)的表达显著性增高。结果表明manA基因突变影响大肠杆菌甘露糖、果糖和淀粉代谢途径中相关基因的表达,从而影响大肠杆菌对碳源(甘露糖、果糖、淀粉)的利用。

