庆大霉素适应性菌株遗传稳定性研究
郭慧玲 卢 洁 张文羿 张和平 孟和毕力格
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室奶制品加工农业部重点实验室 呼和浩特010018)
益生菌包括乳杆菌属、双歧杆菌属和革兰氏阳性球菌[1]。大量研究表明,它可以调节人体肠道菌群[2],增强免疫力[3],预防或改善腹泻[4]和乳糖不耐症等医疗保健作用[5-6]。乳酸菌被认为是安全性菌株,广泛用于发酵食品中。乳酸菌使用前必须经过严格的筛选,除了需要具有较好的发酵特性外,还需具备优良的遗传稳定性。欧盟食品科学委员会(SCFEC)指出“在婴幼儿食品中使用的益生菌必须经过表型和基因型双重验证才可以使用”[7]。更有研究者认为只有在1年连续培养过程中,表型和基因型都没有发生变化的益生菌才被认为具有稳定性[8]。从20世纪开始,随着抗生素在农业、畜牧业和医学领域中的大量使用,它对人类健康产生了巨大的影响[9]。到20世纪中叶,抗生素被卷入细菌耐药性和光谱耐药性的问题中,在致病菌[10]和益生菌[11]中都有报道存在耐药性。益生菌的安全性问题成为了人们首要关心的问题。
微生物适应性进化是对生物进化研究的一项新技术,它被称为“定向进化、实验室进化或驯化”[12]。微生物适应性进化使菌株在较短的时间内改变某些表型或生理特性(如菌体生长速度、底物消耗速度、耐高温等),并且基本不会影响菌株的其他优良性状[13]。该技术被广泛用于优良菌株的选育。目前国内外关于致病菌的微生物进化研究较多,对于乳酸菌的进化研究也逐渐增多。其中,Lenski等[14]将12株大肠杆菌在限制性培养基中连续进化20年,近50 000代,采用基因组重测序的方法分析其稳定性。Gregory等[15]研究了40株酿酒酵母菌,分别连续进化1 000代,采用基因组重测序技术分析突变位点,结果显示,在连续培养过程中,酵母菌发生的突变位点可以一直保持下去。Bas等[16]在限制性培养基中连续培养植物乳杆菌WCFS1,通过基因组重测序技术分析该菌株在长期进化过程中是否发生选择性突变。
基于上述理论,本课题组将干酪乳杆菌Zhang在抗生素环境下进行10个月的适应性进化实验。分别对其耐药表型和基因型进行监测,研究结果显示,干酪乳杆菌Zhang在1 200代时对庆大霉素的最小抑制浓度达到最大值32μg/mL,继续培养后最小抑制浓度没有发生变化。基因组的突变率在1 200代后基本保持不变[17]。同时有研究者报道,由于点突变引起的耐药性变化,其耐药性不发生转移[18]。作者认为得到的庆大霉素适应性1 200代干酪乳杆菌是安全性菌株。为了进一步分析庆大霉素适应性1 200代菌株的遗传稳定性和安全性,本研究采用连续传代培养的方法,将其在去庆大霉素的培养基中继续传代培养1 000代后,结合表型和基因型分析其遗传稳定性。
1 材料与方法
1.1 菌株和试剂
选取的菌株为在庆大霉素环境中连续传代培养1 200代的干酪乳杆菌Zhang[17],由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供。MRS Broth(CM0359)和ISO-SENSITEST Broth(CM0473),OXOID公司;LSM(90%MRS和10%IST)、庆大霉素,英国Sigma公司。
主要设备与仪器:无菌工作台(NSC-IIA-1200),日本;全自动高压灭菌锅(HA-300M),HIRAYAMA;恒温培养箱(LRH-500F),上海一恒科技有限公司;紫外-可见光分光光度计(ND-1000),美国NanoDrop公司;梯度PCR扩增仪,Applied Biosystems;Hiseq 2000高通量测序平台(Illumina)。
1.2 方法
1.2.1 菌株的传代培养和保藏 将在庆大霉素中进化1 200代的干酪乳杆菌Zhang的3个平行菌株分别作为本试验的出发菌株,编号为Q-G-0-Zhang-1,Q-G-0-Zhang-2,Q-G-0-Zhang-3。每24 h以1%的接种量传入LSM培养基中[19],共传1 000代。每传200代,分别对3株菌进行保藏(甘油保藏和冻干菌粉保藏)。
1.2.2 传代菌株生长曲线的测定和生长代数的计算 将3株0代菌株分别活化后,以1%的接种量接入空白的LSM培养基中,测定生长曲线。每2 h测定活菌数,在波长600 nm处的吸光值和pH值。通过生长曲线确定3株菌的生长规律,计算生长代数。生长代数=log2(Nf/N0),式中Nf是菌株进入稳定期活菌数,N0是初始接种菌株的活菌数[17]。
1.2.3 传代菌株的纯度检测 每200代对3株菌进行革兰氏染色,用显微镜观察菌体形态的变化。同时提取细菌DNA,采用细菌DNA提取试剂盒(QIAGEN),具体方法参照试剂盒使用说明书。使用提取的细菌DNA进行16S rRNA扩增,退火温度58℃,对扩增产物进行检测并进行Sanger测序。测序结果用NCBI的Blast进行比对。
1.2.4 传代过程中的指标检测 每200代分别测定菌株在培养周期末的活菌数变化,在波长600 nm处的浊度变化以及对庆大霉素的耐药性变化。对庆大霉素的耐药性检测采用肉汤稀释法[20-21]。首先将传代菌株在固体培养基上划线培养48 h,挑取单菌落于5mL生理盐水中,至OD600在0.16~0.2之间,将其稀释500倍加入空白LSM培养基中,然后准确称取抗生素,配制不同浓度梯度的抗生素溶液,最后将抗生素溶液与菌液混合,48 h后读取MIC值。
1.2.5 传代菌株的全基因组重测序 将菌株QG-1000-Zhang-1活化,扩大培养,离心后用生理盐水洗菌3次,弃上清,液氮速冻,真空冷冻干燥,将冻干菌粉送往上海美吉生物有限公司,对样品进行基因组重测序。提取细菌基因组DNA,将高质量初始量为3μg的DNA使用高压氮气打断成200~300 bp的片段,采用T4聚合酶和3’-5’核酸外切酶进行双末端修复,然后将A碱基引入3’端,使DNA片段可以互补连接,纯化DNA片段并对DNA片段进行富集,最后对文库进行定量与验证,合格后采用Illumina的Hiseq2000高通量测序平台。
1.2.6 重测序数据处理 采用CLC Genomic Workbench V8.5.1分析基因组重测序的数据。对检测出的非同义突变位点所在基因的氨基酸序列与KEGG数据库进行比对,分析突变位点所在基因的功能和注释。
2 结果与分析
2.1 0代菌株生长曲线和代数计算
图1为Q-G-0-Zhang-1的生长曲线。测定的活菌数、浊度和pH值可以反映庆大霉素适应性菌株的生长规律。通过该菌株在一个生长周期的生长规律,计算生长代数。Q-G-0-Zhang-1在一个生长周期内是6.65代。
2.2 传代菌株纯度检测
2.2.1 16S rRNA序列分析 对16S rRNA序列测序,利用NCBI的比对功能,对所传菌株的物种进行鉴定。
以600代菌株为例,结果见图2。600代菌株检测结果显示为干酪乳杆菌。
2.2.2 细胞形态的观察 图3所示0代干酪乳杆菌Zhang和1 000代干酪乳杆菌Zhang在显微镜下的细胞形态,可以看出,细胞形态都为短杆状,单个或链状。1 000代与0代细胞形态差别不明显,基本一致,说明在去选择压力后连续进化1 000代后,细胞形态没有发生变化,较稳定。
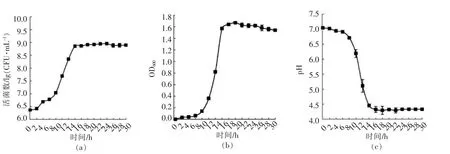
图1 Q-G-1000-Zhang-1的生长曲线Fig.1 Grow curve of Q-G-1000-Zhang-1
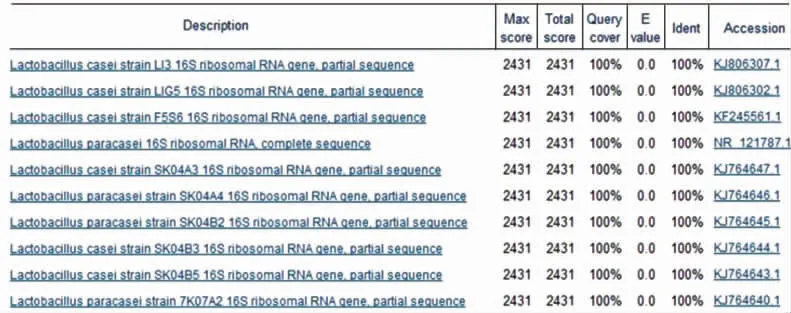
图2 Q-G-600-Zhang-1的NCBI比对结果Fig.2 Results of blast in NCBI

图3 传代菌株细胞形态Fig.3 Cell appearance of different generations
2.3 传代菌株的指标测定结果
2.3.1 活菌数 图4显示干酪乳杆菌Zhang在去庆大霉素环境中传代培养1 000代期间活菌数的变化情况。可以看出,200代生长周期末的活菌数比0代活菌数高,可能是由于在去抗生素的环境中,菌株的活菌数升高,继续传代培养,活菌数虽有些变化,但几乎趋于平稳,总数差异不明显。
2.3.2 浊度 图5显示传代菌株在0~1 000代期间OD值的变化情况。由图5可看出,在200代时OD值明显升高,随后在传代的过程中几乎趋于平稳的状态,与活菌数的变化趋势一致。
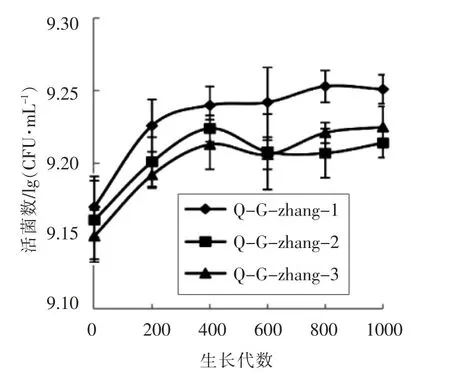
图4 传代菌株活菌数变化Fig.4 Viable counts change of different generations
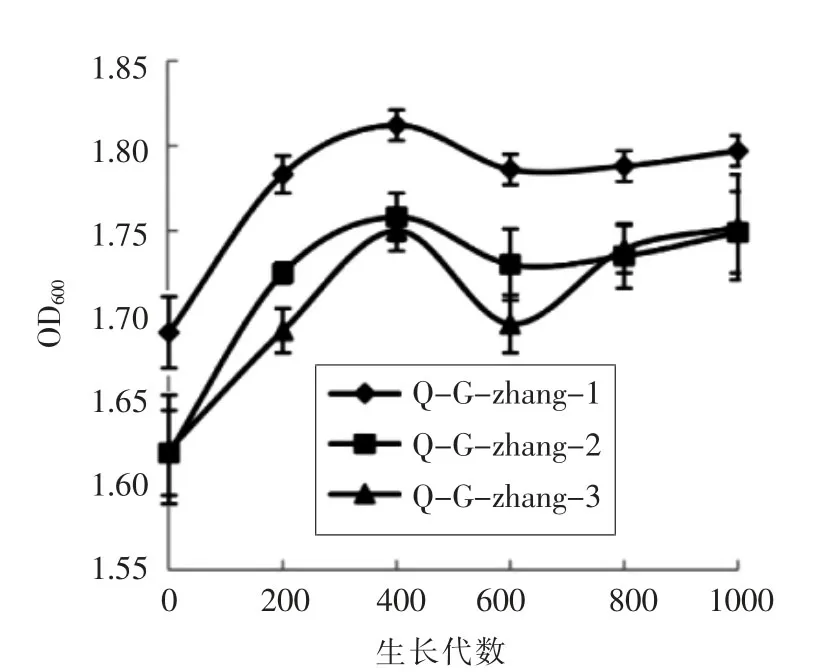
图5 传代菌株OD值变化Fig.5 OD changes of different generations
2.3.3 耐药性 表1显示菌株在去庆大霉素环境中连续传代培养1 000代期间,对庆大霉素的耐药性的变化情况。可以看出,菌株对庆大霉素的耐药性保持稳定状态,没有恢复到原始干酪乳杆菌Zhang对庆大霉素的MIC值。

表1 传代过程中菌株对庆大霉素的耐药性变化Table1 Changes in resistance to gentamicin of different generations
2.4 传代菌株基因组分析
2.4.1 高通量测序质量控制 图6显示测序结果中,长度为150~151 bp的序列数达到100%,其余长度的序列为0。PHRED值反映序列中碱基的错误率。PHRED值越大,碱基错误率越低。由图7可知,本研究中PHRED值在12~42之间,其中PHRED值大于20的序列占总序列的99.04%。当PHRED值为最大(42)时,对应的序列数为1 512 187,占比23.25%。最大占比为25.66%,对应序列数为1 668 984,PHRED值为41。图8为不同碱基位置的质量得分。所测序列不同碱基位置的PHRED值均大于30。不同位置碱基的质量较高,可进行下一步分析。
2.4.2 序列的修整 高通量测序数据下机后,低质量的序列与基因组参考序列匹配时会出现错配现象,在进行序列组装和匹配前,要对低质量序列进行修整。(根据序列质量评分进行修整)。表2是对菌株Q-G-1000-Zhang-1进行修整的结果。修整后序列的长度变为147.5 kb,序列数为6 478 514,修整率为0.41%。
表3是测序序列与参考序列的匹配结果,本研究将匹配序列长度比例设为0.5,就是至少有50%的匹配序列与参考序列相匹配,该序列才可以保留。也可以通过修改匹配序列长度比例值来提高匹配质量。本研究有98.53%的序列匹配到参考序列上,可与参考序列比对。
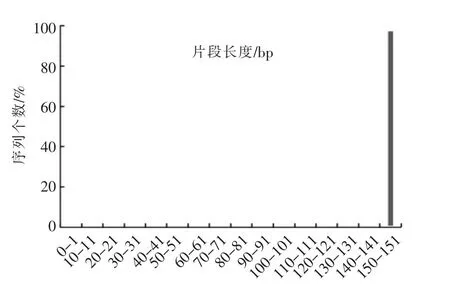
图6 测序结果序列长度分布图Fig.6 Distribution of sequence lengths
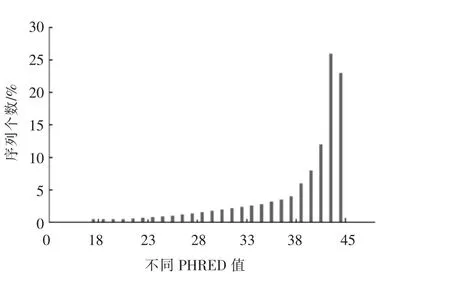
图7 不同PHRED值对应的序列数Fig.7 Distribution of the number of sequences corresponding to different PHRED values

图8 不同碱基位置对应的PHRED值Fig.8 Distribution of PHRED values at different base positions
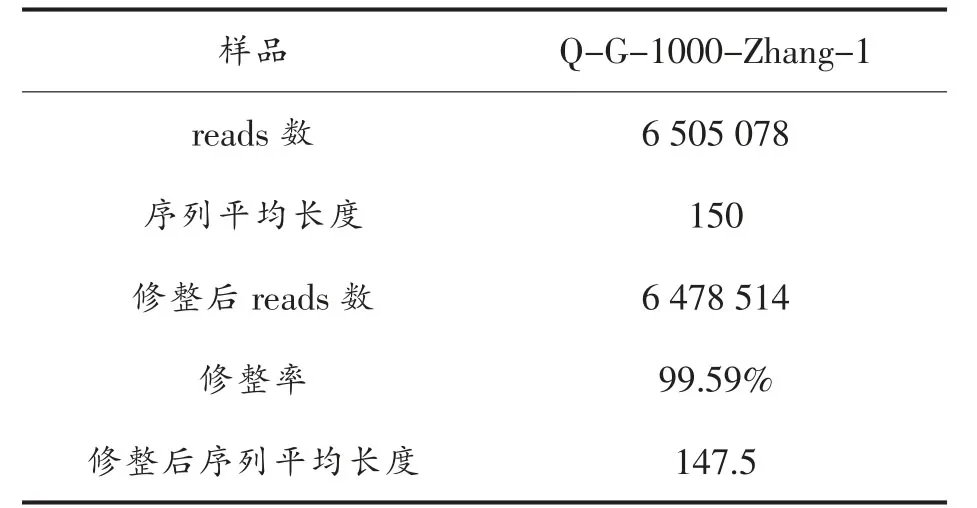
表2 Q-G-1000-Zhang-1测序序列修整结果Table2 Detailed trimresults of Q-G-1000-Zhang-1
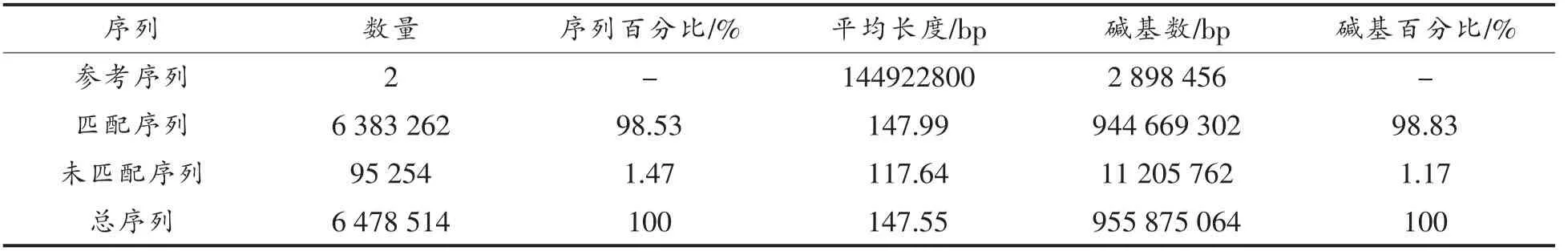
表3 Q-G-1000-Zhang-1测序序列匹配结果Table3 Mapping results of Q-G-1000-Zhang-1
2.4.3 基因组中基因突变检测结果 采用CLC Genomics Workbench 7.5软件对基因组测序结果中的基因突变类型进行检测,共检测到11个突变位点,其中4个同义突变和7处非同义突变。由于非同义突变一般可能引起功能基因的改变,因此只对7处非同义突变位点进行分析。7处非同义位点如表4和图9所示。所有突变位点都不在同一个基因上。干酪乳杆菌Zhang上有一个36 kb大小的质粒,检测结果发现所有突变位点不在质粒上。其中突变基因LCAZH_1039编码甘油二酯激酶参与脂质代谢(甘油酯代谢、甘油磷脂代谢)和次生代谢产物的合成。LCAZH_1154参与氧化磷酸化代谢。LCAZH_2480编码RNA聚合酶分别参与嘌呤代谢和嘧啶代谢。参与阳离子抗微生物肽的抑制作用的LCAZH_2238编码赖氨酰转移酶。赖氨酰转移酶催化L-[14 C]-O-赖氨酰,最终形成磷脂酰甘油。
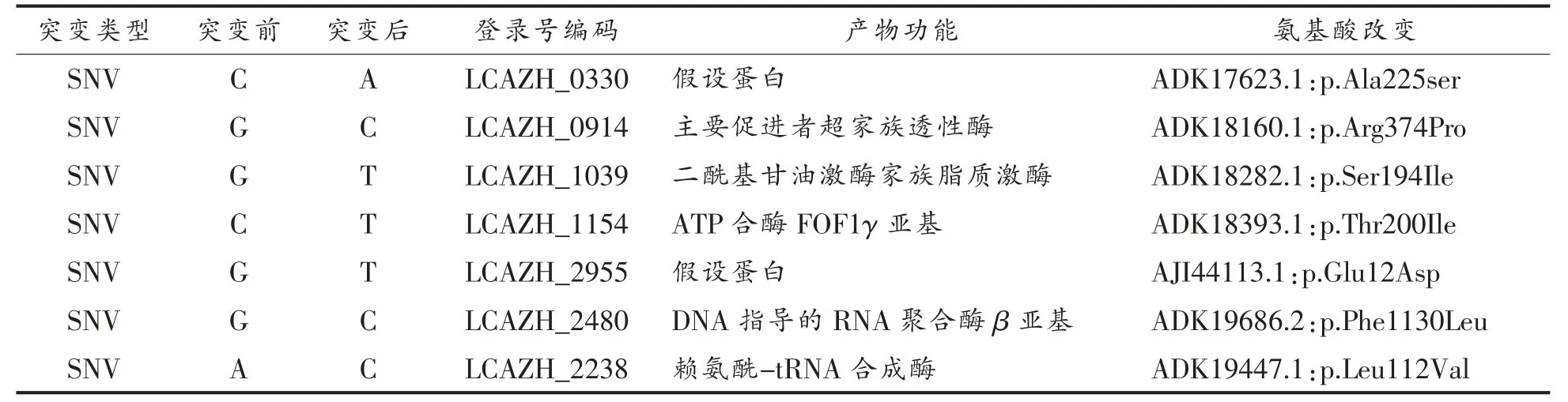
表4 Q-G-1000-Zhang-1非同义突变位点分布Table4 Identified Non-synonymous of Q-G-1000-Zhang-1
图9 Q-G-1000-Zhang-1突变位点分布图Table9 Distribution of gene mution in Q-G-1000-Zhang-1
3 讨论
微生物在受到外界环境或其它一些刺激后,会自发地产生自我保护机制,使其迅速地适应环境。益生菌也具有该特性。益生菌在人体发挥益生作用,必须能够活着经过胃(高酸环境)和小肠(胆盐环境),到达大肠并定植。对乳酸菌耐酸和耐胆盐胁迫的应激机理进行研究,可以提高乳酸菌在人体消化道的存活率,从而促使它发挥更好的益生功能。Munoz等[22]报道,先把戊糖乳杆菌MP-10培养在含有亚致死浓度的培养基中进行胁迫处理,对得到的耐药性菌株进行蛋白质组学研究,结果显示几种基因发生差异表达,菌株可以较好地适应各种环境,包括胃、肠道条件。
近年来,研究者对于益生菌和抗生素联合用于肠道疾病的治疗产生越来越浓厚的兴趣,在临床上取得一定的疗效。Kotowaka等[23]报道布拉酵母菌对儿童抗生素相关性腹泻的影响,采用双盲随机安慰剂对照试验,共269名儿童,其中132名儿童接受抗生素治疗并添加250mg布拉酵母菌冻干菌粉,137名儿童为安慰剂对照组,结果显示,益生菌组减少了患抗生素相关性腹泻的风险。该组儿童没有任何不良反应。由于抗生素成为益生菌新的环境胁迫,因此有必要对益生菌在抗生素环境下的应激反应机制以及菌株的安全性进行全面分析。
本研究将具有耐药性的干酪乳杆菌Zhang在去选择压力连续传代培养后,发现耐药表型和基因组高度稳定,虽然发生几处点突变,但是对其耐药性没有影响。该菌株进一步被确认为安全性菌株。本研究结果为该菌株的产业化应用提供理论参考。

