蛋清源活性肽对过氧化氢诱导的HEK293细胞谷胱甘肽抗氧化系统的影响
张 燕 魏汝君 马中苏 刘 珍 张 婷 刘静波
(吉林大学食品科学与工程学院 长春130062)
在需氧生物机体内,正常的氧化代谢活动都会产生自由基,而机体抗氧化酶系统(超氧化物歧化酶、过氧化氢酶及谷胱甘肽过氧化物酶等)以及抗氧剂(VE、VC、肌肽、谷胱甘肽等)能有效消除并使其维持在适宜的浓度[1-2]。适宜浓度的自由基执行着重要的生物学功能,并对机体产生有益的作用。然而,当机体随着年龄的增长或者长期处于某种不良环境中时,机体细胞内自由基的产生和清除机制就会失衡,即产生氧化应激。在氧化应激状态下,过量积累的自由基会对细胞成分及一些生物大分子进行攻击,如对DNA、蛋白质、碳水化合物、核酸、脂类和质膜进行攻击和破坏,进而导致细胞死亡和组织的氧化性损伤[3-4]。研究表明,自由基引发的氧化应激反应(oxidative stress,OS)与心血管疾病、癌症、神经退行性疾病、糖尿病及衰老等密切相关[5-9]。
谷胱甘肽(glutathione,GSH)是体内具有重要生理功能的活性三肽,由谷氨酸(glutamate,Glu)、半胱氨酸(cysteine,Cys)和甘氨酸(glycine,Gly)组成,为细胞内重要的抗氧化分子,可以清除细胞内自由基和过氧化氢,对维持细胞完整和抗氧化应激损伤起非常重要的作用。体内GSH主要由γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthethase,γ-GCS)和GSH合成酶催化合成,其中γ-GCS是最重要的调节和限速酶,调节细胞内GSH水平[10]。当细胞暴露于高浓度过氧化氢时,GSH在谷胱甘肽过氧化物酶(GPx)的作用下,把H2O2还原为H2O,而GSH本身被氧化为氧化型谷胱甘肽(GSSG)[11],GSH作为还原过程的底物而被大量消耗,GSH还会与活性氧等结合[12],因此细胞中GSH含量下降。有研究发现,高浓度H2O2可抑制抗氧化的γ-GCS表达[13],细胞在氧化应激状态下γ-GCS含量也会下降。本文通过建立过氧化氢诱导的HEK293细胞氧化损伤模型,应用Elisa法和RT-PCR法检测蛋清源活性肽对HEK293细胞GSH和γ-GCS表达的变化,探讨H2O2诱导的HEK293细胞氧化损伤与γ-GCS基因表达水平之间的关系,为揭示氧化应激抑制作用机制提供理论依据。
1 材料与方法
1.1 材料与试剂
蛋清源肽(>95%),上海强耀生物科技有限公司;荧光素钠(Fluorescein sodium)、Trolox(6-羟基-2,5,7,8-四甲基色烷-2-羧酸)、AAPH(偶氮二异丁脒盐酸盐)(分析纯),美国Sigma公司;人胚肾细胞(HEK293),中国科学院细胞库;DMEM培养基,美国GIBCO公司;胰蛋白酶、二甲基亚砜、EDTA,北京鼎国生物有限公司;过氧化氢(分析纯),天津化学有限公司;MTS单溶液细胞增殖检测试剂盒,美国Promega公司;GSH和GSSG检测试剂盒,上海碧云天生物技术有限公司;人γ-谷氨酰胺半胱氨酸合成酶(γ-GCS)酶联免疫分析试剂盒,上海酶联生物科技有限公司;EastepRSuper总RNA提取试剂盒,上海普洛麦格生物产品有限公司;反转录试剂盒,宝生物工程(大连)有限公司;SYBRRPremix Ex TaqTMII(Tli RNaseH Plus)实时荧光定量PCR专用试剂,宝生物工程(大连)有限公司。
1.2 仪器与设备
电子天平,瑞士METTLER TOLEDO公司;多功能酶标仪,美国伯腾仪器有限公司;倒置生物显微镜,日本尼康;CFX Connect实时荧光定量PCR仪,美国Bio-Rad;黑色孔板(透明平底),德国Greiner Bio-One公司;移液器,德国Eppendorf公司;超净工作台,苏州安泰空气技术有限公司;二氧化碳培养箱,上海力申科学仪器有限公司;低速离心机,安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 蛋清活性肽氧自由基吸收能力(ORAC)测定 ORAC试验参考实验室已建立的方法[13-14]并略作修改。反应在75mmol/L磷酸盐缓冲液(PBS,pH 7.4)溶液中进行。将试验分为对照组和试验组。试验组:吸取20μL样品溶液/Trolox和120 μL荧光素钠溶液(终浓度为70 nmol/L)至黑色96孔板各孔中混合反应,对照组使用20μL PBS替代样品溶液,每个样品设置3个重复。在37℃下预热2min,然后用多道移液器快速加入60μL AAPH溶液(终浓度为12mmol/L)启动反应,随即将黑色96孔板放入酶标仪中,在37℃下检测记录。相邻两个测定点之间的时间间隔为2min,每次读数前振板2 s,连续测定180min(荧光衰减趋于稳定为止)。设置酶标仪的激发波长为485 nm,发射波长为520 nm。AAPH自由基作用下的荧光衰退曲线下面积计算公式为:

式中:f0——初始0 min时的荧光相对强度;fi——第i个测定点时的相对荧光强度。
样品的保护面积Net AUC计算公式为:

Trolox是维生素E的水溶性类似物,是一种常用的抗氧化剂和自由基清除剂。在ORAC法中Trolox溶液可作为阳性对照物和标准溶液。
ORAC值以Trolox值(Trolox equivalent,TE)来表示,单位为μmol/L TE/μmol/L,其计算公式为:

1.3.2 蛋清源活性肽对过氧化氢诱导的HEK293细胞GSH、GSSG及GSH/GSSG的影响 将HEK293细胞接种于6孔板中,细胞密度为5.0×105细胞/mL,每孔接种量1.5mL(每个浓度设置3个复孔),5%CO2培养箱中孵育24 h后,保护组加入250μL蛋清源活性肽WNWAD(终浓度为0.5,1,5μmol/L和10μmol/L)、WNW(终浓度为1,5 μmol/L和10μmol/L)、WAD(终浓度为1,5μmol/L和10mol/L)、WN(终浓度为1,5μmol/L和10 μmol/L),空白组和损伤组加入250μL培养基。5%CO2培养箱中继续孵育24 h后损伤组和保护组同时加入250μL终浓度为400μmol/L的H2O2溶液,空白组加入250μL培养基。继续孵育12 h后按照碧云天GSH和GSSG检测试剂盒(s0053)说明书进行操作。
1.3.3 实时荧光定量PCR
1.3.3.1 设计引物 引物由上海捷瑞生物有限公司设计并合成,γ-GCS和DAPDH引物序列见表1。
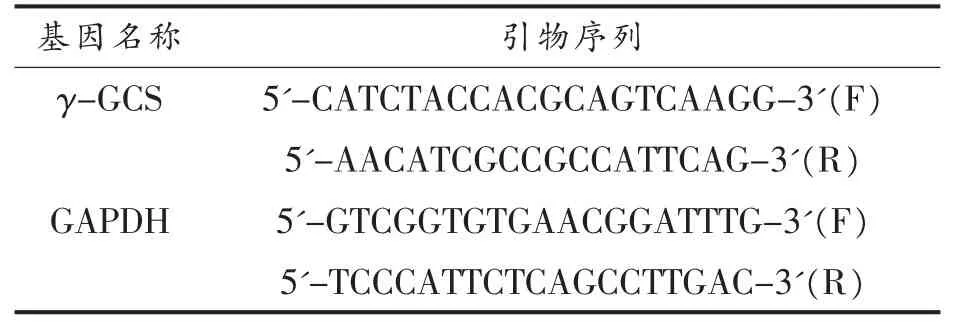
表1 引物序列图Table1 The sequence of the primer pairs
1.3.3.2 提取RNA 将密度为6.0×104细胞/mL的HEK293细胞接种于6孔板中,每孔接种终体积为2mL。设置对照组(1.5mL细胞混悬液+250 μL培养基)、损伤组(1.5mL细胞混悬液)和保护组(1.5mL细胞混悬液),每个浓度设置3个复孔。在37℃,5%CO2培养箱中孵育24 h后,保护组加入250μL不同终浓度的蛋清肽,其中,WNWAD(终浓度为0.1,0.3,0.5,1,5μmol/L和10μmol/L)、WNW(终 浓度1,5μmol/L和10μmol/L)、WAD(终浓度为1,5μmol/L和10μmol/L)、WN(终浓度为1、5和10μmol/L),同时损伤组加入250μL培养基,继续孵育24 h。然后,损伤组和保护组同时加入终浓度为400μmol/L的H2O2溶液250μL,对照组加入培养基250μL,继续孵育6 h后提取RNA。利用EastepRSuper总RNA提取试剂盒说明书提取总RNA,通过紫外分光光度计测定RNA浓度,通过电泳查看RNA的完整性。
1.3.3.3 反转录 SYBR Green qPCR法最多可使用1μg的Total RNA,用DEPC处理水将RNA含量调整到1μg,然后按照反转录试剂盒说明书去除基因组DNA,最后反转录成cDNA。实时荧光定量PCR仪中反应37℃15min,85℃5 s后取出cDNA,于-80℃保存备用。
1.3.3.4 实时荧光定量 各cDNA样品分别以GAPDH和γ-GCS为引物,进行定量PCR反应。PCR扩增反应体系为25μL,包含:SYBRRGreen I预混液(12.5μL)、GAPDH和γ-GCS正、反向引物各1μL、反转录制得的cDNA溶液4μL以及灭菌蒸馏水(8.5μL)配制混合物,充分混匀后反应。反应条件:95℃下30 s实现预变性,95℃下变性5 s、60℃下退火30 s,95℃下延伸15 s、60℃下退火30 s 40次循环。在调整基线周期和计算阈值,得出循环阈值(cycle threshold,Ct值)。最终结果以相对指数法(2-ΔΔCt)表示。
1.4 统计学处理
数据以平均值±标准差(mean±SD,n=3)来表示。使用数据处理软件SPSS19.0版处理,差异显著性通过单因素方差分析(ANOVA)来分析。
2 结果与分析
2.1 蛋清源活性肽的氧自由基吸收能力(ORAC活性)
氧自由基吸收能力(ORAC法)是普遍被接受的抗氧化能力评价方法,可以直接反映抗氧化剂阻断自由基链式反应的能力,是最接近人体生理系统真实反应情况的实验方法,同时也是对食品强化剂和其它植物性治疗药物进行质量控制和检测其抗氧化能力的标准方法。ORAC反应是典型的基于氢原子转移机制(HAT)的氧化过程,氢原子转移是自由基链式反应中的关键步骤,反应后会形成更加稳定的自由基[16]。
蛋清源活性肽在终浓度为5μmol/L时的荧光衰退曲线如图1所示。WNWAD及其结构改造肽(除AD肽)对AAPH引起的时间依赖型荧光衰减有显著影响,可明显减缓荧光衰减速度。对照组(PBS代替抗氧化剂)和试验组AD肽,荧光衰减速度最快,反应开始30min后,荧光衰减曲线趋于稳定,相对荧光强度接近0,而Trolox组和试验组WNWAD、WNW、WAD和WN荧光衰减较对照组均放缓,说明蛋清源活性肽WNWAD、WNW、WAD、WN都有一定的抗氧化活性。其中,五肽WNWAD的抗氧化能力最强,180min后,相对荧光强度接近0;WNW和WAD抗氧化能力次之,150min后,相对荧光强度趋于0;WN 110min后,相对荧光强度趋于0;而Trolox 55min左右相对荧光强度趋于0。在浓度为5μmol/L时,WNWAD的氧自由基吸收能力约为Trolox的5.69倍。WN、WAD、WNW的氧自由基吸收能力分别为Trolox的4.04,3.96,2.66倍。除肽AD外,其余4个蛋清肽WNWAD、WNW、WAD和WN的抗氧化能力均强于Trolox。
Hernandez-Ledesma等[1]测定了不同氨基酸的ORAC活性,结果色氨酸(Trp)残基的ORAC活性最强(ORAC值为4.649μmol/L TE),色氨酸(Trp)的强抗氧化活性可能与其吲哚基团的供氢能力有关。ORAC试验中偶氮类自由基(AAPH)热分解后可转化为过氧化自由基,与抗氧化剂发生反应。分析上述肽的氨基酸组成,可以发现具有抗氧化性的肽链(WNWAD、WNW、WAD、WN)中均含有色氨酸残基,色氨酸是芳香族氨基酸,其结构特殊,在反应中易失去氢原子而与自由基发生反应。当色氨酸存在于肽氨基酸序列中时,肽表现出一定的供氢能力;而肽AD序列中不存在色氨酸残基,没有抗氧化能力。
2.2 蛋清源活性肽对过氧化氢诱导的HEK293细胞GSH、GSSG及GSH/GSSG的影响
有研究表明,GSH能够改善细胞的还原状态,提高细胞的抗氧化能力[18]。GSSG在细胞中过量积累,使细胞氧化还原动态平衡遭到破坏,给生物体带来不良影响[19-20]。由图2及图3可以看出,过氧化氢诱导的HEK293细胞氧化损伤模型组细胞中GSH含量由(173.52±2.87)μmol/L降至(115.85±2.03)μmol/L(P<0.01),而GSSG含量显著升高,由对照组(0.90±0.08)μmol/L升至(33.23±0.68)μmol/L(P<0.01)。可见,在氧化应激状态下,GSH作为细胞内天然抗氧化剂,在受到氧化损伤作用后大量转化成GSSG,导致细胞内GSSG含量迅速增加。用蛋清源活性肽处理的保护组细胞中,GSSG含量与损伤组相比明显降低,在0.5μmol/L WNWAD作用下由(33.23±0.68)μmol/L降至(0.96±0.02)μmol/L(P<0.01),GSH含量与损伤组相比有不同程度的升高,说明蛋清源活性肽能够有效消除H2O2刺激机体产生的氧自由基,减少GSH转化成GSSG,从而降低GSSG含量,保持机体的稳态平衡。
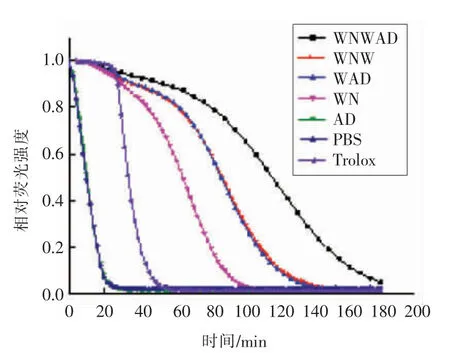
图1 蛋清源活性肽氧自由基吸收能力(ORAC法)Fig.1 Peroxyl radical scavenging activity(ORAC assay)of peptides from egg white
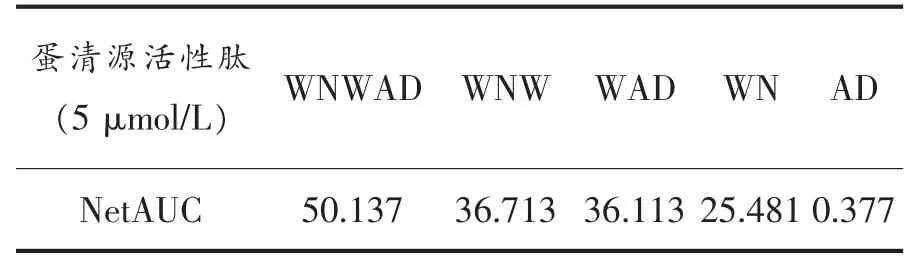
表2 蛋清源活性肽保护面积NetAUCTable2 The NetAUC of the peptides from egg white
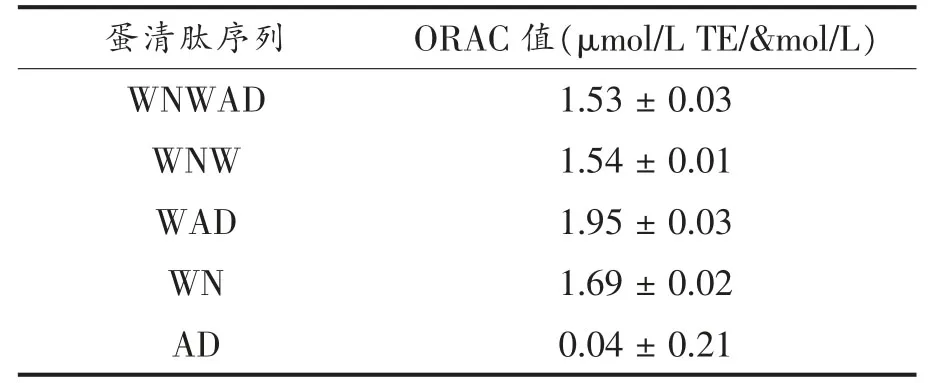
表3 蛋清源活性肽的氧自由基吸收能力(TEAC值)Table3 Oxygen radical absorbtion activity of peptides from egg white
在生物体内,GSH/GSSG比值约为100∶1时,机体处于稳恒性动态平衡[21]。稳定的GSH/GSSG的正常比值是维持细胞正常生理过程的一个关键指标,而且是细胞重要的抗氧化系统之一[27]。如图4所示,对照组细胞没有外界因素影响,处于平衡状态,其GSH/GSSG比值为192.69±0.08,说明细胞和整个机体处于稳态时的GSH/GSSG比值存在一定偏差。在H2O2处理过的损伤组细胞中,GSH/GSSG比值与对照组相比急剧降低(P<0.01),仅为3.49±0.68;而不同浓度蛋清源活性肽处理细胞后,GSH/GSSG比值不同程度升高。浓度均为1μmol/L的WNWAD、WNW、WAD和WN处理过的细胞GSH/GSSG比值分别为113.22±0.12,57.08±0.09,61.94±0.19,31.35±0.35,与损伤组比差异显著(P<0.01)。可见,蛋清源活性肽能够降低氧化应激损伤带来的危害,在一定程度上维持了GSH/GSSG比值的稳定。图3 蛋清源活性肽对HEK293细胞内GSSG含量的影响
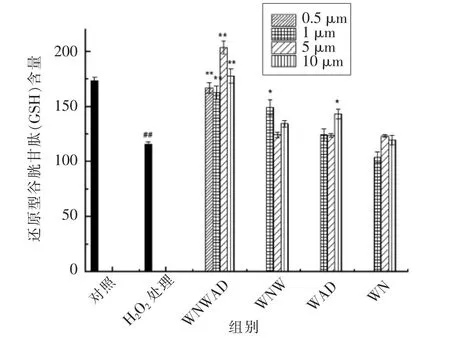
图2 蛋清源活性肽对HEK293细胞内GSH含量的影响Fig.2 The effect of peptides on the content of GSH in HEK293 cells
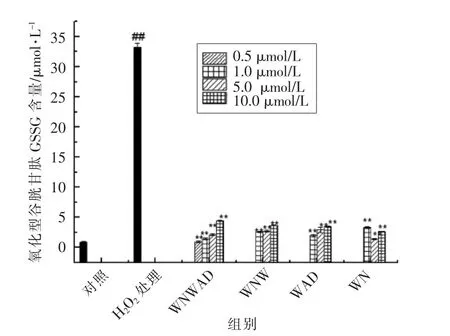
图3 蛋清源活性肽对HEK293 细胞内GSSG 含量的影响Fig.3 The effect of peptides on the content of GSSG in HEK293 cells
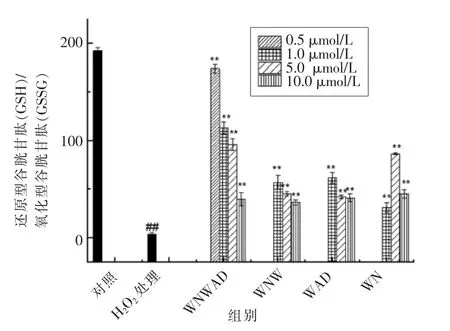
图4 蛋清源活性肽对HEK293细胞内GSH/GSSG比值的影响Fig.4 The effect of peptides on GSH/GSSG ratio in HEK293 cells
2.3 蛋清源活性肽对过氧化氢诱导的HEK293细胞γ-GCS mRNA表达的影响
用real-time PCR方法对HEK293细胞γ-GCS基因mRNA表达水平进行分析,试验中γ-GCS和内参GAPDH基因溶解曲线均呈单峰(图5左边单峰较低的曲线代表γ-GCS基因溶解曲线,右边单峰较高的曲线代表GAPDH基因),说明这2个基因引物特性较好,基因扩增曲线稳定,可用于进一步分析。
研究表明,γ-GCS含量和活性增加,能促进GSH合成速度,且γ-GCS表达水平会直接影响细胞中GSH含量[22-25]。在高水平的氧化应激作用下,γ-GCS抗氧化应激能力可能受到损害,使得γ-GCS表达降低而失去保护细胞的能力[24]。如图6所示,损伤组的细胞中,γ-GCS mRNA相对表达量为0.185,即表达量降为对照组的18.5%,差异具有统计学意义(P<0.05),γ-GCS基因表达受到明显的抑制。其中的氧化应激机理可能是γ-GCS基因表达下调,导致GSH合成减少,同时氧化应激产生的活性氧引起GSH消耗增加,最终导致细胞内GSH含量减少,GSH/GSSG稳态失衡。有大量研究γ-GCS与抗氧化有很大关系。刘立新等[26]研究表明参苦补肺方可以激活KLF2、Nrf-2、γ-GCS的活性,诱导GSH的大量生成来清除肺内过多的氧化物质。曹义甫等[27]研究了丁苯酞通过激活Nrf-2通路,上调γ-GCS的表达,进而“中和”ROS,缓解氧化应激对肾间质的损伤,延缓肾间质纤维化。尚立群等[28]研究表明安石榴苷可显著促进Nrf2/γ-GCS信号通路的活化,提高慢性支气管炎大鼠的抗氧化能力。本试验中不同浓度的蛋清源活性肽处理HEK293细胞后,γ-GCS mRNA相对表达量较损伤组都有一定程度的提高,浓度1,5,10μmol/L的WN对γ-GCS mRNA相对表达显著升高(P<0.01)。浓度5μmol/L的WN作用后,细胞中γ-GCS mRNA相对表达量最高,相对表达量为8.53。有研究报道,转录因子Nrf2能够在细胞核中与氧化应答元件结合,增强过氧化氢酶、γ-GCS等抗氧化酶的表达,增强机体的抗氧化性[29-33]。霍仕霞等[34]研究发现高良姜素能够增加γ-GCS表达量,从而激活Nrf2信号通路使相关抗氧化酶的表达量增加而起到抗氧化作用。蛋清源活性肽氧化应激抑制机理是否与Nrf-2通路有关,还需进一步验证。
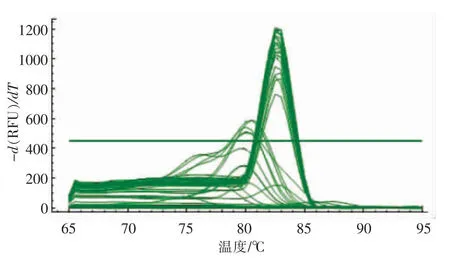
图5 γ-谷氨酰半胱氨酸合成酶、管家基因GAPDH溶解曲线Fig.5 Melt Peak ofγ-GCS and GAPDH
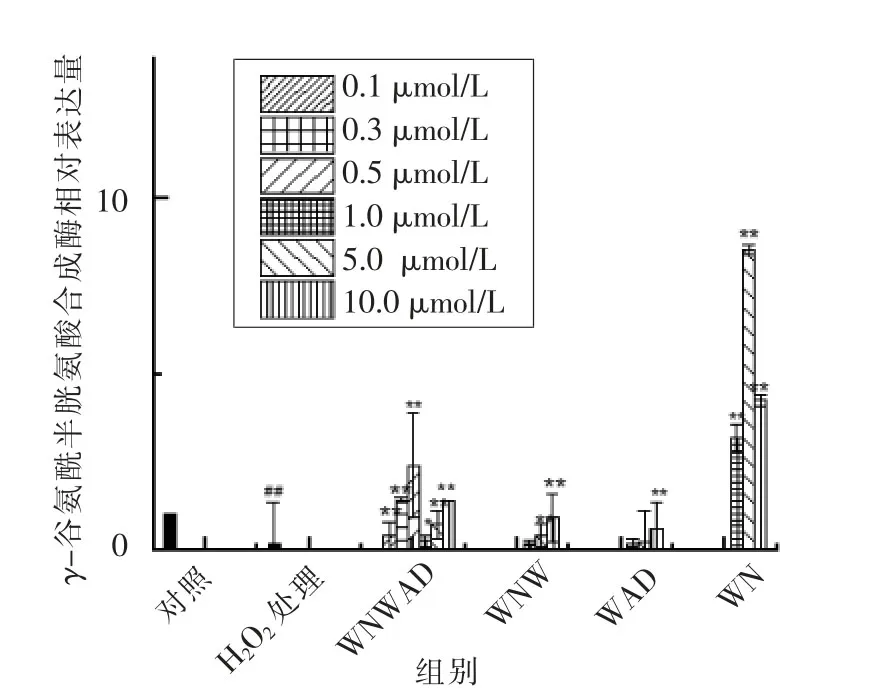
图6 蛋清源活性肽对HEK293细胞γ-GCS m RNA表达水平的影响Fig.6 Effects of peptides on the expression ofγ-GCS mRNA in HEK293
3 结论
氧化应激产生的活性氧(reactive oxygen species,ROS)是众多疾病发生的病理生理基础。当机体暴露于ROS时,其自身能诱导出一系列保护性蛋白,以缓解细胞所受的损害[26]。在对蛋清源肽WNWAD,WNW,WAD,WN,AD的研究中发现,除了肽AD外,其余4条肽不仅有体外氧自由基吸收能力,而且能有效缓解细胞中GSH含量的降低,并维持GSH/GSSG比值在细胞中的稳定平衡状态。在氧化应激状态下,GSH含量降低,蛋清源活性肽会消除活性氧而减少GSH的消耗。γ-GCS是体内还原型谷胱甘肽合成的限速酶,蛋清源活性肽通过上调γ-GCS的表达来实现抗氧化作用。

