多糖中金属离子对其抗氧化活性及抗肿瘤活性的影响
钱怡霖 汪东风 范明昊 孙潇雯 李 昕
(中国海洋大学食品科学与工程学院 山东青岛266003)
多糖是广泛存在于植物、动物和微生物中的由相同或不同的单糖构成的高分子化合物,是所有生命有机体的重要组成成分与维持生命所必需的结构材料[1]。由于多糖具有多种生物活性和无毒副作用,使其生物资源的研究、开发和利用日益活跃,在保健食品及医疗行业中被广泛应用[2]。
国内对于多糖的研究较为深入的有香菇多糖、枸杞多糖、灵芝多糖、海带多糖、银耳多糖等。这些研究集中于以粗提物为基础,对其进行提取纯化工艺的优化、成分分级、组成结构的修饰等[3]。单糖组成、糖链构象、聚合度以及离子的引入都会影响多糖的生物活性[4]。在生命科学及药物化学领域,从机体组成生长发育到能量和物质的新陈代谢、神经信号的传递和免疫机制等许多生命活动中金属离子及其配体都起到重要的作用。王琴等[5]应用主成分分析研究了不同地区枸杞中多糖和金属元素之间存在显著的相关性。蒋方程等[6]发现不同种山药所含微量元素与多糖含量不尽相同,对应的活性表现也略有不同。为提高多糖活性,目前的研究方向主要集中于多糖与目标金属离子的螯合。张新国等[7]将提取的党参多糖作为载体,CaCl2为钙源配位反应生成党参多糖钙络合物,有望成为一种潜在的新型补钙剂。杜德红等[8]利用多糖作为配体与硝酸铈铵或混合稀土金属进行配位,制备多糖稀土配合物,发现其结构发生变化且对磷脂键有良好的水解活性。目前关于多糖所含金属元素组成及其在多糖中发挥的作用却鲜有报道[9]。
本文选取枸杞、香菇、海带3种原料提取多糖并检测其金属元素的组成及含量,使用EDTA-2Na络合纯化前、后的多糖金属离子,比较改变金属元素组成后多糖的抗氧化活性及抗肿瘤活性变化,探讨多糖金属元素组成对其活性的影响,为今后充分利用多糖资源,开发高活性有机物提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 香菇、海带、枸杞均购自当地超市。
1.1.2 试剂 金属混合标准溶液,国家有色金属及电子材料分析测试中心;DPPH(1,1-dipheny-2-picrylhydrazy)、ABTS(2,2-azino-bis-3-ethyl-benzthiazoline-6-sulphonic acid),美国Sigma公司;左旋谷氨酰胺、青霉素-硫酸链霉素双抗混合液,北京索莱宝科技有限公司;DMEM高糖培养液,吉诺生物医药技术有限公司;RPMI.1640培养液,吉诺生物医药技术有限公司;胰酶-EDTA,美国Invitrogen公司;胎牛血清(FBS)、96孔细胞培养板,依科赛生物科技(太仓)有限公司;人乳腺癌细胞MCF-7,中国科学院上海细胞库;其余试剂均为分析纯级。
1.2 仪器与设备
8800 ICP-MS/MS,美国Agilent;Nicolet Nexus 470型红外波谱仪,Thermo Electron公司;电子精密天平,奥豪斯国际贸易(上海)有限公司;CX41显微镜,日本Olympus公司;SpectraMax I3多功能酶标仪,美国Molecular Devices;DL6MB型大容量离心机,西安禾普生物科技有限公司;HHS21-4电热恒温水浴锅,北京长安科学仪器厂;FD-1A-50真空冷冻干燥机,西安太康生物科技有限公司SW-CJ-2F超净工作台,苏净集团安泰公司;AdvantageA 5 Milli-Q超纯水系统,美国Millipore公司。
1.3 试验方法
1.3.1 多糖的制备与纯化 分别称取一定质量的海带、香菇和枸杞原料于40℃烘干、粉碎,过40目筛。加入去离子水,在65℃搅拌浸提3 h后离心浓缩,分别得到粗海带多糖(HP)、粗香菇多糖(XP)和粗枸杞多糖(GP)浓缩液。将3种浓缩液按体积比25∶4∶1加入正丁醇和氯仿,剧烈振摇后离心、收集糖液(Sevage法)。重复此步骤至溶液无白色蛋白层析出,得到纯化海带多糖(HD)、纯化香菇多糖(XD)和纯化枸杞多糖(GD)溶液。分别向纯化前、后的多糖溶液中加入4倍体积95%乙醇,静置12 h后,将沉淀用无水乙醇、丙酮、乙醚洗涤,得到粉末状样品。取纯化前、后的多糖样品分别溶于去离子水,加入EDTA-2Na在4℃水浴震荡8 h,得到EDTA-2Na处理后的EHP、EXP、EGP、EHD、EXD和EGD溶液。分别将各样品溶液加至透析袋(3 500 u)中,4℃隔离透析72 h后收集并冷冻干燥[10]。
1.3.2 糖含量的测定
1.3.2.1 标准曲线的制备 精密称取105℃干燥至恒重的葡萄糖,配制1mg/mL的葡萄糖储备液。准确吸取0.1,0.2,0.3,0.4,0.5mL储备液,定容5 mL。分别吸取该系列溶液2mL于不同试管中,各加入1mL苯酚和5mL浓硫酸。放置5min后40℃加热30min,冷却后测定波长490 nm处吸光值,绘制标准曲线。
1.3.2.2 样品的测定 取多糖稀释液2mL,按上述方法测定吸光值,计算含量[11]。
1.3.3 蛋白含量的测定1.3.3.1 标准曲线的制备 准确称取100mg考马斯亮蓝G-250,溶于50mL 95%乙醇中,加入85%磷酸120mL,定容1 000mL容量瓶。取0.2,0.4,0.6,0.8,1.0mg/mL蛋白质标准溶液各0.1mL,各加入5mL考马斯亮蓝G-250溶液,充分振荡混匀,5 min后于波长595 nm处测定吸光值,绘制标准曲线。
1.3.3.2 样品的测定 取样品溶液0.1mL,按上述方法测定吸光值,计算含量[12]。
1.3.4 糖醛酸含量的测定1.3.4.1 标准曲线的制备 准确吸取0.0,0.1,0.2,0.4,0.6,0.8mL葡萄糖醛酸标准溶液(0.1mg/mL)于试管中,加水至1mL。在冰水浴中各加入6 mL浓硫酸,摇匀后85℃水浴锅中保持2 h,测定波长530 nm处吸光值,以浓度对吸光度绘制标准曲线。
1.3.4.2 样品的测定 取1mL样品溶液按上述方法测定吸光值,计算糖醛酸含量[12]。
1.3.5 金属含量的测定1.3.5.1 标准曲线的绘制 配制Al、Ca、Mn、Fe、Cu、Zn、Pb、Ni、Sn标准溶液(0.0,0.2,0.4,0.6,0.8,1.0mg/kg),使用串联四级杆电感耦合等离子体质谱仪(ICP-MS/MS)测定其浓度,以金属浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到标准曲线回归方程[13]。
1.3.5.2 样品的消化 准确称取20mg样品于消化管中,加入硝酸消化,直至管内溶液澄清透明[14]。冷却后定容10mL。采用ICP法测定其各金属含量。
1.3.6 多糖体外抗氧化活性的测定
1.3.6.1 羟自由基清除能力测定[15]向体系中分别加入1mL硫酸亚铁(9mmol/L)、1mL水杨酸-乙醇(9mmol/L,以无水乙醇配制)和1mL样品液,随后加入1mL H2O2(8mmol/L)启动反应,37℃保温0.5 h后测定波长510 nm处的吸光值Ai。用蒸馏水代替H2O2的体系,测定多糖的本底吸收值Ai0。按下列公式计算羟自由基清除率。
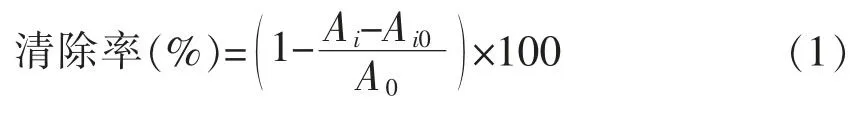
式中,A0——蒸馏水代替多糖溶液测得的吸光值;Ai——样品吸光值;Ai0——多糖本底吸光值。
1.3.6.2 DPPH自由基清除能力测定[16]向试管中加2mL DPPH溶液(2×10-4mol/L,用甲醇配制)和2mL不同浓度多糖溶液,涡旋混匀,于黑暗条件下室温反应30min后测定波长517 nm处吸光值Ai。以原溶剂调零,清除率计算公式:
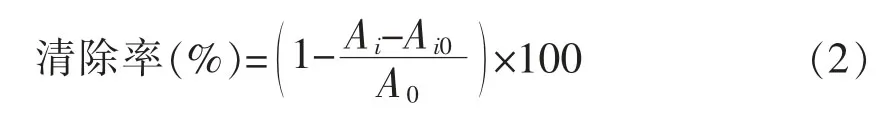
式中,A0——甲醇代替多糖溶液测得的吸光值;Ai——样品吸光值;Ai0——多糖本底吸光值。
1.3.6.3 ABTS自由基清除能力测定[17]将ABTS水溶液(7.4mmol/L)和过硫酸钾水溶液(2.6mmol/L)等量混合,在室温闭光条件下静置12 h。测定时,用50%乙醇稀释ABTS溶液,使其在波长734 nm处的吸光度在0.70±0.02范围,形成ABTS自由基测定液。将0.1mL样品用ABTS自由基测定液稀释至3mL,准确震荡30 s,测定30℃反应20 min后于波长734 nm处的吸光值Ai。清除率计算公式:式中,A0——水代替多糖溶液测得的吸光值;Ai——样品吸光值。
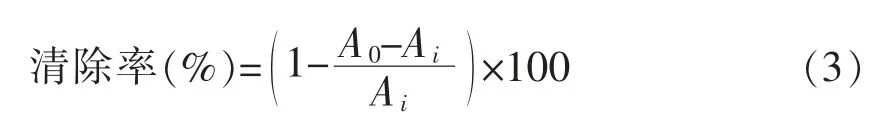
1.3.7 多糖体外抗肿瘤细胞活性的测定
1.3.7.1 MCF-7细胞的培养 将人体乳腺癌细胞MCF-7置于含10%热灭活FBS(胎牛血清)中培养,将2mmol/L左旋谷氨酰胺、100U/mL青霉素和100 g/mL链霉素的5A、DMEM、RPMI-1640加入培养基中,于37℃、5%的CO2细胞培养箱中培养。每两天换液1次,将细胞汇合,用胰酶-EDTA消化,传代,保持细胞在良好的对数生长期。
1.3.7.2 多糖对MCF-7细胞活性的检测 将处于对数生长期的MCF-7细胞分别以5 000个/孔(180mL/孔)接种于96孔板,培养24 h后,加入待测香菇多糖溶液,每个样品设3个复孔。对溶剂对照组加等量的培养基,药物作用72 h后,每孔加入50%冰冷的三氯乙酸(TCA)固定细胞,SRB染色后,加入150mL/孔Tris溶液,于波长540 nm处测定吸光值[18]。
肿瘤细胞生长的抑制率按以下公式计算:

式中,Acontrol——培养基代替多糖溶液测得的吸光值;Asample——样品吸光值。
1.3.7.3 MCF-7细胞凋亡的形态学检测 使用显微镜对贴壁的人乳腺癌MCF-7肿瘤细胞形态观察与拍照[19]。
1.4 数据处理与统计分析
运用Excel数据处理软件,所有数据均为3次重复试验的平均值。采用Origin 8.5作图。采用SPSS 19.0软件处理试验数据,P<0.05为显著性差异。
2 结果与分析
2.1 3种多糖纯化前、后的主要成分含量比较
测定3种多糖的糖、蛋白质、糖醛酸含量,结果列于表1。GD糖最高含量为74.08%,其次为GP和XD。蛋白与多糖含量相反,HP中蛋白最高含量为10.97%,而GD蛋白含量最低为1.29%。由表中数据可以看出除蛋白后仍有少量残留。3种多糖的糖醛酸含量普遍较低。

表1 3种多糖纯化前、后主要成分含量比较Table1 Composition of the contents of main components of three polysaccharides before and after purification
2.2 3种多糖纯化前、后金属元素组成及含量比较
以EDTA-2Na作为金属螯合剂,脱除多糖样品中的金属成分,用ICP-MS/MS检测在EDTA-2Na处理前、后多糖金属元素的种类及含量。去除超纯水,按上述消化方式测得的空白,结果见表2、3、4。
香菇、海带、枸杞粗多糖中均含有Mg、Ca、Fe、Al、Pb等多种金属元素,只是含量各不相同。其中,3种多糖均含有大量的Mg、Ca、K。经过浸洗的淡干海带中K的含量高达40 629mg/kg,大多以无机盐的形式存在[20],与检测结果相符,海带多糖中K的含量最高。海带多糖中过高的K离子含量与其生长环境有关。香菇多糖与海带多糖中的大部分金属离子分布于纯化多糖中,枸杞多糖中除Fe、Pb外,大部分金属离子含量随蛋白的去除而降低。
多糖经EDTA-2Na处理后,含量较高的Ca、Fe、Pb、Zn等金属离子脱除效果显著(P<0.05),而Ni、Sn、Cu等金属离子含量较低,处理过程受水溶液、接触器壁等环境因素影响较大,虽有一定的脱除效果但不显著(P>0.05)。从表2可以看出,除蛋白可在一定程度上降低多糖金属离子密度。通过对3种多糖金属含量的测定,推测多糖的金属组成具有普遍性,其中EDTA-2Na脱除金属离子效果较好。
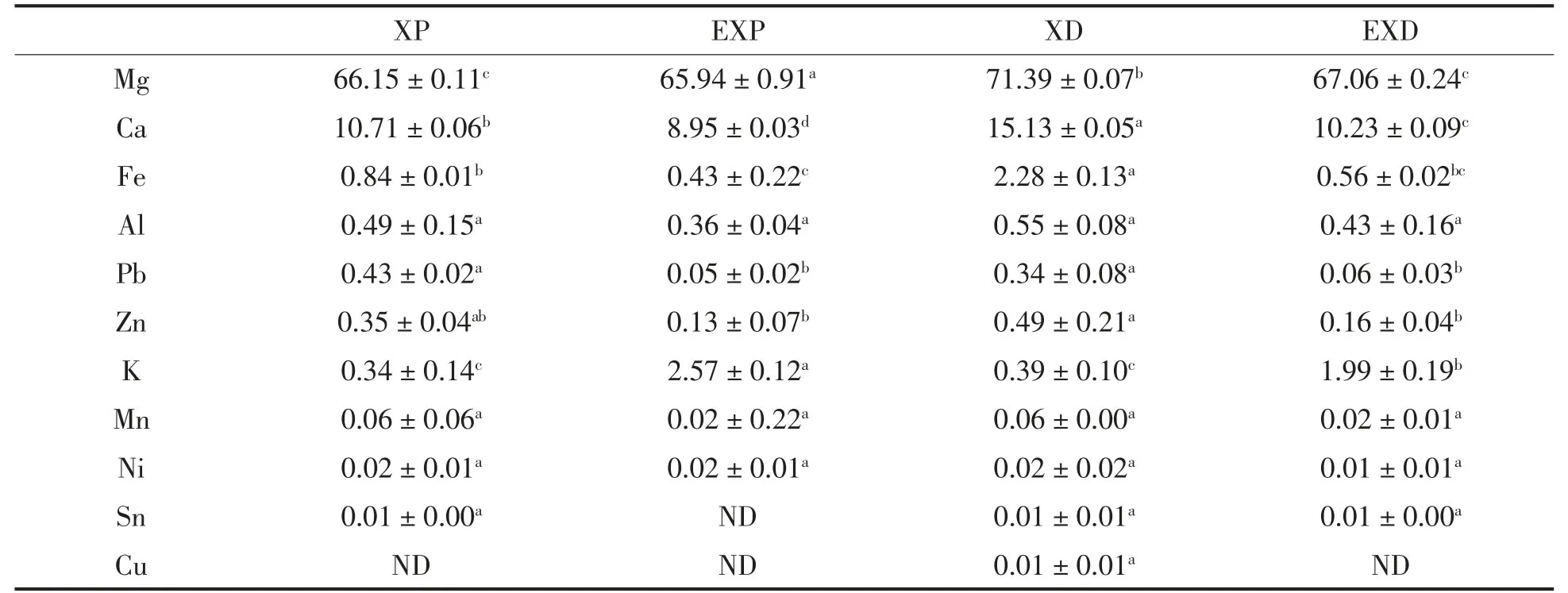
表2 香菇多糖金属组成及含量(mg/kg)Table2 Metal elements(mg/kg of sample)in Lentinan(mg/kg)
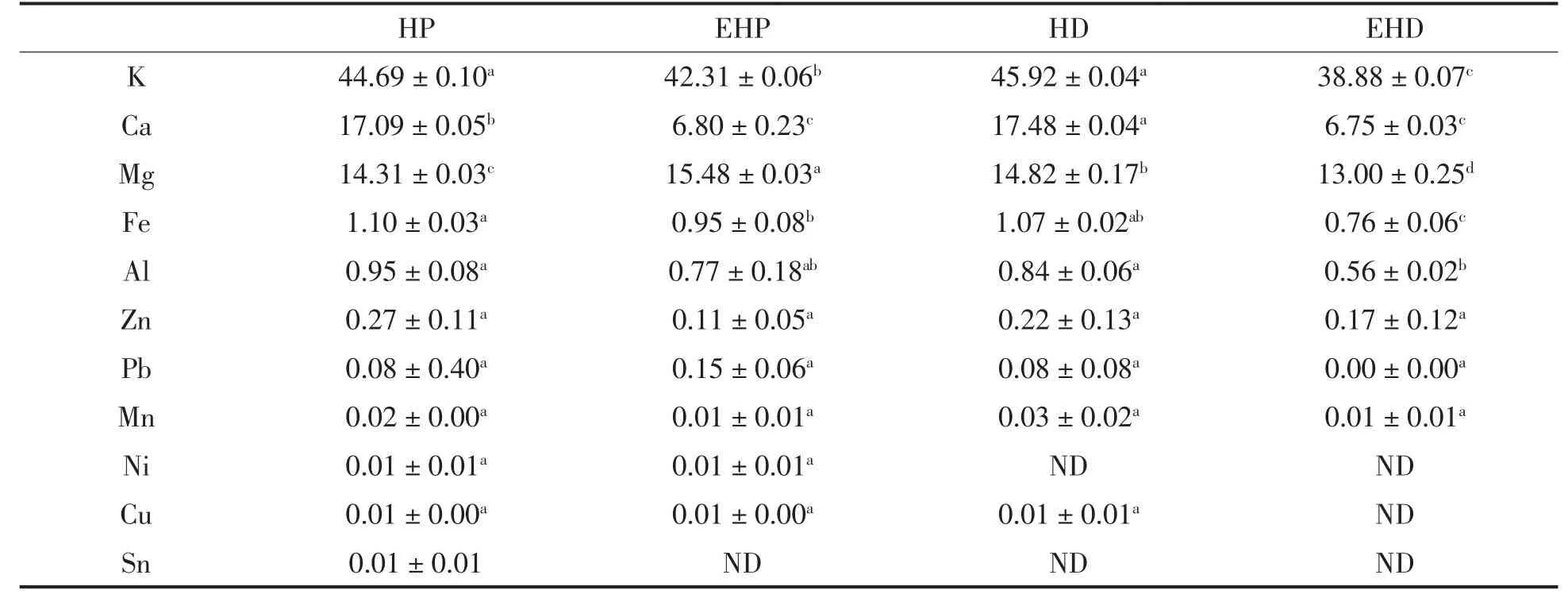
表3 海带多糖金属组成及含量(mg/kg)Table3 Metal elements(mg/kg of sample)in Laminarin(mg/kg)
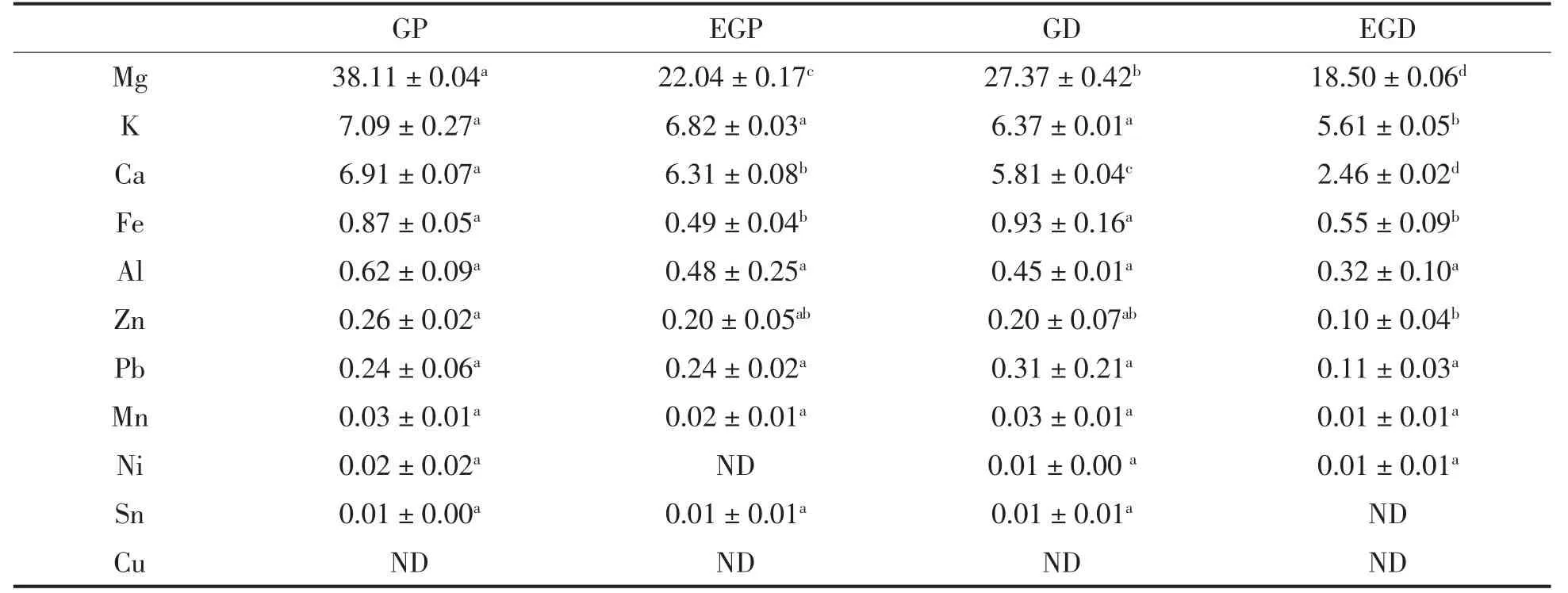
表4 枸杞多糖金属组成及含量(mg/kg)Table4 Metal elements(mg/kg of sample)in Lycium barbarum polysaccharides(mg/kg)
2.3 3种多糖纯化前、后的抗氧化活性分析
2.3.1 2种多糖金属元素对清除DPPH自由基活性的影响 DPPH即1,1-二苯基-2-苦基苯肼是一种稳定的自由基,使其溶液显示紫红色,当存在自由基清除剂时,因与其单电子配对而使其吸收逐渐消失,褪色程度用分光法进行定量分析,以评价多糖活性[21]。样品的清除率测定结果见图1。在试验浓度范围,样品对DPPH自由基清除率随多糖浓度的增加而增强。纯化多糖对DPPH自由基清除率均略高于粗多糖。枸杞多糖中,600μg/mL GD的清除活性高达59.8%,对应EGD清除率降至38.4%,GP清除率为49.5%,而EGP清除率降至34.4%。同样,香菇多糖和海带多糖脱除金属后对DPPH自由基清除活性均显著下降(P<0.05)。
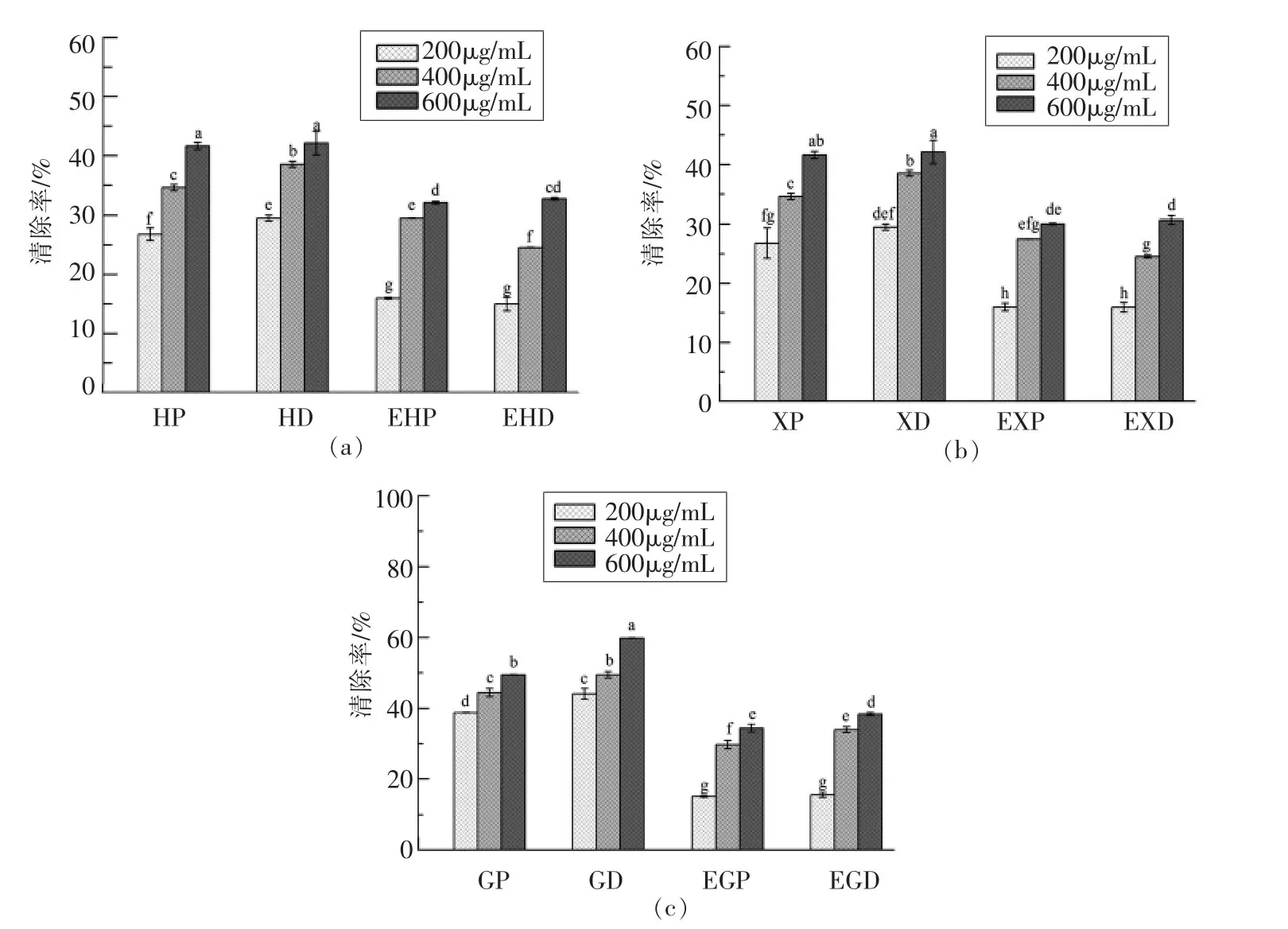
图1 海带多糖(a)、香菇多糖(b)和枸杞多糖(c)清除DPPH自由基活性Fig.1 Scavenging effects of Laminarin(a),Lentinan(b)and Lycium barbarum polysaccharides(c)on DPPH radicals
2.3.2 3种多糖金属元素对清除羟自由基活性的影响 羟自由基清除活性的原理为Fenton反应所产生的羟自由基(H2O2+Fe2+=·OH+H2O+Fe3+)与反应中加入的水杨酸生成于510 nm处有特殊吸收的2,3-二羟基苯甲酸,而羟自由基会对细胞产生毒害作用[22]。金属离子的减少,对羟自由基的生成量有影响。3种多糖对羟自由基的清除结果见图2。随着反应液中样品浓度的增加,对·OH清除率呈上升的趋势。纯化枸杞与海带多糖活性均高于粗多糖,其中枸杞多糖的活性改变最为显著(P<0.05)。通过对比,低浓度样品经EDTA-2Na处理后活性显著下降(P<0.05),随着样品浓度的升高,EDTA-2Na处理样活性均高于原样。因EDTA-2Na为强螯合剂,故推测其在多糖样品中残留,残留量随样品浓度的升高而增大,尚未发挥作用的EDTA-2Na与反应体系中生成的铁离子螯合,使高浓度EDTA-2Na处理样品组的活性大幅度升高。
2.3.3 3种多糖金属元素对清除ABTS自由基活性的影响 ABTS在氧化剂的作用下氧化成绿色的ABTS·+,而抗氧化物存在时ABTS·+的产生被抑制,在波长734 nm处测定ABTS的吸光度即可反映样品的总抗氧化能力。多糖为体系供应电子,将游离自由基转化为稳定产物,从而终止氧化还原链反应[23]。如图3所示,多糖清除ABTS·+的能力与多糖浓度呈正相关。3种纯化多糖EDTA-2Na处理组活性下降显著(P<0.05),表明金属对多糖活性起促进作用。推测由于多糖内金属脱除,供应电子能力降低,导致其活性的下降。
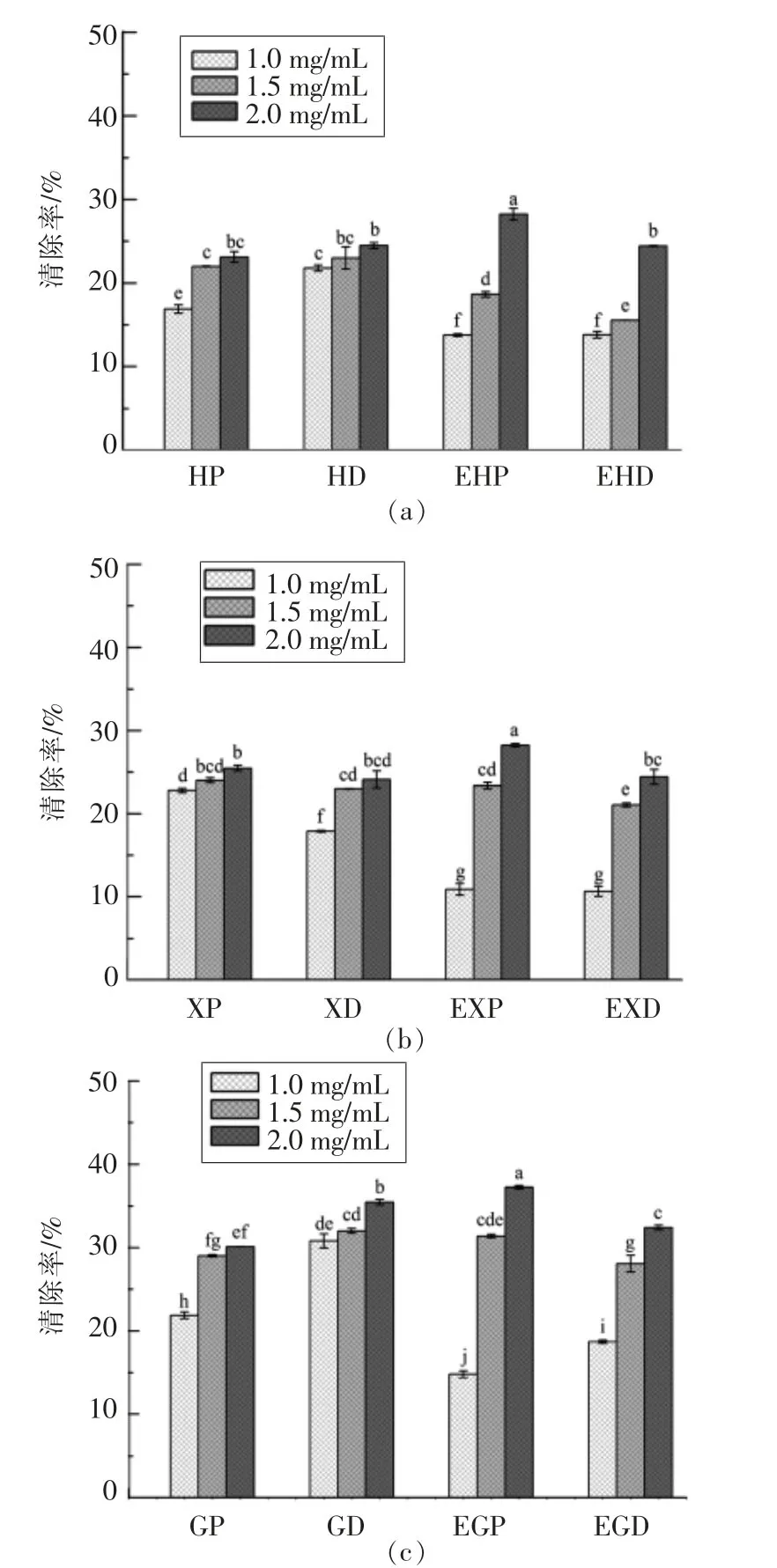
图2 海带多糖(a)、香菇多糖(b)和枸杞多糖(c)清除羟自由基活性Fig.2 Scavenging effects of Laminarin(a),Lentinan(b)and Lycium barbarum polysaccharides(c)on hydroxyl radicals
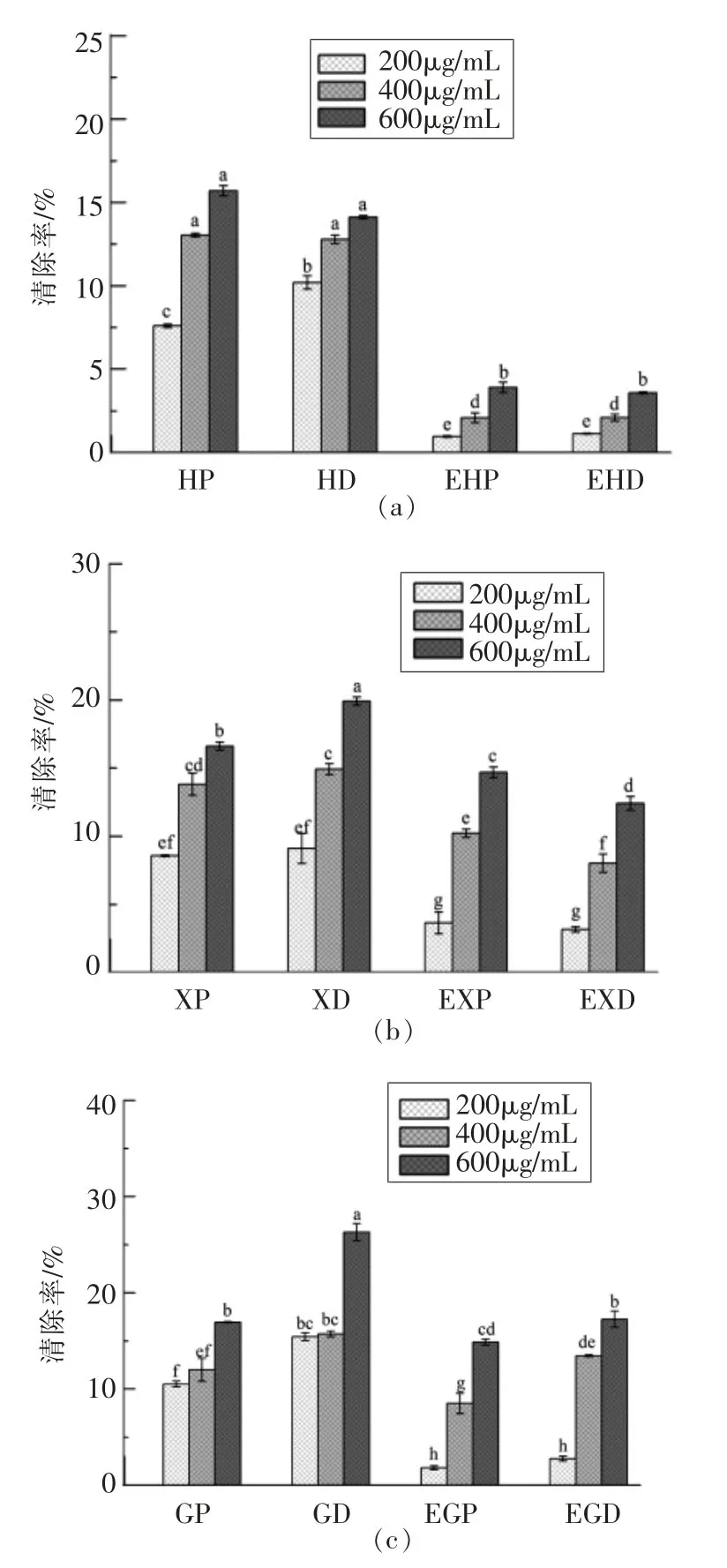
图3 海带多糖(a)、香菇多糖(b)和枸杞多糖(c)清除ABTS自由基活性Fig.3 Scavenging effects of Laminarin(a),Lentinan(b)and Lycium barbarum polysaccharides(c)on ABTS radicals
2.4 枸杞多糖金属元素对抗肿瘤活性的影响
2.4.1 对人乳腺癌细胞MCF-7活性的影响 为进一步考察多糖金属元素组成对多糖活性的影响是否具有普遍性,以人乳腺癌细胞MCF-7作为新的活性作用对象,研究多糖脱除金属处理对肿瘤细胞增殖的影响[24]。 如图4SRB试验表明,脱除金属离子前、后的多糖均能不同程度地抑制人乳腺癌细胞MCF-7的增殖,且这种抑制作用随样品浓度的增大而增强。值得注意的是,在3 200μg/mL质量浓度下EGD抑制活性高于GD。随多糖浓度的降低,EGD抑制能力低于GD。推测在高浓度EGD中,残留的EDTA-2Na导致细胞生长被抑制。总体来说在相同浓度下,GD与EGD的抑制率有一定的差异。
2.4.2 对人乳腺癌细胞MCF-7凋亡形态学的影响 通过肿瘤细胞体外抑制试验进行枸杞多糖(GD、EGD)活性对比。以无菌DMSO为阴性参比,多糖液为试验组,通过细胞形态学变化探讨多糖内金属对MCF-7人乳腺癌细胞凋亡诱导作用的影响[25]。如图5所示,随着多糖浓度的增大,24 h后其抑制率逐渐增大,表现出一定的剂量依赖关系。当多糖质量浓度达到400μg/mL后,GD与EGD对肿瘤细胞细胞增殖的抑制作用的差异开始展现。GD组的质量浓度在800μg/mL时凋亡趋势愈发明显,几乎半数细胞变为圆形且不再贴壁,而EGD组多数呈梭型。枸杞多糖能够较好地抑制人乳腺癌细胞MCF-7生长,且含金属离子的枸杞多糖抗肿瘤效果更佳。
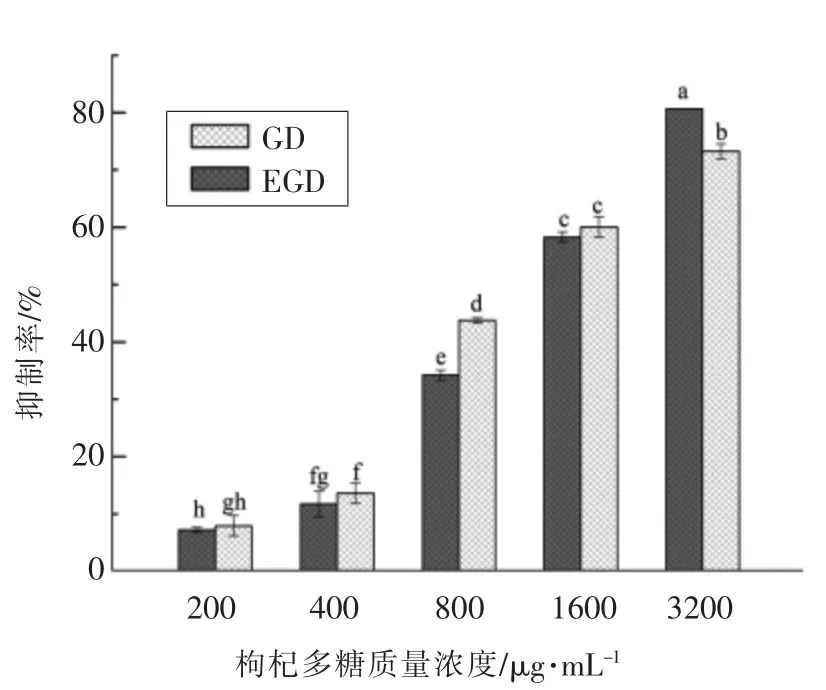
图4 枸杞多糖抑制人乳腺癌细胞MCF-7生长活性Fig.4 Effect of Lycium barbarum polysaccharides on the proliferation of MCF-7 cells
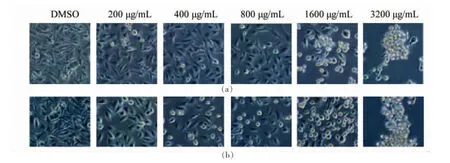
图5 不同浓度EGD(a)和GD(b)处理对人乳腺癌细胞MCF-7细胞形态学的影响Fig.5 Effect of MCF-7 cells treated with different concentrations of EGD(a)and GD(b)on cellular morphological
3 结论
采用水体醇沉法提取的香菇、海带和枸杞多糖均含有Mg、Ca、Fe、Al、Pb等多种金属元素,其含量各不相同。枸杞多糖的金属离子集中分布于多糖的蛋白组成中,而香菇和海带多糖中的金属离子集中分布于多糖组成中。利用EDTA-2Na去除多糖粗品及纯品中的金属离子,结果表明其对含量较高的Ca、Fe、Pb、Zn等金属离子脱除效果较好。
去除金属后的3种多糖对ABTS自由基、DPPH自由基的清除活性均有所下降,其中枸杞多糖活性下降最为显著(P<0.05),推测多糖金属组成成分对其活性有一定的促进作用。枸杞多糖纯品对人乳腺癌细胞MCF-7抑制活性高于去除金属离子的样品,验证了多糖金属元素组成对其活性的影响。

