载紫杉醇重组高密度脂蛋白微球的制备和抗胃癌作用研究
王青 杨觅
在我国,大多胃癌患者初诊即为Ⅳ期,5年生存率低于5%[1]。而现今的胃癌化疗面临诸多难题:首先,现有化学药物治疗对肿瘤无靶向性;其次,抗肿瘤疗效与药物剂量相关,全身给药途径不能使药物局部浓度增加,因而效果不尽人意。载药纳米微球可通过在特定的组织细胞中驻留并缓慢释放药物而发挥靶向治疗作用,从而达到较好的治疗效果[2-4]。目前,美国食品药品监督管理局已批准盐酸阿霉素脂质体等多种抗肿瘤纳米药物上市,大量抗肿瘤纳米药物也已处于临床试验阶段[5-6]。重组高密度脂蛋白(rHDL)是一种理想的药物载体,它与人体内源性高密度脂蛋白(HDL)类似,可转运疏水性药物,具有良好的生物相容性和长循环特征,其表面的载脂蛋白Apo A-I可特异性识别靶细胞表面的受体SR-B1,通过内吞机制将药物靶向投递到特定类型的细胞[7-9]。研究者们发现SR-B1广泛存在于多种恶性肿瘤细胞表面,包括乳腺癌、肝癌以及卵巢癌等[10-13]。
紫杉醇(PTX)是目前常用的治疗胃癌的化疗药物,但临床使用时常伴有严重的毒性反应,如骨髓抑制、超敏反应等[14]。本研究采用一种新型无毒制备工艺进行载紫杉醇重组高密度脂蛋白(PTX-rHDL)微球的合成,观察其理化性质及存放稳定性,并通过细胞及动物实验观察其体内外抗肿瘤疗效,以期为PTX-rHDL微球的临床应用提供依据。
1 材料和方法
1.2 主要试剂 PTX原药(批号:WS-20170913,江苏红豆杉药业有限公司);大豆卵磷脂(批号:160lPC-77,日本 TCI公司);Apo A-Ⅰ(批号:GP20180563,美国Sigma公司);NBD-PE(批号:171022,美国 Avati Polar Lipids公司);胎牛血清(FBS,批号:160903,兰州民海生物有限公司);RPMI 1640培养液(批号:1900-141,美国Gibco公司);四亚基偶氮唑蓝(MTT)(批号:09052345,美国Amersco公司);十二烷基硫酸钠(批号:0B7103256,北京鼎国昌盛生物技术有限公司);四甲基二乙胺(TEMED)(批号:13M00163,北京鼎国昌盛生物技术有限公司);过硫酸铵(批号:0AA10211,北京鼎国昌盛生物技术有限公司);三羟甲基氨基甲烷(Tris)(批号:DH35-3.1,北京鼎国昌盛生物技术有限公司);甲叉双丙烯酰胺(批号:0B410295,北京鼎国昌盛生物技术有限公司);丙烯酰胺(批号:0BD109101,北京鼎国昌盛生物技术有限公司);磷脂膜染料(NBD-PE)(批号:60025,美国Biotium公司);兔抗SR-B1抗体(批号:GR149558-14,美国NOVUS Biologicals公司);辣根过氧化物酶HPR标记的羊抗兔IgG(批号:4413,美国Cell Signaling公司);β-actin(批号:4970,美国Cell Signaling公司);RIPA裂解液(批号:P0013,碧云天生物技术公司);BCA试剂盒(批号:KGP902,南京凯基公司);截留分子量为8 000-10 000透析袋(批号:201600307,南京大治生物科技有限公司),人胃癌细胞株MKN-45和SGC-7901(中科院上海细胞生物研究所);乙腈(批号:PX24235D,德国 Merck公司);盐酸(批号:201601190,天津市大茂化学试剂厂)、无水乙醇(批号:201610530,天津市大茂化学试剂厂),水为去离子水。
1.3 实验方法
1.3.1 PTX-rHDL微球的制备 取10mg大豆卵磷脂和1mg PTX加入2ml乙醇溶液中,搅拌5min使其完全溶解,30℃恒温下用真空旋转蒸发仪(型号:DZF-6092,上海一恒科学仪器有限公司)将溶剂吹干,制成均匀的脂质薄膜,干燥1h;加入0.01M磷酸盐缓冲液(PBS)(pH 7.4)10ml,水浴超声(型号:KH-500B,昆山禾创超声仪器有限公司)5h,水温持续控制在48℃以下,形成脂质悬液;加入0.05mg Apo A-Ⅰ,上述溶液以4℃保存过夜,再将该溶液置入透析袋,放置于以PBS中透析24h制备的微球4℃保存。通过透析法将合成的微球与游离PTX及大豆卵磷脂分离。空白纳米粒子的制备除去不加药物外其余过程同上。
1.3.2 PTX-rHDL微球表征观察 (1)稳定性:制备的微球以4℃保存,在设定的时间点分别取出1ml微球,用动态光散射仪(型号:NanoBrook 90plus,美国Brookheave公司)测量粒径的变化,评估稳定性,所有结果均测定3次。(2)载药及包封率:PTX-rHDL载药量和包封率由高效液相色谱(型号:1260,德国Agilent公司)测定,色谱柱为Zorbax C18 柱,流动相为乙腈/水(52/48,v/v),PTX的保留时间为5.5min,测定波长为227nm,按照中国药典固体脂质纳米包封率及载药量公式计算。载药率(DLC)=PTX质量/(PTX-rHDL微球质量)×100%。包封率(EE)=PTX实际质量/PTX的投料量(mg)×100%。(3)PTX-rHDL微球的粒径和形态学通过透射电镜(型号:JEM-2010,日本电子株式会社)和动态光散射仪观察。
1.3.3 药物体外释放观察 将6ml PTX-rHDL微球置入透析袋(截留分子量为8 000~10 000Da),透析袋完全浸没置入 80ml PBS[含 0.5%(w/v)Tween-80],在 37℃条件下,特定的时间点(30min 及 1、4、12、50、72、96h)取出4ml释放介质,并替换相同体积的新的缓冲液。释放介质中的PTX含量由高效液相色谱法分析得,每个独立样本重复3次。
1.3.4 不同胃癌细胞株蛋白表达检测 采用Western blot法。人胃癌细胞株SGC-7901和MKN-45培养于含有10%FBS的1640培养液中,置于含5%CO2的37℃培养箱(型号:MCO-15AC,日本 SANYO公司),加入RIPA裂解液提取蛋白质,收集上清液后使用BCA试剂盒测定蛋白浓度。经SDS-聚丙烯酰胺电泳(Mini Protean 3 Cell,美国Bio-Rad公司),转印于NC膜,先后加入一抗及二抗,应用成像系统检测蛋白表达(Odyssey双色红外荧光成像系统,美国LI-COR公司)。其中一抗采用兔抗SR-B1抗体,二抗采用辣根过氧化物酶HPR标记的羊抗兔IgG。
1.3.5 细胞摄取实验 取10mg大豆卵磷脂溶解在2ml乙醇溶液中,加入0.01%NBD-PE,搅拌5min使其完全溶解,30℃恒温下用真空旋转蒸发仪将溶剂吹干制成均匀的脂质薄膜,干燥 1h。加入 0.01M PBS(pH 7.4)10ml,水浴超声5h(水温控制在48℃以下)形成脂质悬液,加入0.05mg Apo A-Ⅰ,上述溶液4℃保存过夜。再将该溶液置入透析袋浸入PBS中透析24h。以上操作均避光进行。将人胃癌细胞株SGC-7901和MKN-45以105密度接种在六孔板中(每孔8 000个细胞),在37℃ 5%CO2培养箱培养24h后,去除培养液,每个孔加入200μl上述荧光微球孵育4h,PBS冲洗3次后在荧光显微镜(型号:BX-51,日本Olympus公司)下观察摄取情况。
1.3.6 细胞毒性实验 采用MTT法评估PTX裸药、rHDL、PTX-rHDL微球对SGC-7901及MKN-45细胞生长抑制作用。具体步骤为:细胞以5 000个细胞/孔的密度接种于96孔中,在37℃5%CO2培养箱中培养24h,每孔再分别加入100μl浓度为8.75μg/ml的PTX裸药、PTX-rHDL微球、以及含有相同量大豆卵磷脂的rHDL空白微球,每个浓度设3个复孔。以加入0.9%氯化钠溶液(NS)为对照组。与药物作用48h后,每个孔中加入20μl 5mg/ml MTT,继续置培养箱中培养4h,弃去上清液,每孔加入二甲基亚砜(DMSO)200μl,置震荡仪上震荡10min充分混匀,采用酶标仪(型号:ELX800,美国Biotek公司)630nm为参考波长,检测490nm下吸光度(OD)。细胞的存活率(%)=(各实验组OD值/对照组OD值)×100%。样本重复3次。
7.定期总结,将同一类型的错题做好归类,要学会使用标签或符号,给相似类型的题、相关类型的题等做好标记,以便于以后分专题复习,很多学生最缺乏的就是这一步骤。其实在每周、每月、每季度、每年的定期整理归纳时,可以专门留出错题本的前几页,方便后续做一个归类整理的目录,这样,在翻错题本时就不至于茫然失措了。
1.3.7 小鼠建模及分组 在小鼠右侧腋下皮下注射SGC-7901细胞培养液0.5ml含2×106个细胞,使用游标卡尺测量肿瘤长短径,按照如下公式计算肿瘤体积:V=长径×短径2/2。当大部分小鼠肿瘤体积达到100~300mm3,分组评估PTX-rHDL较传统化疗药物PTX是否有更好的抗肿瘤疗效,以及空白rHDL是否具有抑瘤作用及生理毒性。将荷瘤小鼠随机分为PTX-rHDL组、PTX组、NS组、rHDL组,每组5只。分别于瘤周皮下给药0.2ml PTX-rHDL微球(含PTX浓度为10mg/kg)、0.2ml PTX(10mg/kg)、0.2ml0.9%氯化钠溶液、0.2m空白rHDL(空白微球浓度为100mg/kg)。每3d给药1次,共5次。
1.3.8 体内抗肿瘤评价 在第1、4、8、11、19天测量肿瘤长短径,并称量小鼠体重,计算相对肿瘤体积和相对小鼠重量。相对肿瘤体积=V/V0(V是测量时肿瘤绝对体积;V0是第1天该组肿瘤平均体积);相对小鼠体重=W/W0(W是测量时小鼠体重;W0是第1天该组小鼠平均重量)。第19天小鼠被处死,肿瘤取出称重,并对各组小鼠的器官如心肝脾肺肾取出进行石蜡包埋后HE染色作病理检查,评估毒性。
1.4 统计学处理 采用SPSS 17.0统计软件。计量资料采用表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 PTX-rHDL微球的合成和表征 大豆卵磷脂与PTX配比为质量比10∶1时,PTX-rHDL微球的稳定性最高,粒径在8d内无明显变化,见图1。PTX-rHDL微球是直径为(60.41±1.81)nm 球形粒子,见图 2、3。载药率和包封率分别为(3.86±0.90)%和(95.59±0.09)%。
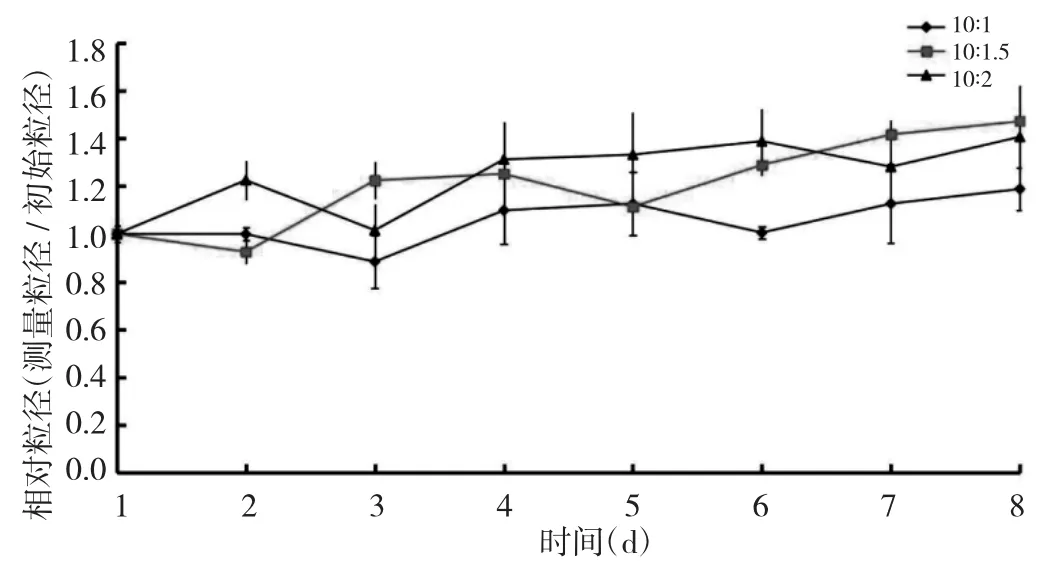
图1 不同比重大豆卵磷脂/PTX微球的稳定性
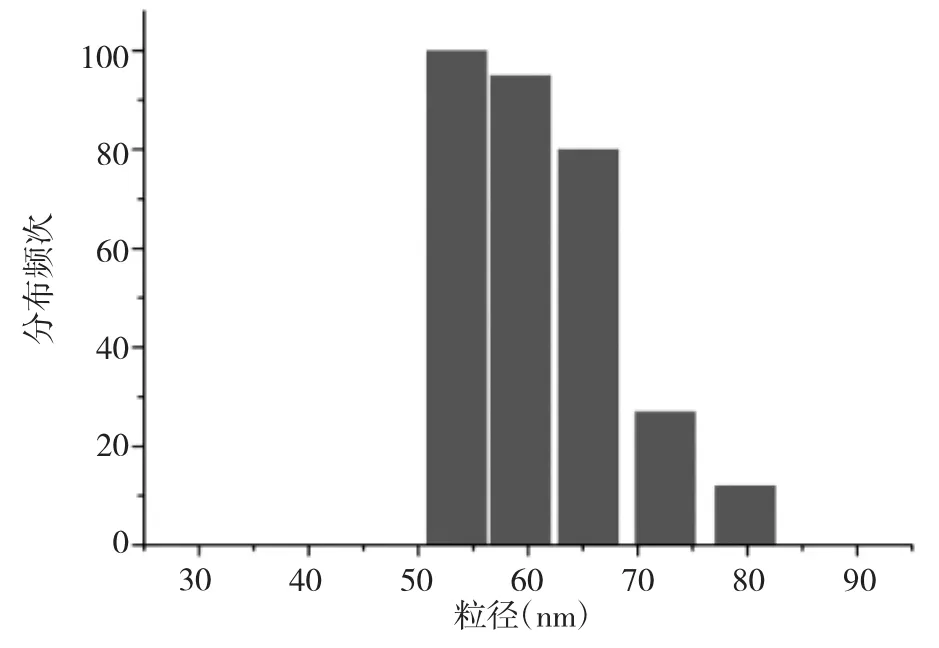
图3 PTX-rHDL粒径分布
2.2 PTX-rHDL微球体外释放动力学 PTX-rHDL微球呈现先突释后缓释药物的特征,在初始的4h内释放了17.55%,在24h内共释放了约25.00%的药物含量,由此可以发现,载入微球的PTX具有延迟释放的效果,见图4。
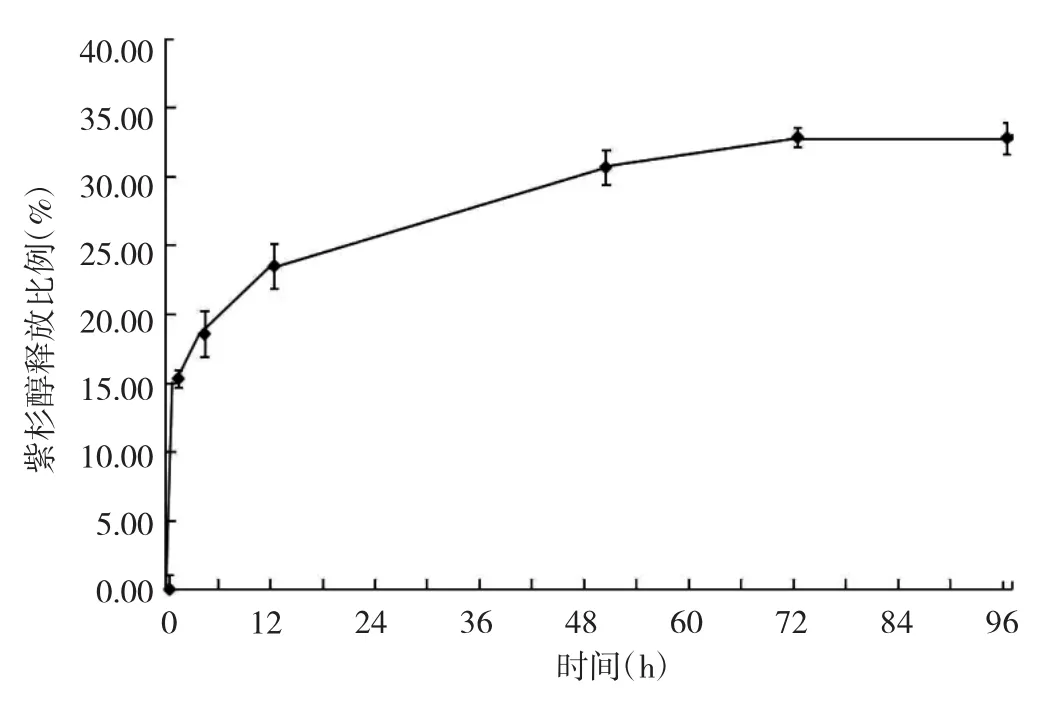
图4 PTX-rHDL的药物释放曲线
2.3 不同胃癌细胞株SR-B1蛋白表达 SR-B1蛋白在人胃癌SGC-7901细胞株高表达,在MKN-45细胞株低表达,见图5。
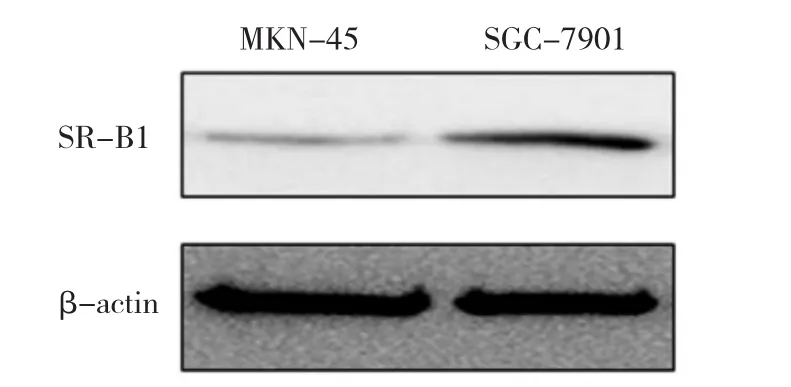
图5 MKN-45和SGC-7901的SR-B1蛋白表达的电泳图
2.4 胃癌细胞株对PTX-rHDL微球的摄取 SR-B1表达阳性的胃癌SGC-7901细胞株摄取大量的荧光微球,而MKN-45细胞株不摄取,见图6(插页)。
2.5 细胞毒性试验 SGC-7901和MKN-45细胞株的细胞毒性试验结果见表1,SGC-7901细胞中PTX-rHDL组的细胞存活率低于PTX组、rHDL微球组及NS组,差异均有统计学意义(均P<0.05)。对于MKN-45细胞中PTX组的细胞存活率低于PTX-rHDL组、rHDL微球组及NS组,差异均有统计学意义(均P<0.05)。由表1可以看出:(1)对SR-B1表达阳性或者阴性细胞株的生存,rHDL无明显影响;(2)PTX-rHDL微球对高表达SR-B1的细胞株的毒性强于低表达SR-B1的细胞株,并且比PTX裸药杀伤作用更强。
2.6 PTX-rHDL微球的体内抗肿瘤作用 采用人胃癌细胞株SGC-7901小鼠皮下瘤模型来评价PTX-rHDL微球的体内抗肿瘤作用。在第1、4、8、11、19天测量肿瘤长短径,根据上文公式计算相对肿瘤体积,并绘制肿瘤生长曲线。第19天时,PTX组相对肿瘤体积为6.32,NS组相对肿瘤体积为10.32,PTX-rHDL微球组相对肿瘤体积为9.14。PTX-rHDL微球组与NS组比较差异有统计学意义(P<0.05),PTX组与NS组比较差异无统计学意义,这可能是因为本研究中使用了较小剂量的PTX以及采用间隔给药模式,见图7。而在小鼠体重上,PTX组、PTX-rHDL微球组与NS组比较差异均无统计学意义,见图8。
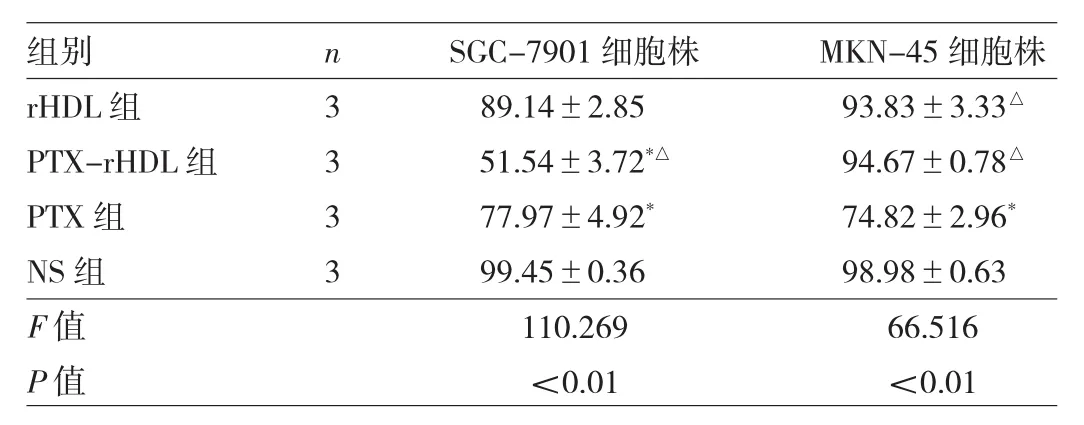
表1 不同药物作用于SGC-7901和MKN-45细胞株后细胞存活率(%)
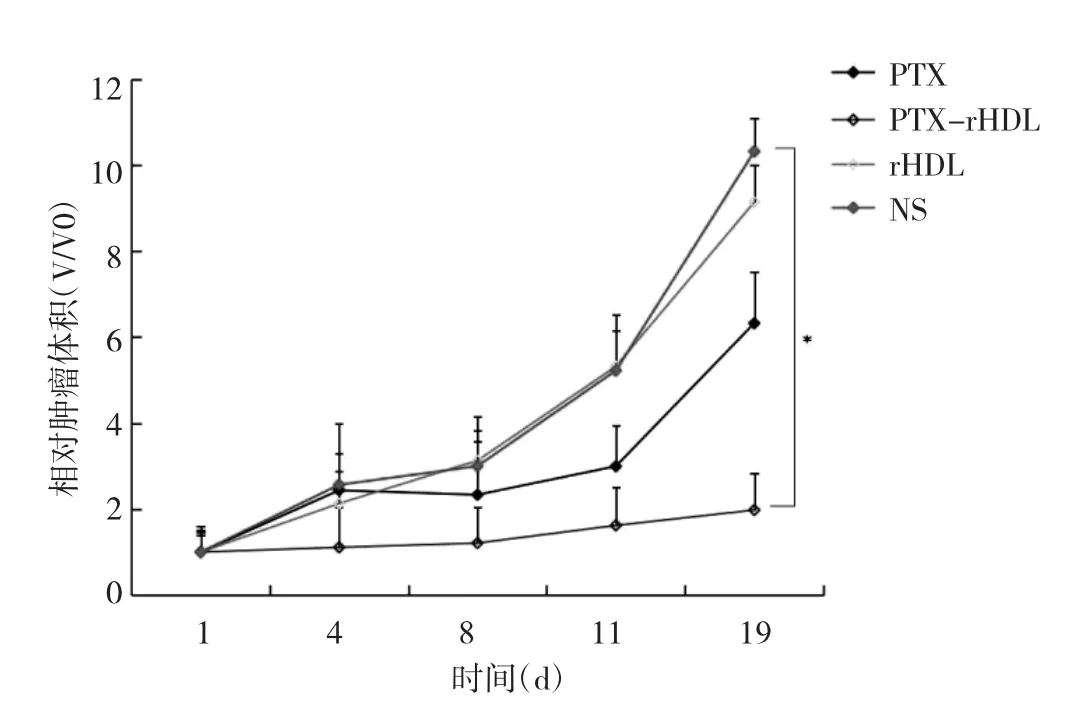
图7 4组小鼠的肿瘤体积曲线
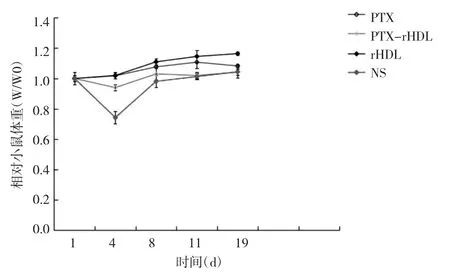
图8 4组小鼠体重变化曲线
所有小鼠在第19天被处死,每组的平均瘤重也被记录并统计作为相对肿瘤体积的补充。PTX-rHDL微球组平均瘤重为(0.73±0.24)g,明显小于NS组的(1.68±0.40)g(P<0.05),以及 rHDL 组(1.56±0.25)g(P<0.05)。PTX组平均瘤重为(1.46±0.32)g,低于 rHDL 组和 NS 组,差异均无统计学意义(均P>0.05),见图9。小鼠瘤重结果与小鼠相对肿瘤体积结果一致。
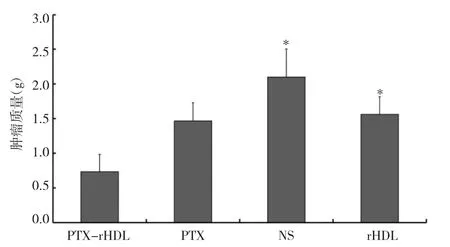
图9 4组小鼠瘤重比较(注:与PTX-rHDL比较,*P<0.05)
小鼠心、肝、脾、肺、肾组织切片HE染色结果显示,无明显的病理变化,见图10(插页)。初步证实了PTX-rHDL微球的体内安全性。
3 讨论
PTX作为广谱抗癌药物具有良好的抗肿瘤活性,但溶解度低这个特性限制了PTX的应用。rHDL在结构上、性质上与人体内源性HDL相似,具有粒径小、生物相容性高、可与脂蛋白受体特异性结合等特点,引起研究者们的广泛关注,rHDL可以作为良好的药物运输载体,搭载各类型的化疗药物、小干扰核糖核酸(siRNAs)、光敏剂和显像剂等。
本实验采用无毒无害的原料和方法制备了PTX-rHDL微球,形态规整,粒径在60nm左右,具有良好的稳定性,容易保存。该大小粒径的微球易在组织内扩散,穿透血管内皮进入肿瘤细胞。体外释放试验显示所制备的微球具有长时的缓释作用。SR-B1广泛表达于多种恶性细胞表面,促进其增殖和转移。通过对SR-B1蛋白不同表达的细胞株进行细胞摄取实验,揭示该微球可以被SR-B1高表达的细胞株摄取,细胞毒性实验中,PTX-rHDL微球对高表达SR-B1的SGC-7901杀伤作用是裸药PTX的1.5倍,而在SR-B1不表达的MKN-45细胞株,PTX-rHDL微球对其杀伤作用小于PTX裸药,这证实了该微球的靶向性。动物体内实验也证实了PTX-rHDL微球可以明显延缓肿瘤生长。研究者们发现SR-B1可以作为一个潜在的生物标志物,即不包裹任何化疗药物,也可以减缓肿瘤的生长,对肿瘤细胞有一定的杀伤作用[15]。在本研究的细胞毒性试验中也发现rHDL组对细胞杀伤作用强于NS组,说明空白rHDL微球也有抗肿瘤趋势,然而差异无统计学意义。PTX-rHDL微球有良好的抑瘤效果,且不良反应并无明显增加,这符合当代恶性肿瘤的治疗理念。
随着生物化学、蛋白组学等学科的进一步发展,后续可将本实验室肿瘤穿透肽iRGD通过化学修饰到微球表面实现双靶向,或者联合放疗研究有无协同增效等进行更深入的探索。重组高密度脂蛋白微球作为药物载体显示出广阔的应用前景,为研究者们提供新思路和新方法。

