二代测序技术在流产物染色体拷贝数改变检测中的应用
梅瑾 王昊 王敏 何茶英
染色体异常是导致自然流产和婴儿出生缺陷的常见因素[1]。既往对流产物开展遗传学检测方法有限,主要是通过绒毛细胞培养法[2-3]检测胚胎组织染色体异常,但该方法操作过程繁琐,细胞培养周期长,容易发生母体细胞污染。此外临床上还常用染色体微阵列芯片[4]、微阵列比较基因组杂交技术[5]等对流产物进行检测,但费用较高,患者接受度较差。近年来二代测序技术(next-generation sequencing,NGS)在产前诊断领域得到普遍应用,通过对流产物样本进行低深度全基因组测序,可以获取准确的基因组变化信息,在相对较低成本下得到高分辨率、高准确率的基因组异常信息,逐渐成为流产物遗传学诊断的常用技术[6-7]。目前临床上采用NGS对流产物染色体拷贝数改变进行分析的大样本研究报道不多,本研究选取2015年9月至2018年6月不明原因流产和死胎的孕妇639例,采用NGS对其绒毛或胎儿样本进行全基因组测序,并完成染色体拷贝数改变分析,探讨NGS在流产物染色体拷贝数改变检测中的应用价值。
1 对象和方法
1.1 对象 选取2015年9月至2018年6月在本院门诊的不明原因流产和死胎的孕妇639例,年龄22~44(29.1±5.6)岁,孕周 7~26(12.8±5.8)周。所有孕妇均经 B超诊断为胚胎停育、死胎。本研究经医院医学伦理委员会审批通过。
1.2 样本采集 所有孕妇均在知情同意的原则下,按妇产科常规施行手术操作,孕7~14周者行人工流产术,采集无母血污染的清洁胚胎绒毛组织约5~10g;孕15~26周死胎者行引产术,留取清洁的死胎皮肤肌肉标本约5~10g;均放入专用试管内冷冻保存。次日冷链快递运输至湖南家辉遗传专科医院实验室检测。
1.3 方法
1.3.1 DNA提取 选取冷冻的流产组织10mg,采用DNA试剂盒(北京天根生化科技有限公司)提取基因组DNA,按照试剂盒说明书操作。采用NanoDrop 2000分光光度计(美国Thermo Fisher公司)检测DNA纯度和浓度,1%琼脂糖凝胶电泳检测DNA完整性。
1.3.2 DNA文库构建与测序 提取的基因组DNA经超声仪打断成小片段核酸,然后以小片段核酸为起始模板,构建文库。将小片段DNA 5′端和3′端作平末端化处理;采用T4-DNA连接酶(美国Enzymatics公司),连接接头序列在DNA片段两端;进行琼脂糖凝胶电泳,切胶回收目的片段;采用聚合酶链反应(PCR)法进行DNA扩增,磁珠法进行DNA片段纯化,去除二聚体干扰,构建好的测序文库经实时荧光定量PCR法检测合格后,进行上机测序;使用美国Illumina HiSeq 2500测序平台,对样本进行全基因组测序;测序结果进行染色体拷贝数改变分析[8]。
1.3.3 染色体拷贝数改变分析 通过生物信息学软件分析NGS测序结果,将每个测序的Read标签匹配到对应的染色体上,然后进行Z值标准化分析,根据Z值进行染色体异常的判定。本研究中通过检索公共数据库,如 Decipher数据库(https://decipher.sanger.ac.uk/syndromes)、Database of Genomic Variants数据库(http://dgv.tcag.ca/dgv/app/home)和 Orphanet数据库(http://www.orpha.net/consor/cgi-bin/index.php?lng=EN),分析测序结果中染色体拷贝数改变的临床意义。
1.3.4 染色体拷贝数改变致病性判读 根据美国医学遗传学会的指南[6],判读原则为:拷贝数是重复或缺失、是否涉及已知的单倍剂量不足基因、片段上含有的基因数量、相关病例文献及数据库查询结果以及双亲是否携带的情况进行评分,根据评分结果从大到小将染色体拷贝数改变分 5类,致病(≥0.99分)、可能致病(0.90~0.98分)、临床意义不明确(-0.89~0.89分)、可能良性(-0.90~-0.98分)、良性(≤-0.99分)。
1.4 统计学处理 采用SPSS 17.0统计软件。计量资料以表示。计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 染色体拷贝数改变检出情况 639例孕妇中,因DNA降解导致检测失败9例,完成NGS检测630例。630例患者中,≥35岁78例,<35岁552例;NGS检测结果为阴性315例,整条染色体改变和(或)拷贝数改变315例,检出率为50.00%。315例异常中,250例涉及整条染色体增减或改变,包括单体64例(10.16%),三体169例(26.83%),三倍体1例(0.16%),复合三体 9例(1.43%),性染色体单体和(或)三体嵌合体7例(1.11%),见表1;65例为染色体片段的拷贝数改变,拷贝数减少的片段大小范围为1.06~85.24Mb,拷贝数增加的片段大小范围为 1.42~135.80Mb,其中明确致病性 30例(4.76%),可能致病性5例(0.79%),见表2,临床意义不明确的23例(3.65%),可能良性4例(0.63%),良性 3例(0.48%)。
2.2 不同年龄组孕妇整条染色体增减或改变检出情况≥35岁组孕妇整条染色体增减或改变检出率为44.87%(35/78);<35岁组孕妇整条染色体增减或改变检出率为38.95%(215/552);两组比较差异无统计学意义(χ2=1.000,P=0.316)。
2.3 不同年龄组孕妇致病性染色体片段拷贝数改变检出情况 ≥35岁组孕妇致病性染色体片段拷贝数异常检出率为5.13%(4/78);<35岁组孕妇致病性染色体片段拷贝数异常检出率为5.62%(31/552);两组比较差异无统计学意义(χ2=0.031,P=0.860)。
3 讨论
引起自然流产的原因包括遗传因素、环境因素等,其中胚胎的染色体拷贝数改变是最主要的遗传因素,有研究显示约50%的流产物存在染色体异常,其中包括整条染色体改变和结构异常[9-10]。本研究应用NGS对630例绒毛或胎儿组织DNA进行低深度全基因组测序,并进行染色体拷贝数改变分析,结果显示染色体拷贝数改变315例,检出率为50.00%。其中整条染色体增减或改变占大多数,具体为单体64例、三体169例,检出率分别为10.16%和26.83%,该数据与之前的研究结果一致[11]。本次检测另发现7例46,XY/46,XX嵌合,不排除为标本母源污染所致。
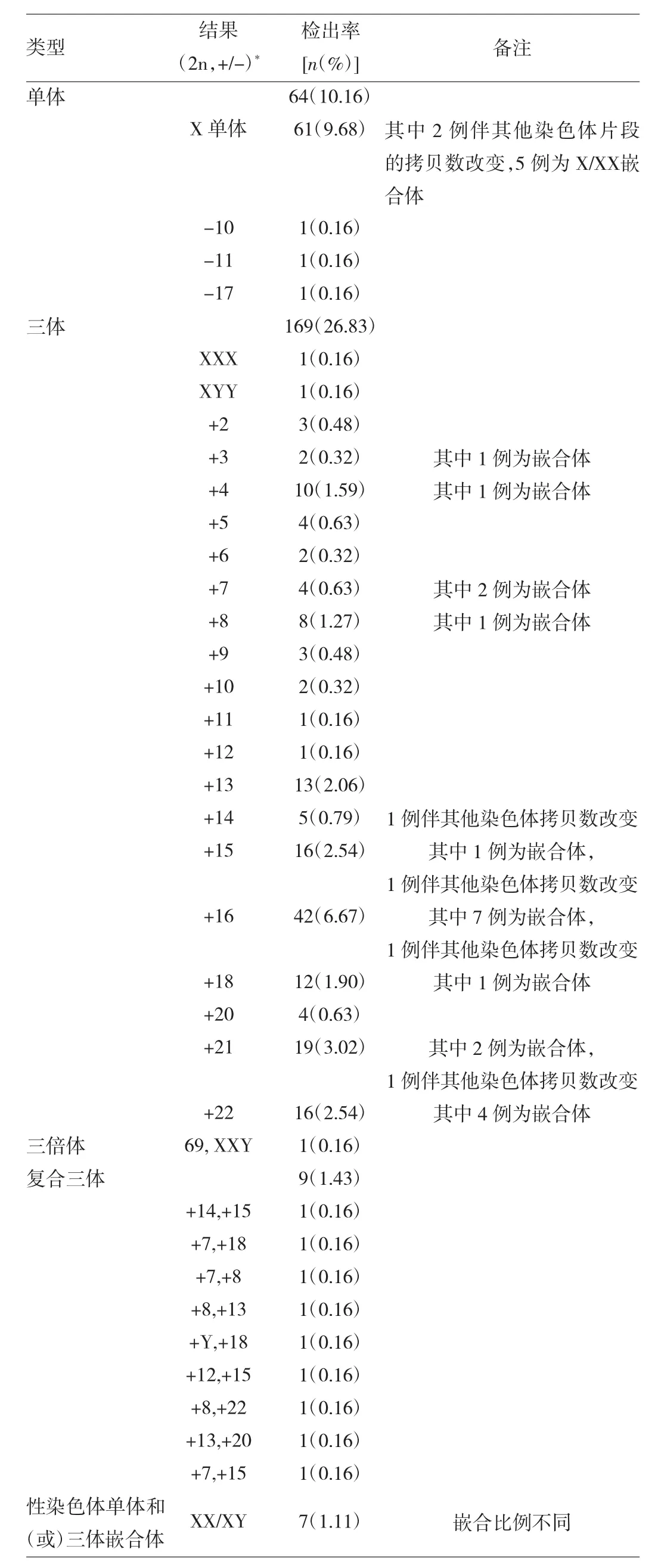
表1 整条染色体增减或改变检出情况

表2 致病性染色体片段拷贝数改变检出情况
除整条染色体增减或改变外,本研究还检出染色体拷贝数改变65例,检出率为10.32%,高于之前的研究报道[12]。经查询Decipher数据库、Database of Genomic Variants数据库和Orphanet数据库,明确致病30例,可能致病5例,临床意义不明确23例,可能良性4例,良性3例,其中明确致病的拷贝数改变检出率为4.76%,与van den Berg等[13]报道一致。致病性染色体片段拷贝数改变(染色体微缺失微重复)可引起临床表现复杂的遗传性综合征[14],其表现为严重精神发育迟滞、智力低下、多器官畸形、癫痫、肌张力减退等。其形成因素有非等位同源重组以及非同源末端连接等[15]。近年来不断有报道提出,染色体拷贝数改变还与早期流产的发生密切相关。张影等[16]通过NGS对252例复发性流产患者的流产绒毛组织进行分析,结果共检出124例(49.21%)发生染色体异常,其中101例为整条染色体改变,23例为染色体拷贝数改变,通过数据库检索发现,检出的染色体片段拷贝数改变多数与早期流产、胚胎停育相关。陈俊坤等[17]采用NGS检测了140例早期流产患者的流产物组织,发现82例(58.57%)的染色体异常,其中67例为整条染色体改变,15例为染色体拷贝数改变。以上研究和本文结果均表明染色体拷贝数改变是引起自然流产的原因之一。本研究中检出的临床意义不明片段拷贝数改变,可能需要根据数据库的更新作进一步分析,即现在的临床意义不明病例可能会重新分类成致病性或良性。
本研究还发现,≥35岁孕妇和<35岁孕妇整条染色体增减或改变检出率分别为44.87%和38.95%,两者比较差异无统计学意义,与以往的研究报道不一致[2]。分析其原因:≥35岁孕妇检测样本量少,仅78例,不能反映该组群体的发生率;而<35岁孕妇检测样本量多,而且针对的是自然流产和死胎患者的染色体拷贝数检出率,阳性率高,不能代表低龄普通群体的检出率,两者比较不能真正反映统计学差异。依据染色体拷贝数变异的发病机制,其遗传变异与母亲年龄无关,故在不同年龄群体中发病率一致,本研究中≥35岁孕妇和<35岁孕妇染色体致病性片段拷贝数改变检出率分别为5.13%和5.62%,两者比较差异无统计学意义,也可说明这一点。
目前,传统的染色体核型分析技术仍然是临床上检测整条染色体改变和大片段的结构异常的金标准,但该方法存在操作过程繁琐、细胞培养周期长、母体细胞容易污染,培养失败等缺点。高通量测序技术具有检测周期短、便捷高效等优点。基于NGS对整条染色体改变和拷贝数改变进行分析,能够在相对较短的时间内发现患者除染色体平衡易位以外的患者染色体片段的异常,可以作为一种有效的遗传学诊断方法在临床应用。

