Box-Behnken法优化人参皂苷Rg1、Re、Rb1提取工艺
赵立春,刘继永
1. 中国农业科学院特产研究所(长春 130112);2. 农业部特种动植物产品质量安全风险评估实验室(长春 130112)
人参(Panax ginseng C. A. Meyer)为五加科人参属植物,其干燥根或根茎是享誉海内外的滋补珍品,素有“百草之王”美誉。据现存最早的中医学专著《神农本草经》中记载:“人参,味甘微寒,主补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智。久服,轻身延年”[1-3]。经大量研究发现,人参化学成分较为复杂,药用价值巨大。人参皂苷作为主要活性成分,具有增强人体免疫、抗衰老、抗疲劳、治疗心血管疾病等功效[4]。随着先进仪器设备的使用,在其分离提纯与结构鉴定等方面取得了巨大的收获。由早前的煎煮、浸渍法等单纯物理提取,到超声、超临界提取法,再到多种仪器设备综合使用,先后建立30多种人参皂苷的提取方法,且在不断精进优化[5-12]。
超声提取人参皂苷方法简便安全、成本低、污染较小,提取效率较高,深受广大科研工作者的亲睐[13]。试验通过考察单因素对提取率的影响,设计Box-Behenken四因素三水平试验,优化人参皂苷提取工艺。
1 材料与方法
1.1 原料与试剂
人参(2017年9月采自吉林省万良市,经中国农业科学院特产研究所刘继永研究员鉴定,为5年生人参),于45 ℃恒温干燥箱烘干至恒重,粉碎,过60目筛。
三氯甲烷、乙醇(均为分析纯,国药);甲醇、乙腈(均为色谱纯,美国Fisher);人参皂苷标品Rg1(批号Z13O8L45576)、Re(批号B10M8S35243)、Rb1(批号Z16J9X52719):上海源叶生物科技有限公司;超纯水,电导率为0.1~0.055 μ s/cm;等。
1.2 仪器与设备
液-质-质联用仪(美国Waters Xevo TQ);十万分之一电子天平(梅特勒-托利多 XSA205DU);数控超声波清洗器(昆山市超声仪器有限公司);DK-98-ⅡA电热恒温水浴锅(天津泰斯特仪器有限公司);多样品平行蒸发仪(瑞士步琦 Syncore);电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂);其他玻璃仪器(天津玻璃仪器厂)。
1.3 试验方法
1.3.1 人参皂苷供试品制备
精密称取5.000 g人参样品,用滤纸包好,放于索氏回流提取器中,加入三氯甲烷回流提取3 h。残渣挥干三氯甲烷。按照试验要求加入一定比例的提取溶剂,浸泡过夜,超声提取,过滤,弃去初滤液,精确量取25 mL滤液,减压浓缩近干,用甲醇溶解定容至100 mL,过0.22 μ m有机滤膜,备用。
1.3.2 人参皂苷含量测定
1.3.2.1 混合对照品溶液的制备
精密称取适量28种人参皂苷标准品,加入甲醇溶解配制成含人参皂苷Rg1 19.975 μg/mL、Re 19.396 μ g/mL和Rb1 19.4 μg/mL的混合对照品溶液。
1.3.2.2 色谱条件
色谱柱,ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm);流动相,乙腈(A),0.01%甲酸水(B);流速,0.5 mL/min;柱温,35 ℃;样品温度,19 ℃;进样量,2 μL。梯度洗脱程序:0~4.4 min,19%~19% A;4.4~6.4 min,19%~21% A;6.4~8.8 min,21%~28% A;8.8~13.6 min,28%~31% A;13.6~21.6 min,31%~46% A;21.6~23.2 min,46%~54% A;23.2~25.44 min,54%~54% A;25.44~25.84 min,54%~95% A;25.84~27 min,95%~95% A;27~27.5 min,95%~19% A;27.5~30 min,19%~19% A。
1.3.2.3 质谱条件
离子源采用 HESI-源(Heated ESI-),载气N2,毛细管电压为-280 kV,锥孔反吹气体流量为50 L/h,脱溶剂气温度为450 ℃,脱溶气体流量为1 000 L/h,采用正负离子MRM扫描模式扫描分析,见表1。

表1 UPLC-MS操作质谱条件
1.3.2.4 线性关系的考察
精密吸取1.3.2.1小节中混合对照品溶液,用甲醇依次稀释成不同浓度梯度,以2 μL进样量检测,按一定采集条件,以浓度作横坐标(X),峰面积作纵坐标(Y),绘制标准曲线,得到28种人参皂苷的回归方程。
1.3.2.5 单因素试验
以人参皂苷Rg1、Re、Rb1提取率作响应值,控制单因素变量,依次考察提取溶剂及浓度(水饱和正丁醇,40%,50%,60%,70%和80%乙醇)、料液比(1∶30,1∶40,1∶50,1∶60和1∶70(g/mL))、超声功率(320,400,480,560和640 W)、超声温度(30,40,50,60和70 ℃)、超声时间(20,30,40,50和60 min)、超声次数(1,2,3和4次)对人参皂苷提取率的影响。
1.3.2.6 Box-Behenken法试验设计
综合单因素试验,根据Box-Behenken设计原理,设计四因素三水平试验表,即设计29个试验点,包括24个分析点和5个零点。精确称取5.000 g样品,选择试验因素及其水平值,分析结果,优化建立人参皂苷提取工艺。
2 结果与分析
2.1 标准品线性关系的考察(参见表2)

表2 人参皂苷的线性回归方程
2.2 单因素试验
2.2.1 提取溶剂对人参皂苷提取率的影响
按1.3.1小节操作步骤,以超声功率320 W、料液比1∶50(g/mL)、超声时间30min、超声温度30℃、超声2次为试验定量,考察水饱和正丁醇、乙醇(40%,50%,60%,70%和80%)对人参皂苷提取率的影响,结果见表3。当提取溶剂为70%乙醇时,3种皂苷的提取量最高,且色谱图峰形较好,响应值较高,无杂质峰干扰。故选定提取溶剂为70%乙醇。

表3 提取剂对人参皂苷提取率的影响
2.2.2 超声次数对于人参总皂苷提取率的影响
按1.3.1小节操作步骤,以70%乙醇作提取剂、超声功率320 W、料液比1∶50(g/mL)、超声时间30 min、超声温度30 ℃为试验定量,考察超声次数对人参皂苷提取率的影响,结果见表4。当超声次数为3和4次时,3种人参皂苷的提取率最高。但是由于超声4次时,与超声3次的差别太小,即浪费时间,成本又高。故选择超声3次作为试验条件。

表4 超声次数对人参皂苷提取率的影响
2.2.3 超声功率对人参皂苷提取率的影响
按1.3.1小节操作步骤,以70%乙醇作提取剂,超声3次,以料液比1∶50(g/mL)、超声时间30 min、超声温度30 ℃为试验定量,考察超声功率对人参皂苷提取率的影响,结果见表5。3种人参皂苷的提取率走势大致相同,当超声功率为480 W时,提取率达到最大值。故选择320,480和640 W作因素水平,对应编码值为-1,0和+1。

表5 超声功率对人参皂苷提取率的影响
2.2.4 超声温度对于人参皂苷提取率的影响
按1.3.1小节操作步骤,以70%乙醇作提取剂,超声3次,以超声功率480 W、料液比1∶50(g/mL)、超声时间30 min为试验定量,考察超声温度对人参皂苷提取率的影响,结果见表6。当超声温度为60 ℃时,3种人参皂苷的提取率最高。将温度的50,60和70 ℃作因素水平值,对应编码值为-1,0和+1。
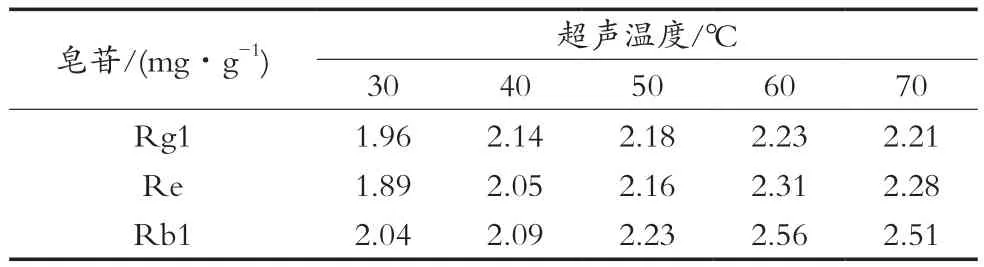
表6 温度对人参皂苷提取率的影响
2.2.5 料液比对于人参皂苷提取率的影响
按1.3.1小节操作步骤,以70%乙醇作提取剂,超声3次,以超声功率480 W、超声温度60 ℃、超声时间30 min为试验定量,考察料液比对人参皂苷提取率的影响,结果见表7。当料液比为1∶50(g/mL)时,3种人参皂苷的提取率最高。将料液比1∶30,1∶50和1∶70(g/mL)作因素水平值,对应编码值为-1,0和+1。
2.2.6 超声时间对于人参皂苷提取率的影响
按1.3.1小节操作步骤,以70%乙醇作提取剂,超声3次,超声功率480 W、超声温度60 ℃、料液比1:50(g/mL)为试验定量,考察超声时间对人参皂苷提取率的影响,结果见表8。当超声时间为30 min时,3种人参皂苷的提取率最高。将超声时间20,30和40 min作因素水平值,对应编码值为-1,0和+1。

表7 料液比对人参皂苷提取率的影响

表8 超声时间对人参皂苷提取率的影响
2.3 工艺条件优化的响应面分析结果
根据表9安排试验,最终试验结果如表10所示。

表9 Box-Behenken法试验各因素水平

表10 Box-Behnken试验结果
利用SAS 9.2分析Box-Behnken试验所得出的3种人参皂苷提取率,进行多元回归拟合,得到人参皂苷提取率(Y)对于超声功率(X1)、超声温度(X2)、料液比(X3)和超声时间(X4)的多元二次回归方程。
2.3.1 人参皂苷Rg1的响应面优化
考察超声提取人参皂苷Rg1的影响因素及其交互作用对提取率的影响。
由表11可知,其预测模型的p<0.001,表明影响极显著;其失拟项p=0.153 8>0.05,不显著,说明其拟合较好,能够说明模型对真实值情况的模拟较为准确。综上,该预测模型可以用于人参皂苷Rg1的提取工艺的优化。所得到的多元二次回归方程为:Y=-23.66+0.207 5X1+0.499 6X2+8.881×10-2X3+0.206 2X4-3.75×10-5X1X2-6.25×10-6X1X3-3.75×10-5X2X3-5.0×10-5X1X4+5.0×10-5X2X4+3.75×10-5X3X4-1.681×10-3X12-4.148×10-3X22-9.03×10-4X32-3.411×10-3X42。R2=0.996 8,接近于1,模拟程度较好。
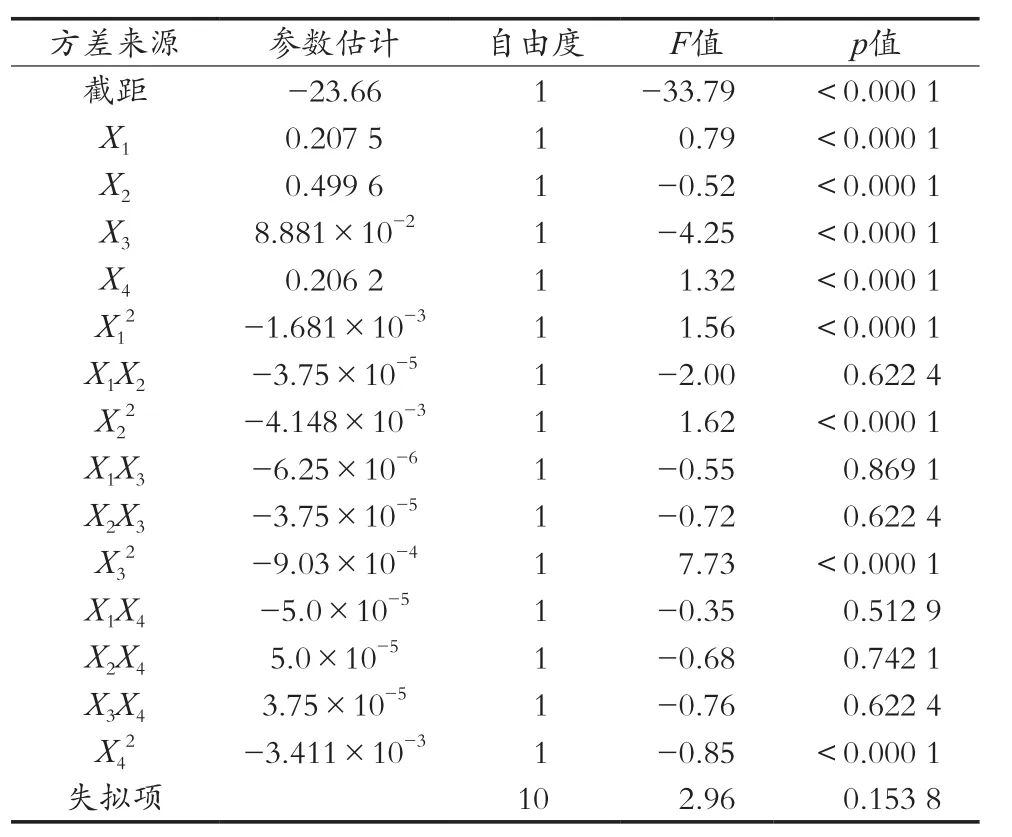
表11 人参皂苷Rg1响应面回归模型的方差分析
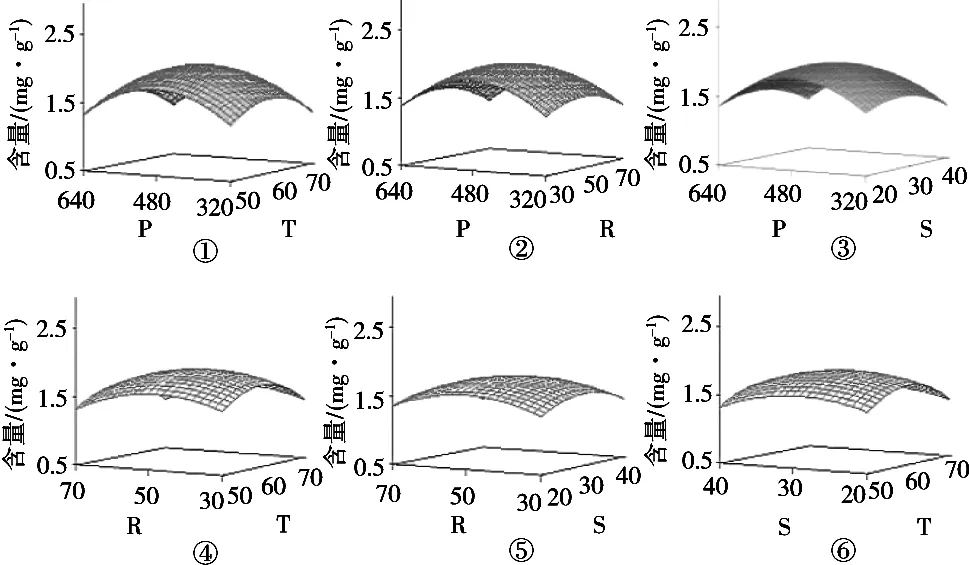
图1 各因素间交互作用对于人参皂苷Rg1提取率的响应曲面图
通过SAS 9.2软件响应面设计分析所得到曲面图,如图1所示。图1中①,②和③的交互作用对于人参皂苷Rg1的影响较大,其余影响较小。采用SAS 9.2软件计算所得,当超声功率为484 W,超声温度为60.3℃,料液比为1∶50.8(g/mL),超声时间为30.5 min时,人参皂苷Rg1含量为3.1 mg/g。
2.3.2 人参皂苷Re的响应面优化
由表12可知,其预测模型的p<0.001,表明影响极显著;其失拟项p值为0.141 7,说明其拟合较好,能够说明模型对真实值情况的模拟较为准确。综上,该预测模型可以用于人参皂苷Re的提取工艺的优化。所得到的多元二次回归方程为:Y=-13.16+7.538×10-2X1+0.344 9X2+5.558×10-2X3+8.718×10-2X4+2.5×10-5X1X2-2.5×10-5X1X3-6.25×10-5X2X3-3.75×10-5X1X4-1.75×10-4X2X4-1.75×10-4X3X4-6.05×10-42.781×10-3-4.3×10-4-1.031×10-3。R2=0.941 2,接近于1,模拟程度较好。

表12 人参皂苷Re响应面回归模型的方差分析

图2 各因素之间交互作用对于人参皂苷Re提取率的响应曲面图
通过SAS软件响应面设计分析所得到曲面图,如图2所示。除图2中①对人参皂苷Re的影响较明显外,其余影响所形成曲面图形状大致相同,影响不大。采用SAS 9.2软件计算所得,当超声功率为492.32 W,超声温度为60.71 ℃,料液比为1∶52.05(g/mL),超声时间为31.59 min时,人参皂苷Rg1含量为2.45 mg/g。
2.3.3 人参皂苷Rb1的响应面优化
由表13可知,其预测模型的p<0.001,表明影响极显著;其失拟项p=0.417 6,说明其拟合较好,能够说明模型对真实值情况的模拟较为准确。综上,该预测模型可以用于人参皂苷Rb1的提取工艺的优化。所得到的多元二次回归方程为:Y=-14.49+0.169 8X1+0.353 7X2+4.429×10-2X3+5.226×10-2X4-2.5×10-5X1+8.75×10-5X2X3-6.25×10-5X1X4-2.5×10-5X2X4-1.0×10-4XX-1.371×10-3X2+9.222×10-5-4.4×10-4-3416.47×10-4。R2=0.988 8,接近于1,模拟程度较好。

表13 人参皂苷Rb1响应面回归模型的方差分析

图3 各因素之间交互作用对于人参皂苷Rb1提取率的响应曲面图
通过SAS软件响应面设计分析所得到曲面图,如图3所示。图3中①,②和③图对人参皂苷Re的影响较明显,其余影响所形成曲面图较平缓,影响不大。采用SAS 9.2软件所得,当超声功率为484.96 W,超声温度为60.91 ℃,料液比为1∶52.73(g/mL),超声时间为32.19 min时,人参皂苷Rg1含量为3.44 mg/g。
2.4 提取工艺比较
根据Box-Behnken设计试验结果,最终得到3种人参皂苷Rg1、Re、Rb1的最佳提取工艺参数,其结果见表14。分析3种人参皂苷的提取条件,依据实际情况获得提取3种皂苷的实际参数。

表14 3种人参皂苷的提取工艺的比较
2.5 工艺验证试验
参照2.3小节,并按照1.3.2小节进行超高液相色谱-串联质谱检测,分别进行3批验证试验,结果见表15,真实的人参皂苷提取率与模型预测值RSD低于2.86%,说明试验的重复性较好。
3 结论
超声提取人参皂苷是现在较为常用的一种提取人参皂苷的方法,操作简便,耗时较短,成本低廉,能够满足现在实验室的人参皂苷的提取检测要求。以70%乙醇作提取剂,超声3次,当超声功率为480 W,温度为60 ℃,料液比为1∶50(g/mL),超声时间为30 min时,人参皂苷Rg1、Re、Rb1的提取率达到最高,分别为3.10,3.44和2.45 mg/g。且28种人参皂苷的回收率在82%~103%之间,回收率较好。该方法能够满足试验需求,同时为多种人参皂苷的提取提供了技术参考,又为人参工业化生产提供了理论参考。
——以羌族舞歌《叶忍》为例
——《幽默曲》赏析

