56例成人still病临床特征分析
杜文清,杜彦萍,池淑红
成人still病(AOSD)是一种病因不明的以高热、皮疹、关节痛和血白细胞增多为主要表现的全身性炎症性疾病。AOSD无特异性诊断方法,属于排他性疾病,故临床上误诊率及漏诊率较高[1]。本文回顾性地分析了近10年来宁夏医科大学总医院就诊的56例AOSD患者的临床资料,总结药物治疗经验,现报告如下。
1 资料与方法
1.1 一般资料:选择宁夏医科大学总医院风湿免疫科、呼吸与危重症医学科、感染疾病科、急诊内科病房于2011年1月-2020年5月收治的AOSD患者56例,其中男性17例(30.36%),女性39例(69.64%),男女之比为1∶2.29;年龄16~72岁,平均(36.03±13.69)岁。所有患者符合1992年日本AOSD研究委员会提出的分类标准[2]。主要标准: ①体温>39 ℃并持续1周以上;②关节痛持续2周以上;③典型皮疹;④白细胞增高>10×109/L(中性粒细胞>0.80)。次要标准:①咽痛;②淋巴结和(或)脾大;③肝功能异常;④类风湿因子阴性和抗核抗体阴性。排除感染性疾病、恶性肿瘤及其他风湿病。以上分类标准中符合5项或以上(其中主要指标符合2项或以上)者即可诊断为AOSD。
1.2 方法:观察患者血常规、肝功能、红细胞沉降率(ESR)、C反应蛋白(CRP)、血清铁蛋白(FER)、降钙素原(PCT)、抗核抗体(ANA)、类风湿因子(RF)、白介素6(IL-6)、血培养结果。
1.3 临床表现:56例患者中,55例(98.21%)发热,关节痛为最常见的临床症状,有48例(85.71%),其次为皮疹45例(80.36%)、咽痛40例(71.43%),皮疹伴有瘙痒者18例(32.14%),肝损害患者有13例(23.21%),33例患者伴有肌肉酸痛(58.93%),31例患者淋巴结肿大(55.36%);有21例(37.50%)患者在确诊AOSD时合并肺部感染;有12例患者伴有脾大、病毒感染;疾病进展过程中有2例患者继发巨噬细胞活化综合征(MAS),见表1。
1.4 实验室结果
1.4.1 血常规:56例患者均行血常规检查,49例(87.50%)患者白细胞总数>10.0×109/L,平均值为(16.86±7.00)×109/L;41例(73.21%)患者中性粒细胞相对值>80%,平均值为(83.98±8.65)%。
1.4.2 ESR、CRP、FER检查:51例(91.07%)患者ESR增快,平均值为(62.61±33.73)mm/H;55例(98.21%)患者CRP升高,平均值为(101.38±62.76)mg/L;所有患者FER均升高,平均值为(1718.11±443.01)ng/mL。
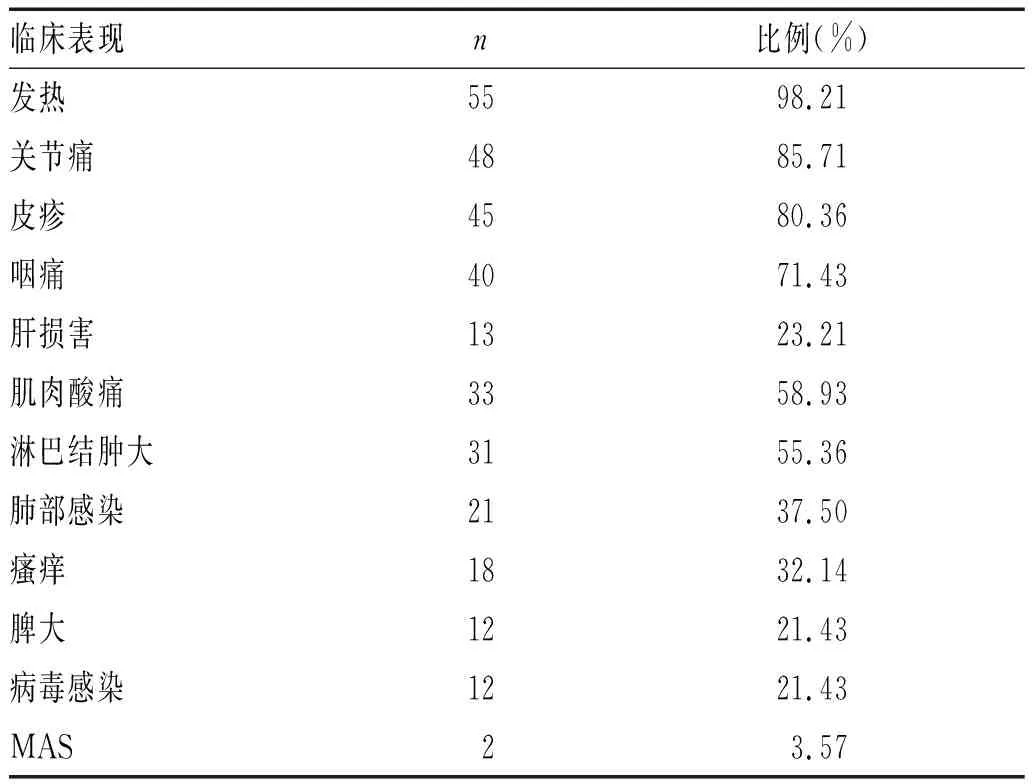
表1 56例AOSD患者临床表现
1.4.3 肝功能检查:转氨酶升高患者大多数以丙氨酸氨基转移酶升高为主。
1.4.4 IL-6检测:22例患者行IL-6检测,17例(77.27%)患者IL-6升高,平均值为(46.59±69.00)pg/mL。
1.4.5 骨髓穿刺:45例患者行骨髓穿刺术,37例(82.22%)为感染骨髓象,其中1例可见噬血细胞。自身免疫相关指标常为阴性,其中41例(73.21%)ANA为阴性,100%患者RF阴性,均无自身免疫相关疾病,见表2。
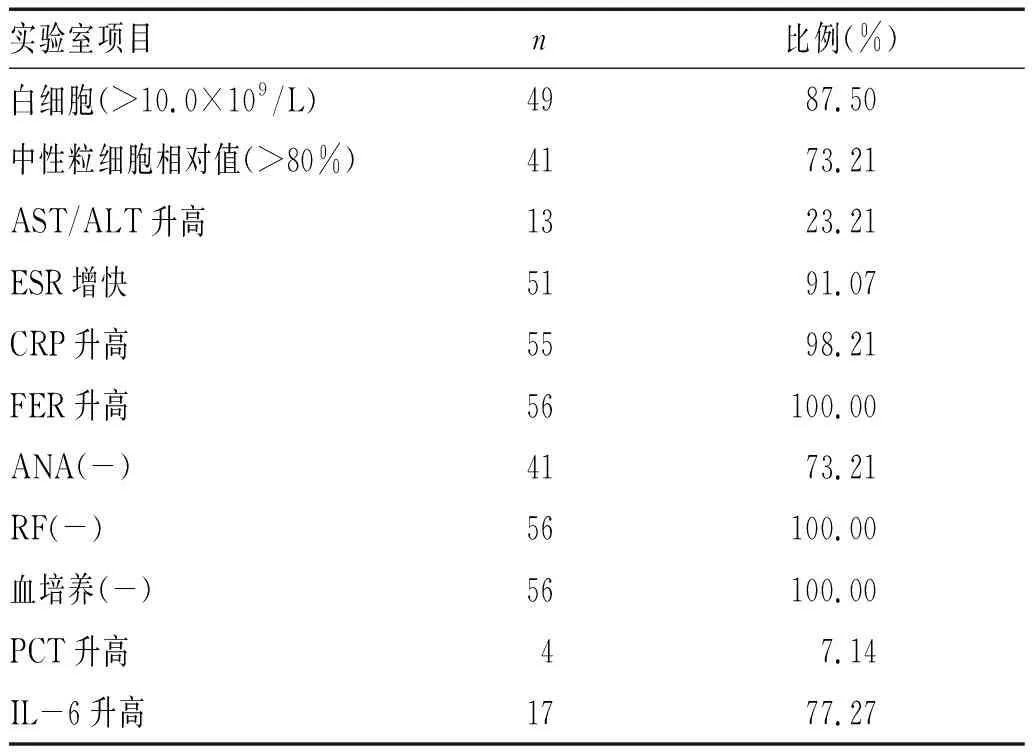
表2 56例AOSD实验室结果
1.5 治疗与转归:本研究中22例患者使用非甾体抗炎药物,效果不明显,所有患者均使用激素治疗,其中25例使用甲泼尼龙40~160 mg静脉滴注,9例使用醋酸泼尼松20~60 mg口服,22例使用地塞米松5~20 mg静脉滴注。19例联合使用甲氨喋呤、9例联合使用硫酸羟氯喹、7例联合使用环孢素、1例联合使用环磷酰胺。大部分患者在使用上述治疗前使用广谱抗生素治疗,且治疗效果不佳。56例患者中死亡2例,其中1例合并MAS后死于重症感染。
45例(80.36%)患者经糖皮质激素治疗后体温高峰下降或未再发热,皮疹消退或无新发皮疹,关节、肌肉酸痛缓解,血常规中白细胞、中性粒细胞相对值、ESR、CRP下降,治疗好转后出院,并将激素调整为醋酸泼尼松口服。另有11例患者在大剂量糖皮质激素或激素冲击治疗后病情仍难以控制,体温高峰不降、皮疹反复,炎性指标、FER居高不降,或激素减量后病情反复,属于难治性AOSD,其中有3例患者联合使用人免疫球蛋白,9例使用托珠单抗(8 mg/kg),使用托珠单抗的9例患者中有2例合并MAS,见表3。

表3 56例AOSD治疗方法及病情转归[n(%)]
2 讨论
AOSD首次由[3]Bywaters于1971年描述,发病率女性多于男性,多为中老年女性;林冰[4]在101例AOSD患者中,也发现女性多于男性,与本研究结果一致。本组患者主要表现为发热、皮疹、关节痛,其次为咽痛、肌肉酸痛、淋巴结肿大,与国内相关研究一致[5]。发热主要表现为弛张热,皮疹常与发热伴行,表现为热退疹消,部分患者皮疹伴有瘙痒,大部分患者伴有肌肉酸痛。56例患者中有13例合并肝损,其中有4例合并肝衰竭,病因尚不明确,可能与AOSD的变态反应导致的巨噬细胞活化和细胞因子产生有关[6],也有学者认为可能与非甾体抗炎药与抗生素的使用有关[7],但针对疾病本身,在病情急性期也会出现肝损,这不仅是诊断本病的次要标准,还是病情活动的指标[8]。本研究4例肝衰竭患者入院前肝功能正常,考虑急性重度肝损伤的原因可能主要与疾病高度活动有关。本组患者中有一半以上患者出现淋巴结肿大,多数患者淋巴结穿刺提示反应性增生,均未查见恶性细胞。AOSD属于排他性疾病,临床上需排除感染、肿瘤、自身免疫系统疾病。本研究56例患者中有21例合并肺部感染,12例合并病毒感染,多数为单纯疱疹病毒感染、巨细胞病毒感染,部分为乙型副流感病毒感染,虽然有4例患者PCT升高,但所有患者血培养均为阴性,经积极广谱抗感染、抗病毒治疗后无效。因此,应综合其已有的临床表现及实验室检查做出早诊断、早治疗,降低误诊率。
AOSD缺乏特异性实验室指标,多通过血白细胞、中性粒细胞数量增多及炎性指标如ESR、超敏CRP、IL-6升高及血清铁蛋白升高来判断,多数研究表明血清铁蛋白指标对AOSD有一定诊断意义,且指标升高超过正常值5倍诊断特异性高[9],本研究中所有患者血清铁蛋白均明显升高,有94.64%超过正常值5倍,可将血清铁蛋白作为AOSD诊断标准和判断疗效指标之一。若在治疗过程中血清铁蛋白居高不降,或持续上升,多提示预后不佳,具有预警作用。与既往研究一致[10],本研究中绝大多数患者ESR、CRP、IL-6明显升高,缺乏特异性,不能作为诊断标准,但对辅助诊断及病情活动、预后判断提供了重要信息。
AOSD尚无标准治疗方案,目前主要有非甾体抗炎药、糖皮质激素和免疫抑制剂[11],非甾体抗炎药曾被推荐为AOSD初始治疗药物,但其应答率仅为 20%,仅用于轻症患者或与其他药物合用[12]。本研究中有39.29%患者使用非甾体抗炎药,但均与其他药物合用,效果不佳。糖皮质激素是目前治疗AOSD的主要药物,据报道有效率可达 76%~95%[13],与本研究相符,其中反复高热的患者选用地塞米松,病情危重需要激素冲击者选用甲泼尼龙,出院时均调整为醋酸泼尼松。在免疫抑制剂的选用上,最常用的有甲氨蝶呤,其次包括环孢素、硫唑嘌呤、硫酸羟氯喹、环磷酰胺、来氟米特、他克莫司[14]等,本组患者中有19例合用甲氨蝶呤以减少激素剂量,其本身副作用也较少,另有7例患者选用环孢素,旨在血三系减低,或有MAS倾向时使用。
目前AOSD发病机制不明确,有研究表明IL-6可能参与了AOSD发病,并且参与了血清铁蛋白、CRP、白细胞水平的增高[15],托珠单抗是一种人源化抗IL-6R抗体,与IL-6R的膜结合和可溶性结合,可作为治疗AOSD的有效生物制剂[16],本研究中的11例难治性AOSD患者中有9例给予托珠单抗治疗后病情好转,但有2例患者合并MAS。MAS为AOSD严重并发症之一[17],是巨噬细胞异常活化引起的以发热、血细胞减少、肝脾肿大、肝功能异常等为特征的急性全身性炎症综合征。本研究中有2例AOSD继发MAS,占同期研究56例AOSD患者的3.57%,比国外报道比例低[18],考虑与研究病例数少有关。本组2例MAS均发生在AOSD复发阶段,也有文献报道AOSD稳定阶段也可继发MAS,由此可见,MAS可发生于AOSD任何阶段。MAS病情凶险、病死率高,应尽早识别,本组2例MAS患者中就有1例因重症肺部感染最终死亡。托珠单抗与MAS之间的机制尚不清楚,可能是因为细胞因子阻断后靶因子水平瞬间升高,从而导致AOSD或MAS恶化;另一个可能原因是在AOSD活动期,产生的细胞因子数量大量增加,仅抑制IL-6可能导致细胞因子风暴加剧[19]。但由于 AOSD 本身就可引起 MAS,所以很难将托珠单抗治疗导致的MAS与AOSD继发的MAS区别开来。

