弥散峰度成像预测急性一氧化碳中毒迟发脑病
张艳利,王天红,郭顺林,雷军强*,王帅文,南 江,王少彧,岳梦颖
(1.兰州大学第一医院放射科 甘肃省智能影像医学工程研究中心 精准影像协同创新甘肃省国际科技合作基地,甘肃 兰州 730000;2.兰州大学第一医院神经内科,甘肃 兰州 730000;3.西门子医疗系统有限公司磁共振事业部,上海 200000)
迟发性脑病(delayed encephalopathy, DE)是指急性一氧化碳中毒(acute carbon monoxide poisoning, ACOP)患者神志清醒后,经过2~40天(平均22天)的假愈期,突然发生以痴呆、精神症状和锥体外系症状为主的神经系统疾病[1-2],常导致患者工作和日常生活能力下降[3]。及时发现有DE危险的中毒患者,对于提供有效治疗以降低DE发生风险至关重要。脑白质脱髓鞘被认为是DE的主要病理学特征[1-3]。既往研究[4-5]多应用弥散张量成像(diffusion tensor imaging, DTI)评估DE白质损害,预测DE发生的相关研究较少。弥散峰度成像(diffusion kurtosis imaging, DKI)是DTI技术的延伸,可较DTI更敏感、准确地反映组织微观结构变化[6]。本研究探讨DKI预测DE的应用价值。
1 资料与方法
1.1 研究对象 前瞻性收集2016年11月—2019年2月就诊于兰州大学第一医院的75例ACOP患者,男37例,女38例,年龄25~64岁,平均(47.4±9.7)岁。纳入标准:①符合ACOP国家诊断标准(GB87-88)[7];②急性中毒时间<7天。排除标准:①既往有脑炎、脑外伤、肿瘤、脑血管病、代谢性脑病、癫痫、精神疾病等病史;②其他气体中毒;③婴幼儿。随访3个月,根据是否发生DE分为DE组和非DE组。DE组22例,男13例,女9例,平均年龄(46.7±10.1)岁;非DE组53例,男24例,女29例,平均年龄(47.7±9.6)岁。
DE诊断标准[2]:①有明确ACOP病史;②有明确假愈期;③具有以痴呆、精神症状、肌张力增高和震颤麻痹为主的典型临床表现;④随访颅脑MRI显示半卵圆中心和侧脑室旁白质继发脱髓鞘病灶。本研究获得兰州大学第一医院伦理委员会批准(编号:LDYYLL2018-114),患者或家属均签署知情同意书。
1.2 仪器与方法 采用Siemens Magnetom Skyra 3.0T超导型MR仪,标准32通道颅脑专用线圈,于患者急性中毒后7天内进行扫描。常规MR序列包括T1W、T2W、T2W-tirm及弥散加权成像(diffusion weight imaging, DWI)。DKI采用自旋回波序列进行扫描,参数:TR 7 000 ms,TE 100 ms,FOV 240 mm×240 mm,矩阵122×122,在30个方向施加弥散敏感梯度,b值取0、1 000、2 000 s/mm2。各序列采用统一定位线,层厚2.3 mm、层间距0.7 mm。
1.3 图像处理 使用Functool软件处理DKI原始数据,获得平均峰度(mean kurtosis, MK)、轴向峰度(axial kurtosis, AK)和径向峰度(radial kurtosis, RK)图。于半卵圆中心、额叶、颞叶、枕叶、顶叶和胼胝体6个部位选择9个ROI,均为直径3 mm的圆形,在T1WI放置、保存,并在MK、AK及RK图中打开。由2名神经放射主治医师共同确定ROI放置层面(图1)。除胼胝体外,其余部位ROI均于双侧对称放置,系统自动计算平均值。
1.4 临床评价 由2名神经内科医师根据格拉斯哥昏迷量表(Glasgow coma scale, GCS)评分判断意识状态情况。用简易智能精神状态检查量表(mini-mental state examination, MMSE)评估认知功能。
1.5 统计学分析 采用SPSS 22.0软件分析软件。计量资料以±s表示,采用两独立样本t检验比较两组间MK、AK和RK值的差异;对二分类变量采用χ2检验;以ROC曲线评价DKI参数值预测DE发生的效能。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 DE组22例,DE发生时间为ACOP后9~41天,平均(21.45±10.02)天。患者临床基本资料见表1。
2.2 不同ROI的MK、AK及RK值比较 与非DE组相比,DE组各ROI的MK、AK及RK值呈升高趋势(图2)。DE组半卵圆中心前部MK值明显高于非DE组(P<0.05)。DE组半卵圆中心前部及后部、胼胝体膝部、额叶及顶叶AK值均明显高于非DE组(P均<0.05)。见表2。
2.3 不同ROI的MK、AK及RK值预测DE效能比较 除胼胝体压部及枕叶外,其余ROI的AK值的AUC均高于MK及RK值;比较各ROI的AK值诊断效能,半卵圆中心前部AUC最大(0.78,P<0.01),95%CI(0.68,0.89),以1.05为临界值,诊断敏感度81.82%(18/22),特异度60.38%(32/53),阳性预测值46.15%(18/39),阴性预测值88.89%(32/36),准确度66.67%(50/75)。 见表3。
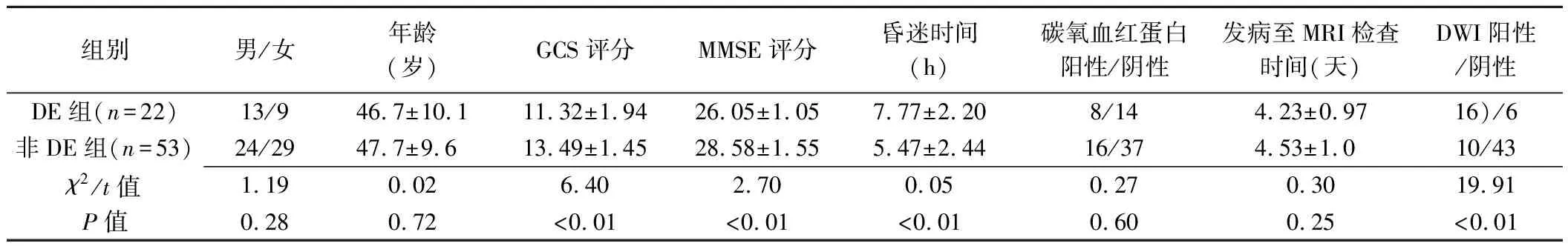
表1 患者资料
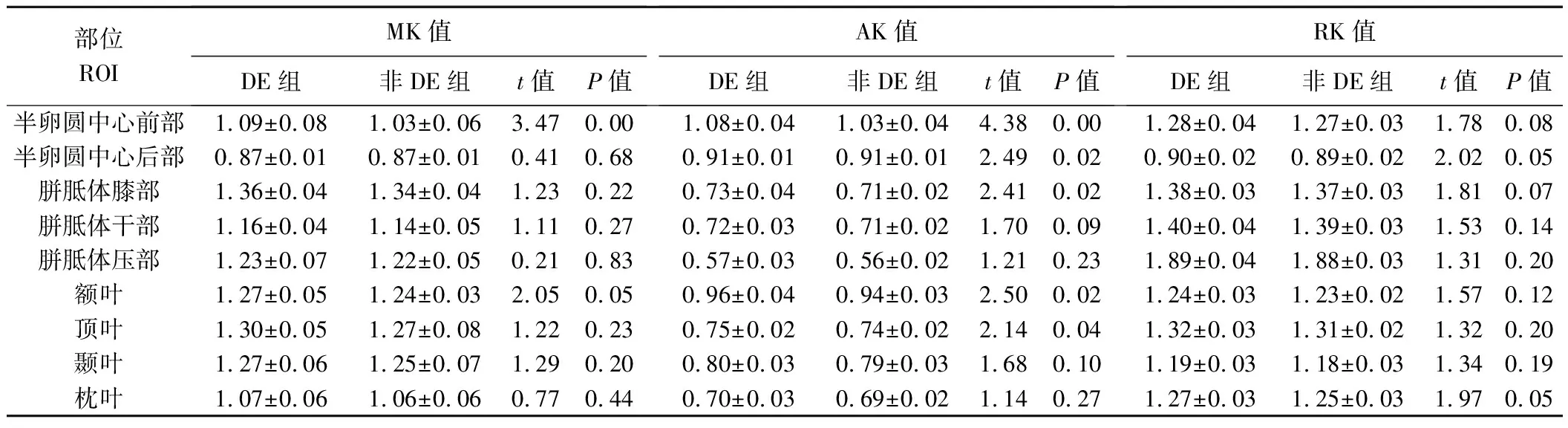
表2 不同ROI的MK、AK及RK值比较
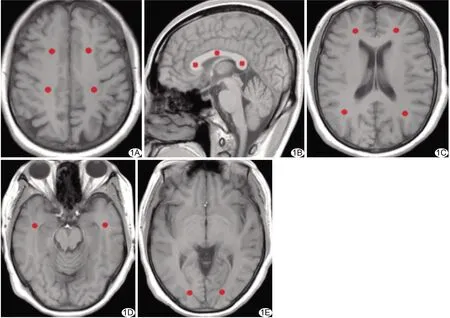
图1各部位ROI A.半卵圆中心前和后部; B.胼胝体膝、体和压部; C.额叶和顶叶; D.颞叶;E.枕叶
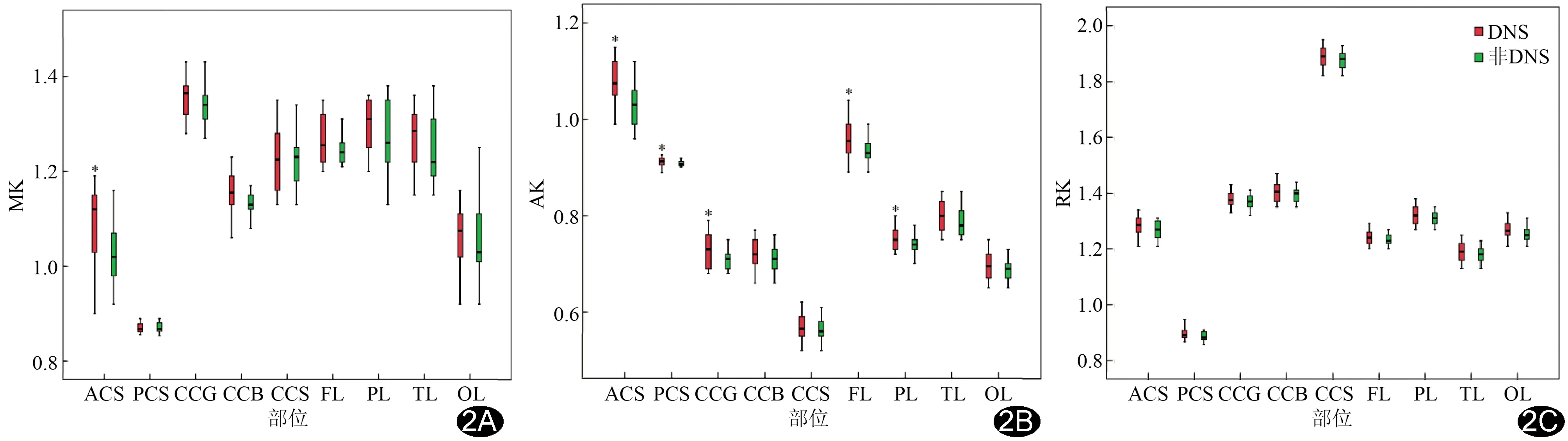
图2 DE组、非DE组各ROI参数值箱图 A.MK; B.AK; C.RK (ACS:半卵圆中心前部;PCS:半卵圆中心后部;CCG:胼胝体膝部;CCB:胼胝体干部;CCS:胼胝体压部;FL:额叶;PL:顶叶;TL:颞叶;OL:枕叶;*:P<0.05)
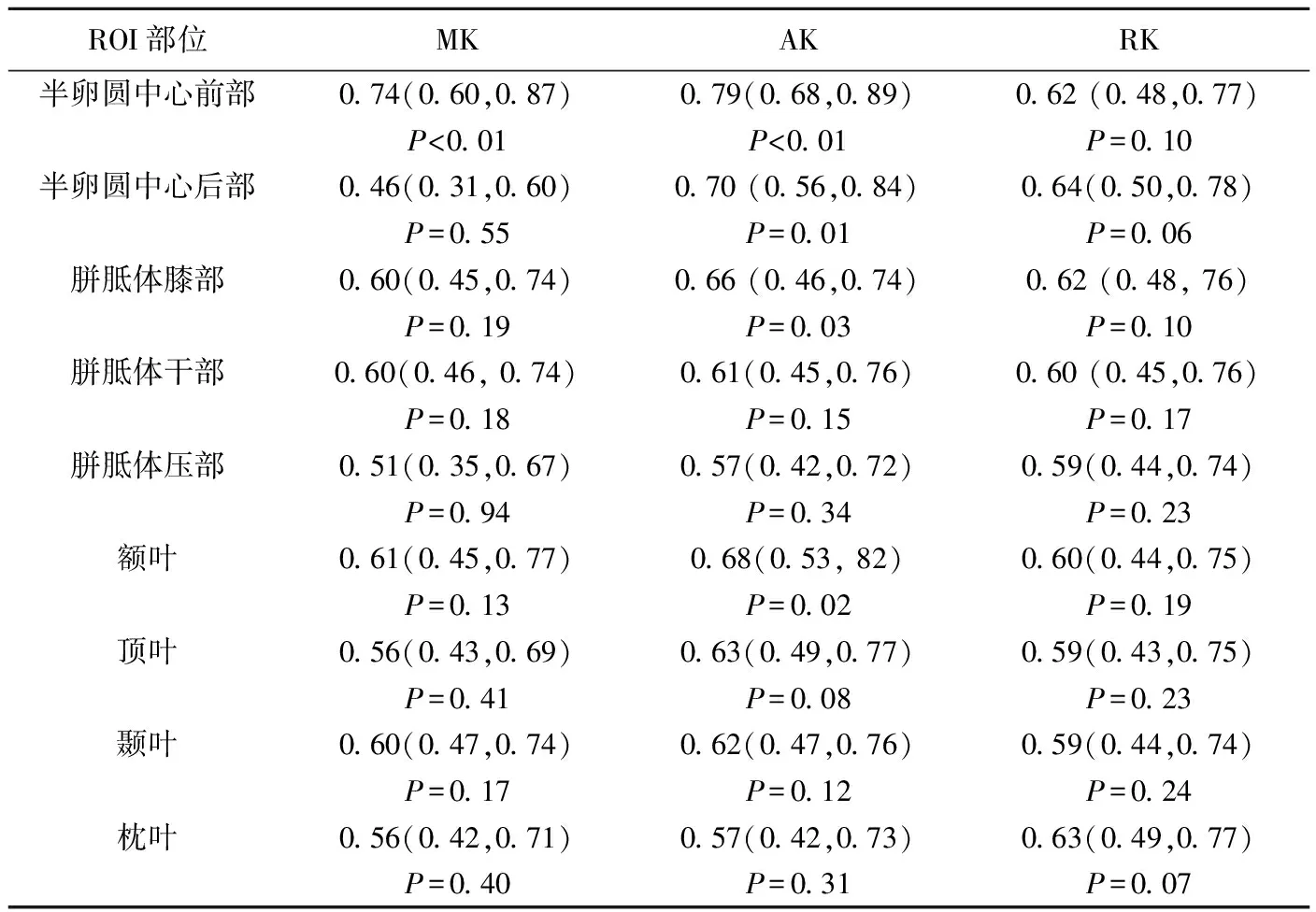
表3 不同ROI的MK、AK及RK值AUC(95%CI)
3 讨论
文献[1]报道,DE最常见白质受损区为半卵圆中心,其次为额叶、颞叶、枕叶、顶叶和胼胝体,本研究MRI随访DE患者结果与之相符。半卵圆中心前部及后部、胼胝体膝部、体部及压部代表不同的功能解剖区[8],故于半卵圆中心、额叶、颞叶、枕叶、顶叶和胼胝体6个部位选择9个ROI进行DKI观察。
DKI参数包括峰度参数和弥散参数,前者对复杂白质排列区(如皮层下白质、放射冠)异常更为敏感[9],因此本研究选取3个峰度参数值(MK、RK和AK)观察其对DE的预测价值。既往研究[6]表明,峰度参数值增高提示细胞微结构密度增加和复杂程度提升,如细胞毒性水肿或肿瘤细胞生长,而其降低提示髓鞘破坏或细胞丢失,如正常衰老和退行性疾病。MK是沿所有扩散梯度编码方向的平均峰度值,但MK≠(AK+2RK)/3,其对轴向或径向主扩散特征向量的敏感性及特异性均低[10],更适用于检出低各向异性或同向性脑区,如丘脑、皮层下白质和皮层病变[11]。AK和RK分别是水分子在平行和垂直于轴突方向上的非高斯性弥散偏倚度。轴突内神经微管和神经丝破坏造成弥散障碍物增多,主要导致AK值升高;组织缩水、细胞膜通透性减低、轴向堆积密度增加及细胞外空间减少主要引起RK值升高[9]。
本研究结果显示,与非DE组相比,DE组各ROI的MK、AK和RK呈升高趋势,提示DE急性期脑白质轴突内微结构复杂程度增加,水分子弥散偏离高斯分布程度加重。另外,2组间多个ROI的AK值差异比RK更明显,提示2组在平行于轴突方向的非高斯性弥散偏倚度差异更大。既往采用DTI观察DE患者脑白质损害的研究结果[5]显示,白质水分子弥散受限主要与平行于神经纤维方向弥散受限有关,而非垂直方向,故认为在早期,细胞骨架破坏、轴突平行的方向上轴突肿胀导致扩散阻力增加、水分子弥散减低,本研究结果与其一致。以往急性缺血性脑卒中研究[12-13]结果显示AK值比RK值具有更高的敏感性,而老龄化[14]、阿尔兹海默病[15]研究结果提示RK具有更高的敏感性。本研究结果与前者一致,推测可能是本组研究对象为ACOP后7天内患者,在此阶段脑组织因缺氧导致血管壁内皮细胞损害、局部微栓子形成,存在继发性缺血性损伤。
本研究DE组半卵圆中心、胼胝体膝部及额顶叶白质AK值明显升高,推测以上部位白质纤维束损害与DE发生关系最密切。半卵圆中心有连接大脑皮层与脑干、脊髓的投射纤维,额顶叶白质为连接同侧半球的弓状纤维,胼胝体膝部则连接两侧额叶的前部,其同时受损则出现精神症状、智力下降、运动、失语及感觉障碍,可能是半卵圆中心、胼胝体膝部及额顶叶白质早期损伤预示将来DE发生及造成DE期患者出现不同临床症状的功能解剖学基础[8]。进一步通过AUC观察3个参数值的诊断效能,发现半卵圆中心前部AK值升高对DE的预测效能最佳,诊断敏感度为81.82%,特异度为60.38%,可能是半卵圆中心前部有锥体束、锥体外系等重要投射纤维走行,且半卵圆中心前部主要连接额叶前部,其内包含较多功能区[8]。
本研究的不足:①难以获得病理活检结果,关于白质损害的病理生理改变讨论均为推论;②手动测量ROI方法存在一定误差,系列研究可使用基于体素分析方法进一步验证DKI预测DE的应用价值。
综上所述,ACOP脑白质区DKI峰度参数值升高与DE发生关系密切,以半卵圆中心前部AK值>1.05可预测DE发生。

