低强度脉冲超声保护MPP+诱导N2a细胞损伤
陈雪莹,杨 珂,王 冬 *,张 亮,王 颖2,,朱 慧,赵钕君,王志刚
(1.重庆医科大学附属第一医院超声科,重庆 400016;2.超声分子影像重庆市重点实验室,重庆 400010;3.重庆医科大学附属儿童医院儿科研究所, 儿童发育疾病研究教育部重点实验室, 儿童发育重大疾病国家国际科技合作基地,儿科学重庆市重点实验室,重庆市干细胞治疗工程技术研究中心,重庆 400014;4.重庆医科大学附属第二医院超声科,重庆 400010)
帕金森病(Parkinson disease, PD)是第二大常见神经退行性疾病,典型症状有静止性震颤、动作迟缓、僵硬及平衡障碍等,主要归因于黑质纹状体系统中的多巴胺能神经元进行性死亡、缺失。在环境和遗传共同作用下,线粒体功能障碍和氧化应激在PD发病过程中具有重要作用[1-2]。目前非侵入方法治疗PD已显示出良好的应用前景,如重复经颅磁刺激[3]、光刺激[4]等。低强度脉冲超声(low-intensity pulsed ultrasound, LIPUS)为安全、非侵入性的超声治疗方法,临床广泛用于骨折后康复治疗[5-6]。近来研究发现LIPUS可触发完整脑回路中的神经元活动及动作电位[7],对血管性损伤[8]及铝超载[9]所致脑损伤具有一定保护作用,由此推测对PD亦可能产生作用。本研究以1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium, MPP+)诱导小鼠神经母细胞瘤Neuro-2a(N2a)细胞株建立PD细胞模型,观察LIPUS是否对 MPP+诱导神经细胞损伤具有保护作用。
1 材料与方法
1.1 主要材料和仪器 N2a细胞株(认知发育与学习记忆障碍转化医学重庆市重点实验室赠与);DMEM高糖培养基、胎牛血清(fetal bovine serum, FBS)、0.25%胰蛋白酶(Gibco公司);1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridiniumion,MPP+)、2',7'-二氯二氢荧光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate, DCFH-DA,Sigma公司);青霉素-链霉素溶液、线粒体膜电位试剂盒(JC-1)、Annexin V-FITC细胞凋亡检测试剂盒;CCK8试剂;总RNA提取试剂盒、Real Master Mix;逆转录试剂盒。超声基因转染仪(重庆医科大学超声影像学研究所)。
1.2 方法
1.2.1 细胞培养及处理 在含10% FBS及1%青霉素-链霉素溶液的DMEM完全培养液中,于37℃、5%二氧化碳浓度恒温培养箱中培养N2a细胞,每2天传代1次。取对数生长期N2a细胞,调整细胞浓度后,根据实验需要接种于96孔板或24孔板内。以不同浓度(0.25、0.5、0.75、1.0和1.5 mmol/L)MPP+作用于N2a细胞24 h后检测细胞存活率,并选择适当MPP+浓度建立PD细胞模型。
将细胞分为对照组、超声对照(LIPUS)组、MPP+组及超声处理(MPP++LIPUS)组。对MPP+组及MPP++LIPUS组加入MPP+(终浓度为0.75 mmol/L),对照组和LIPUS组加入等体积不含血清的DMEM培养基,4 h后对LIPUS组和MPP++LIPUS组进行LIPUS处理(1 MHz,50 mW/cm2,脉冲重复频率为1 kHz,辐照10 min)。加药24 h后检测4组各项指标。
1.2.2 CCK8法检测细胞存活率 每孔加入一定体积CCK8溶液(终浓度为10%),于培养箱中继续培养0.5~1 h后,用酶标仪在450 nm波长处测定各组各孔吸光度(optical density, OD)值,以空白孔数值进行矫正,计算细胞存活率。
1.2.3 JC-1法检测线粒体膜电位 消化收集各组细胞,以1 000 r/min离心5 min,弃上清,按照试剂盒操作说明进行JC-1染色。采用荧光显微镜及酶标仪分别在激发波长为490 nm,发射波长为530 nm及激发波长为525 nm,发射波长为590 nm进行检测。
1.2.4 DCFH-DA法检测细胞内活性氧 消化收集各组细胞,以1 000 r/min 离心5 min,弃上清,装载DCFH-DA探针(10 μmol/L),37℃孵育30 min后PBS洗涤2次。使用荧光显微镜及酶标仪在激发波长为488 nm,发射波长为525 nm进行检测。
1.2.5 AnnexinV-FITC/PI法检测细胞凋亡 消化收集各组细胞,以1 000 r/min 离心5 min,弃上清,按照试剂盒操作说明进行AnnexinV-FITC/PI染色,使用流式细胞仪进行检测。
1.2.6 实时荧光定量PCR检测瞬时受体电位M7(transient receptor potential melastatin 7, TRPM7)的mRNA表达水平 取ddH2O 4.5 μl、2.5×Real Master Mix 7.5 μl、cDNA 2 μl及引物1 μl,共15 μl体系,用Bio-Rad CFX Manager仪器进行检测,以 2-ΔΔCt方法计算所得数据。
1.3 统计学分析 采用Graphpad prism 7统计分析软件。计量资料以±s表示。 组间比较采用单因素方差分析,两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度MPP+对N2a细胞存活率的影响 以不同浓度(0.25、0.5、0.75、1.0和1.5 mmol/L)MPP+作用于N2a细胞24 h后,与对照组相比,各组细胞存活率呈浓度依赖性下降(P均<0.01),即MPP+毒性随浓度增加而增高,见表1。本研究选择0.75 mmol/L 的MPP+浓度建立PD细胞模型,并进行后续实验。
表1 不同浓度MPP+作用24 h对N2a细胞存活率的影响 (±s,n=5)
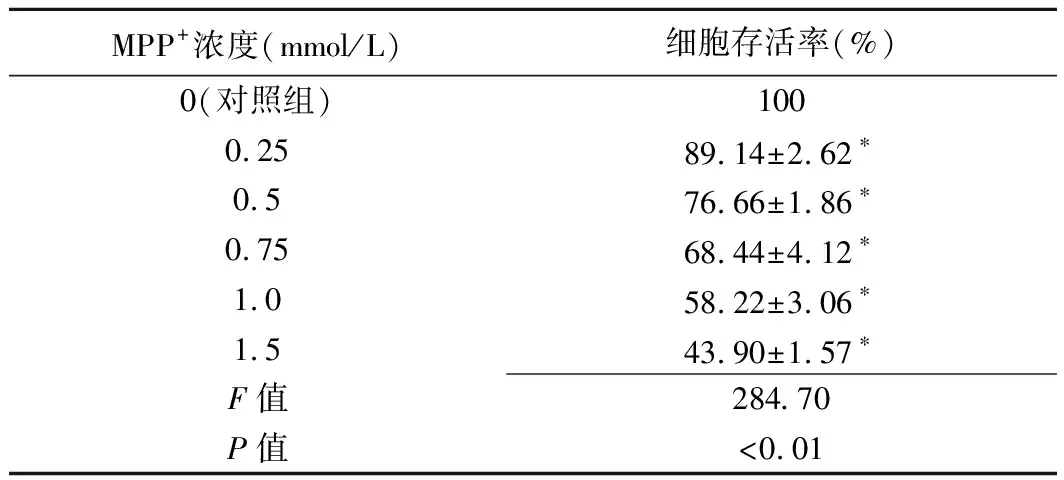
表1 不同浓度MPP+作用24 h对N2a细胞存活率的影响 (±s,n=5)
MPP+浓度(mmol/L)细胞存活率(%)0(对照组)1000.2589.14±2.62∗0.576.66±1.86∗0.7568.44±4.12∗1.058.22±3.06∗1.543.90±1.57∗F值284.70P值<0.01
注:*:与对照组比较,P<0.01
2.2 LIPUS对MPP+诱导N2a细胞存活率的影响 MPP+组N2a细胞存活率较对照组显著下降(P<0.01),而MPP++LIPUS组较MPP+组存活率有所上升(P<0.01),单独LIPUS组对N2a细胞未产生明显细胞毒性(P>0.05),见表2。
2.3 LIPUS对MPP+诱导N2a细胞线粒体膜电位的影响 与对照组相比,MPP+组红色荧光明显减少,绿色荧光明显增多,而MPP++LIPUS组比MPP+组红色荧光增加、绿色荧光减少(图1)。以酶标仪检测红绿荧光强度比值来反应线粒体膜电位的变化,与对照组相比,MPP+组荧光比值明显下降,而MPP++LIPUS组相比MPP+组荧光比值上增多(P均<0.01,表2)。
表2 LIPUS对MPP+诱导的细胞毒性及TRPM7表达的影响(±s,n=3)
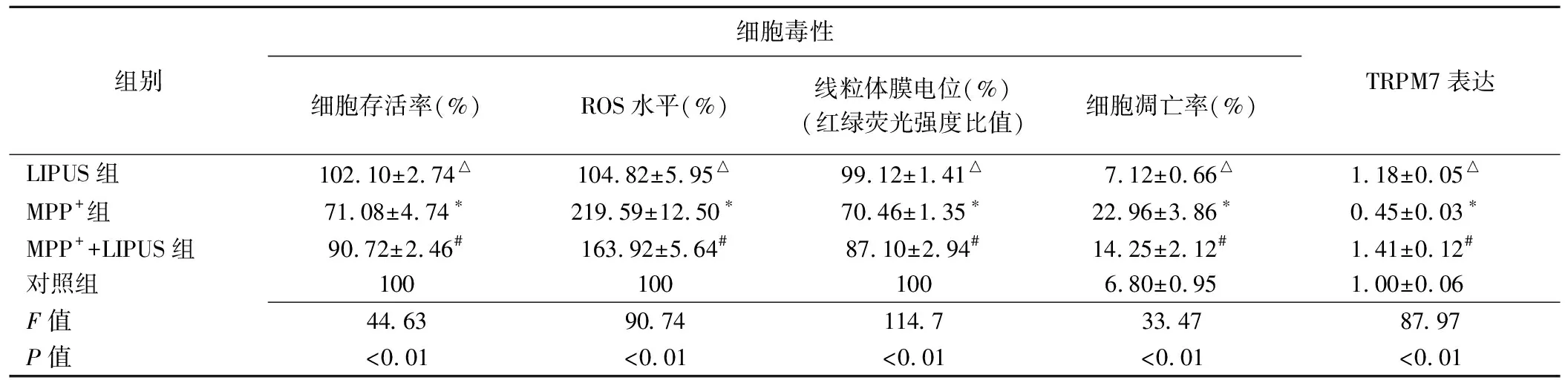
表2 LIPUS对MPP+诱导的细胞毒性及TRPM7表达的影响(±s,n=3)
组别细胞毒性细胞存活率(%)ROS水平(%)线粒体膜电位(%)(红绿荧光强度比值)细胞凋亡率(%)TRPM7表达LIPUS组102.10±2.74△104.82±5.95△99.12±1.41△7.12±0.66△1.18±0.05△MPP+组71.08±4.74∗219.59±12.50∗70.46±1.35∗22.96±3.86∗0.45±0.03∗MPP++LIPUS组90.72±2.46#163.92±5.64#87.10±2.94#14.25±2.12#1.41±0.12#对照组1001001006.80±0.951.00±0.06F值44.6390.74114.733.4787.97P值<0.01<0.01<0.01<0.01<0.01
注:*:与对照组比较,P<0.01;#:与MPP+组比较,P<0.01;△:与对照组比较,P>0.05
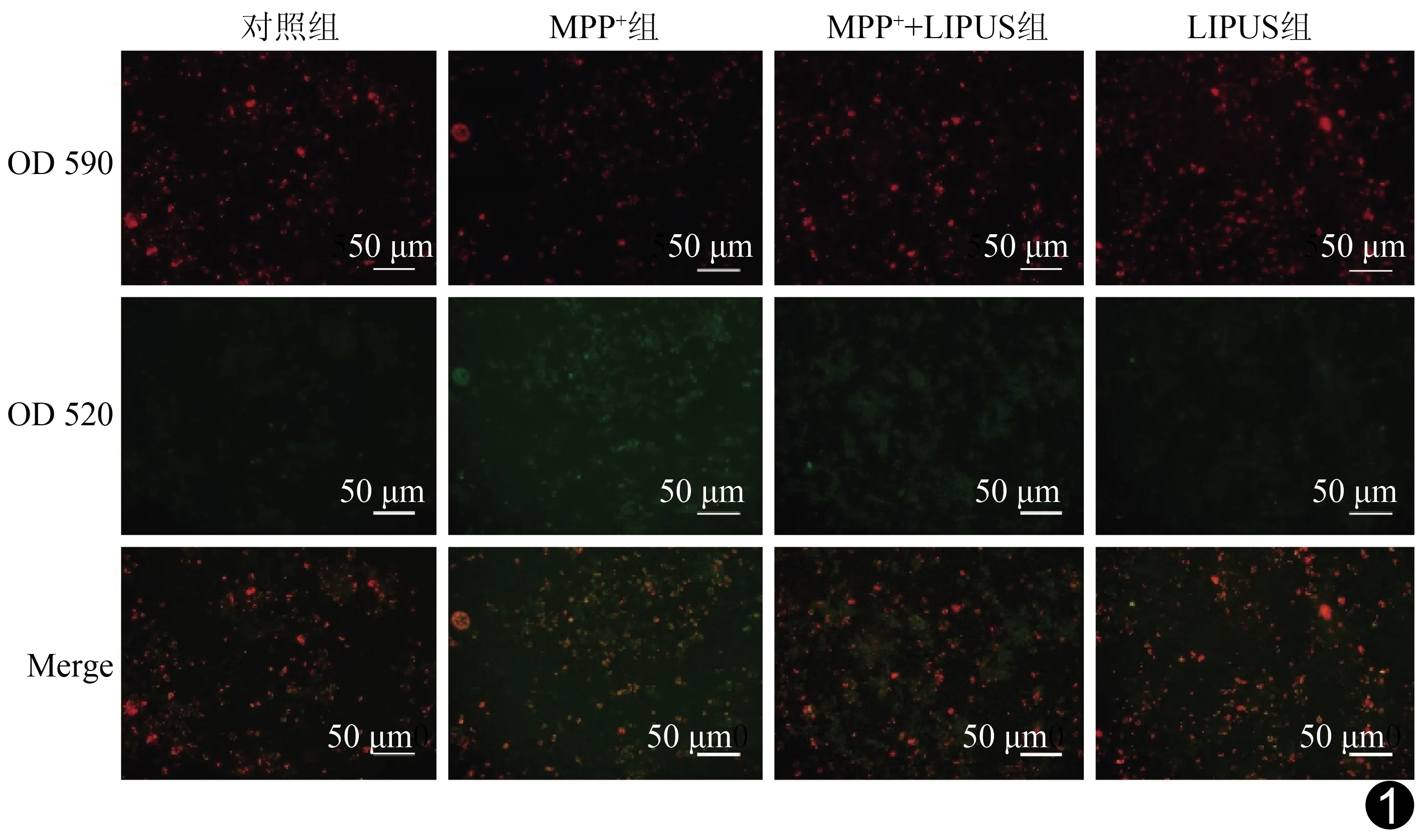
图1 荧光显微镜观察各组JC-1染色结果
2.4 LIPUS对MPP+诱导的N2a细胞内ROS水平的影响 对照组及LIPUS组未观察到明显的绿色荧光,MPP+组细胞的绿色荧光较对照组明显增加,MPP++LIPUS组则较MPP+组有所降低(图2)。酶标仪定量分析结果显示,与对照组相比,MPP+组细胞内ROS水平显著升高(P<0.01),MPP++LIPUS组则较MPP+组细胞内ROS水平有所降低(P<0.01)。与对照组相比,LIPUS组ROS水平无明显变化(P>0.05),见表2。
2.5 LIPUS对MPP+诱导N2a细胞凋亡的影响 照组相比,MPP+组N2a细胞凋亡率明显上升(P<0.01),而MPP++LIPUS组细胞凋亡率较MPP+组下降(P<0.01),且对照组与LIPUS组细胞凋亡率差异无统计学意义(P>0.05),见图3、表2。
2.6 LIPUS对MPP+诱导N2a细胞中TRPM7表达的影响 与对照组相比,MPP+组N2a细胞中TRPM7的mRNA表达水平降低,而MPP++LIPUS组TRPM7的mRNA表达水平较MPP+组显著上升(P均<0.01),见表2。
3 讨论
长久以来,药物一直是治疗PD的传统手段,但其作用有限,且存在不同程度不良反应。超声在神经科学领域显示出了良好应用前景[10]。采用MR引导下聚焦超声技术行丘脑或苍白球切开术,可改善PD患者的震颤及运动障碍[11-12],但以高强度聚焦超声进行组织消融带来各种临床挑战,如手术定位的准确性、手术区域的温度控制及重复治疗的安全性等。近来研究[13-15]显示超声可对刺激区域的神经电活动及相关生物化学反应发挥调控作用。本研究探讨以低强度(50 m/cm2)LIPUS治疗PD的可能性,体外单独作用下并未观察到明显细胞毒性,提示LIPUS具有较好的安全性。
基于各种神经毒素诱导建立多巴胺能神经元损伤模型是进行PD相关研究的重要手段,由MPTP及其活性产物MPP+介导的PD体内外模型体系是常用方法之一[16-17]。N2a细胞为小鼠来源的神经母细胞瘤细胞,是可用于建立PD细胞模型的多巴胺神经元[18-19]。本研究通过MPP+损伤N2a细胞建立PD体外模型,探讨LIPUS对多巴胺神经元的作用。MPP+可选择性蓄积于多巴胺能神经元的线粒体内,导致呼吸链的电子传递效率下降,损伤线粒体功能,使其产生过多ROS而引发氧化应激[20-21];持续氧化应激状态又会进一步加重线粒体功能障碍,二者互为因果且相互影响,最终引发线粒体途径的细胞凋亡[22]。线粒体膜电位稳定是维持线粒体功能正常的先决条件,膜电位降低导致线粒体功能障碍是细胞早期凋亡的一个重要特征[23]。本研究中LIPUS能减缓MPP+引起的线粒体膜电位去极化及ROS累积,并抑制细胞凋亡,原因可能是LIPUS可恢复线粒体膜电位,以保证线粒体功能正常并改善MPP+引起的细胞氧化应激状态,从而抑制细胞凋亡,对多巴胺能神经元发挥保护作用。
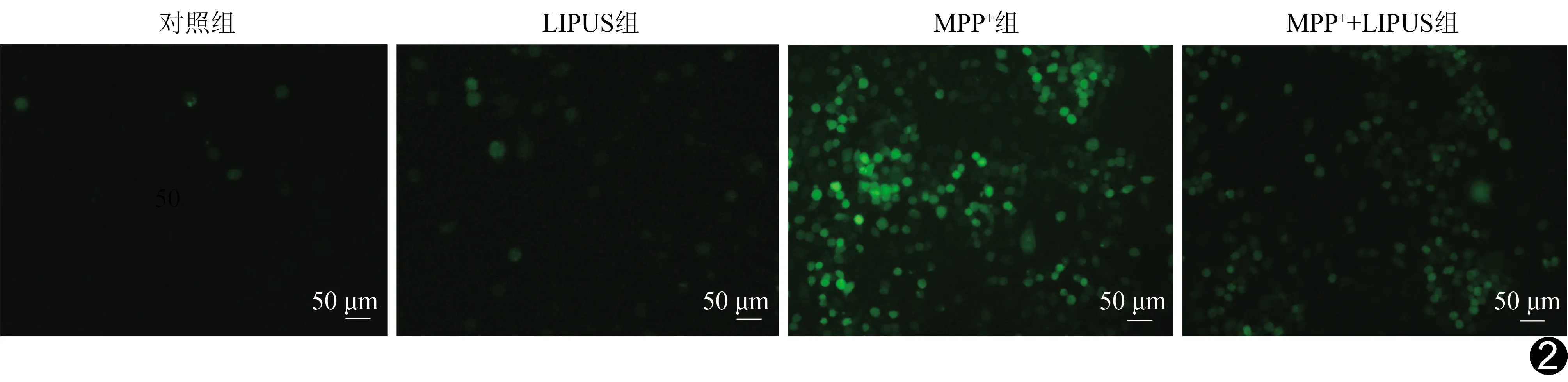
图2 荧光显微镜观察各组DCFH-DA染色结果
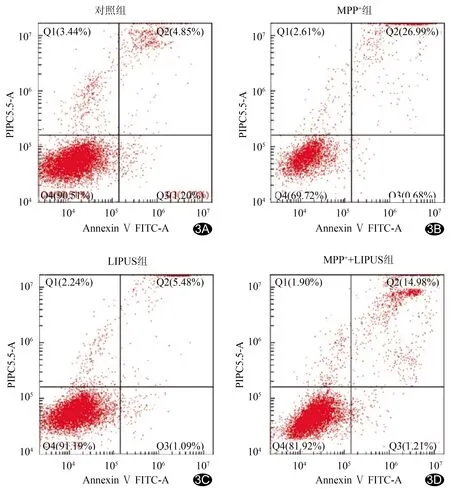
图3 流式细胞术检测结果
TRPM7是瞬时电位受体通道家族的一员,不仅对机械敏感,也对多巴胺能神经元的分化及存活具有重要意义,其功能异常或表达下调可引起多巴胺神经元丢失[24-25]。同时,TRPM7还是一种重要的Mg2+转运体,而Mg2+具有神经调控及抗氧化作用[26-27]。通过补充Mg2+上调TRPM7表达,可抑制神经毒素对多巴胺能神经元的损伤[28]。本研究发现LIPUS处理后可恢复TRPM7表达,提示TRPM7可能参与LIPUS对多巴胺能神经元的保护作用,其机制可能是LIPUS在上调TRPM7表达的同时提高了Mg2+的转运效率,Mg2+与TRPM7协同抑制MPP+的毒性,尚需进一步观察。
本研究发现以50 mW/cm2功率超声处理能缓解MPP+所致N2a细胞损伤,可在一定程度上减轻MPP+的神经毒性作用,提示通过超声的神经调控作用治疗PD或可成为一种潜在策略,其机制有待进一步探讨。

