超声空化联合恩度抑制大鼠Walker-256肿瘤血管新生
余堰澜,乔 伟,冯 爽,黄蕾丹,张 毅,刘 政
(陆军军医大学第二附属医院超声科,重庆 400037)
肿瘤发生、发展及转移依赖于新生血管生成。抗肿瘤血管生成治疗通过破坏和抑制肿瘤新生血管生成,达到抑制肿瘤生长的目的[1]。前期实验[2]发现,微泡增强超声空化在高声压(>4 MPa)水平能物理毁损肿瘤微血管,阻断肿瘤血流可达24 h,故可能成为抗血管生成的物理治疗方法,但不能阻止肿瘤血管在24 h后逐步恢复血供,导致单独微泡超声空化治疗效果并不理想。内皮抑素是迄今最有效的血管生成抑制因子之一,能特异性抑制血管内皮细胞增殖、迁移与血管生成[3]。恩度是人内皮抑素的重组蛋白,也是我国批准用于治疗小细胞肺癌的一线化学治疗药物[4]。抗肿瘤血管生成药以肿瘤新生血管为靶点,单独使用疗效有限[5],联合治疗已成为趋势。本研究通过观察肿瘤血流灌注变化和生长抑制情况,评价肿瘤血流物理阻断联合抗血管生成药物的治疗效果。
1 材料与方法
1.1 实验材料 索尼克脉冲式超声空化治疗仪(CZ-960),治疗头采用弱聚焦圆形换能器,中心频率为830 kHz,脉冲宽度为400个周期,脉冲重复频率9 Hz,峰值负压为4.3 MPa,占空比为0.22%,工作6 s间歇6 s,总辐照时间为6 min。飞依诺彩色多普勒超声诊断仪(VINNO70),X4-12L高频线阵探头(频率范围4~12 MHz)。超声造影(contrast-enhanced ultrasound, CEUS)采用CBI(contrast B imaging)造影模式,机械指数为0.08。注射用GE全氟丁烷微球(Sonazoid,16μl/支),平均直径为2.1 μm,微球外壳厚度2~3 nm,以4 ml无菌生理盐水复溶16 μl微球,充分震荡混匀后微球溶液浓度约6×108/ml。重组人血管内皮抑制素注射液(恩度,15 mg∶3 ml,2.4×105U/支,山东先声麦得津生物制药有限公司)。
1.2 实验动物 8周龄雄性SD大鼠40只(陆军军医大学第二附属医院动物实验中心提供),体质量180~200 g。
1.3 建立模型 将人乳腺癌肉瘤Walker-256细胞(中科院医学药物研究所提供)培养于37℃、5% CO2恒温培养箱中,细胞培养液移入离心管,以1 000 rot/min转速离心5 min,弃上清液。磷酸盐缓冲液重悬,调整细胞浓度至约1×107/ml。随机选取大鼠一侧大腿内侧备皮、消毒,取细胞悬液0.2 ml接种于皮下。
1.4 实验动物分组及处理 经超声测量肿瘤生长至最大径约1.0 cm入组,将荷瘤大鼠随机分为4组,每组10只,施以相应干预。A组:微泡+超声辐照+恩度;B组:恩度;C组:微泡+超声辐照;D组:超声假照。以30 mg/kg体质量腹腔注射1%戊巴比妥钠麻醉大鼠后,仰卧保定于实验台上,建立尾静脉通道;肿瘤生长处备皮后充分暴露。造影结束后,对A组注射恩度溶液5 mg/kg体质量,随后对肿瘤区域进行超声辐照5 min,同时缓慢注射微球稀释液(0.08 ml微球溶液均匀混合于1 ml生理盐水),注射结束后跟注0.5 ml生理盐水冲管;B组注射同量恩度后注射1.5 ml生理盐水;C组给予超声辐照并注射微球稀释液;D组注射1.5 ml生理盐水,将治疗探头置于肿瘤区域但不进行辐照。上述过程每天1次,连续3天。

之后经尾静脉团注0.04 ml微球溶液,随后推注0.5 ml生理盐水冲管,行CEUS并储存图像。以超声诊断仪自带造影分析软件对各组肿瘤动态造影影像进行定量分析。参考二维声像图勾画肿瘤ROI(图1),以时间-强度曲线(time intensity curve, TIC)获得峰值强度(peak intensity, PI)与曲线下面积(area under curve, AUC)。
1.6 组织病理检查 末次造影结束后处死动物,取材剥离肿瘤组织,固定、石蜡包埋后切片,行血管内皮生长因子A(vascular endothelial growth factor A, VEGFA)免疫组化染色,以光学显微镜(×100)筛选染色最密集区,即“热区”,随后于高倍镜(×400)下随机计数3个视野内微血管数,取平均值作为肿瘤微血管密度(microvessel density, MVD)。
1.7 统计学分析 采用SPSS 25.0统计分析软件。PI、AUC、肿瘤体积均符合正态分布,以±s表示。以单因素方差分析比较各组MVD、PI、AUC及肿瘤体积差异,LSD法进行组间两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 CEUS定量指标 干预前造影显示各组肿瘤内部灌注良好,无明显充盈缺损,各组PI及AUC差异均无统计学意义(P均>0.05)。干预结束后1天,A、B、C组肿瘤中心区域可见充盈缺损区,而D组肿瘤仍充盈较好; PI和AUC在A组显著低于其余3组(P均<0.05),B组和C组较D组降低(P均<0.05)。干预后4天,A组肿瘤充盈缺损区仍然存在,而C组可见部分血流恢复,A组PI和AUC比其余3组明显降低(P均<0.05),见表1。
2.2 肿瘤体积 干预前各组肿瘤体积无统计学差异(P均>0.05)。干预后1天,A组肿瘤体积明显低于其余3组(P均<0.05),B组和C组明显低于D组(P均<0.05)。干预后4天,A组肿瘤体积仍明显低于其余3组(P均<0.05),B组也略低于D组(P<0.05),见表2。
2.3 病理检查 干预后4天,镜下观察A组、B组微血管数量少于C组和D组(图2)。肿瘤组织MVD存在差异(F=30.121,P<0.001),A组(18.33±3.10)、B组(24.17±2.16)明显低于C组(30.43±4.17)和D组(31.57±1.74)(P均<0.05),A组与B组、C组与D组之间差异无统计学意义(P均>0.05)。
3 讨论
微泡增强超声空化治疗利用低强度、高声压、脉冲式治疗超声激励超声造影剂微泡,使之发生空化效应,从而产生治疗效应[6]。微泡超声空化可毁损阻断肿瘤微血管,重复性空化治疗可明显抑制肿瘤生长,但需每72 h重复一次,整个周期重复10次以上,时间长达30天[7],且肿瘤血流阻断后,乏氧状态会刺激各种血管生长因子大量释放,促进血管新生[8]。超声空化联合抗肿瘤血管生成药物治疗或许有所帮助。目前综合治疗模式已被证实为治疗恶性肿瘤的有效方法。
已有研究[9-11]表明声孔效应可增强化疗药物的疗效。LUO等[12]证实超声辐照阿霉素载药微泡能介导细胞凋亡和拮抗新生血管生成而抑制肿瘤。HUA等[13]以超声激励诺帝(一种诱导分化的抗肿瘤药物)载药微泡发生空化效应,对兔VX2肿瘤微循环的显著阻断效应。JING等[14]发现超声空化联合恩度载药微泡对裸鼠乳腺癌肿瘤有阻断肿瘤微循环、抑制肿瘤生长的作用。但由于以气体为核心的微泡只有膜表面载药,空间有限,且载药量和包埋率往往很低,药物进入循环后,由于血液稀释而浓度明显降低,同时可能未达靶点就提前释药;且载药微泡的研发周期漫长[15]。
表1 各组Walker256荷瘤模型大鼠CEUS定量指标(±s)
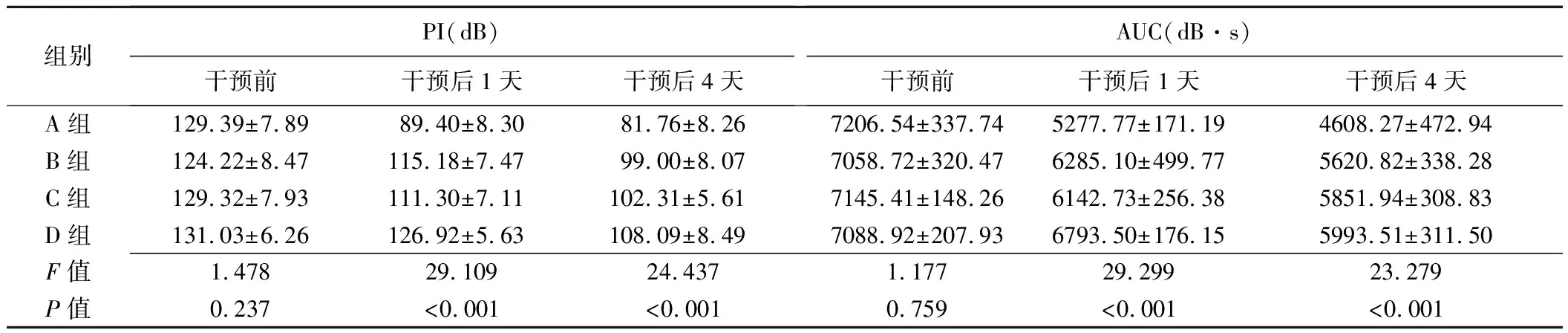
表1 各组Walker256荷瘤模型大鼠CEUS定量指标(±s)
组别PI(dB)干预前干预后1天干预后4天AUC(dB·s)干预前干预后1天干预后4天A组129.39±7.8989.40±8.3081.76±8.267206.54±337.745277.77±171.194608.27±472.94B组124.22±8.47115.18±7.4799.00±8.077058.72±320.476285.10±499.775620.82±338.28C组129.32±7.93111.30±7.11102.31±5.617145.41±148.266142.73±256.385851.94±308.83D组131.03±6.26126.92±5.63108.09±8.497088.92±207.936793.50±176.155993.51±311.50F值1.47829.10924.4371.17729.29923.279P值0.237<0.001<0.0010.759<0.001<0.001

图1 大鼠Walker-256肿瘤二维及CEUS表现 A.二维声像图显示; B.CEUS显示肿瘤,白色区域为ROI; C.TIC
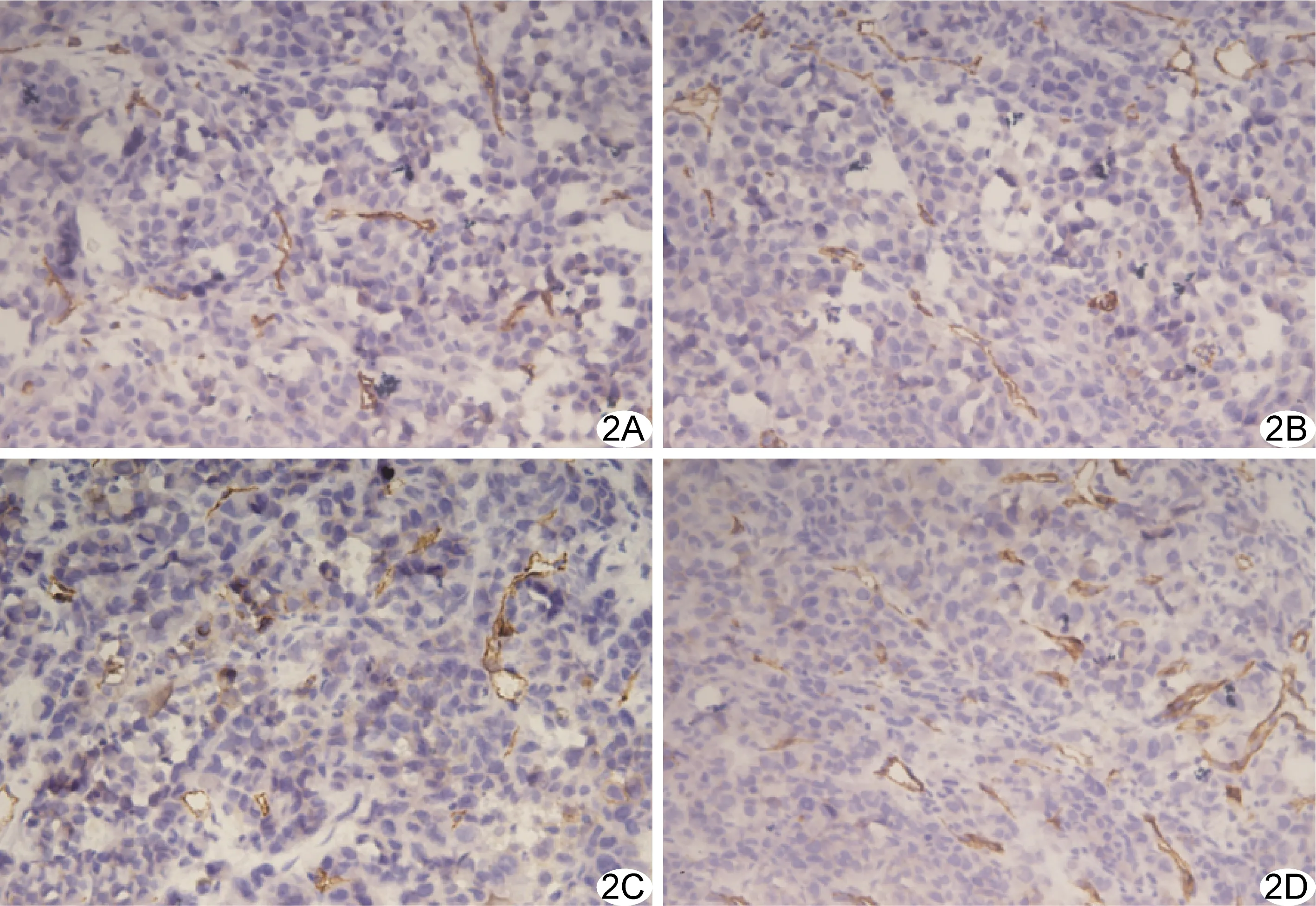
图2 干预后各组肿瘤MVD(VEGFA,×400) A.A组; B.B组; C.C组; D.D组
表2 各组Walker-256荷瘤模型大鼠干预前后肿瘤体积比较(cm3,±s)
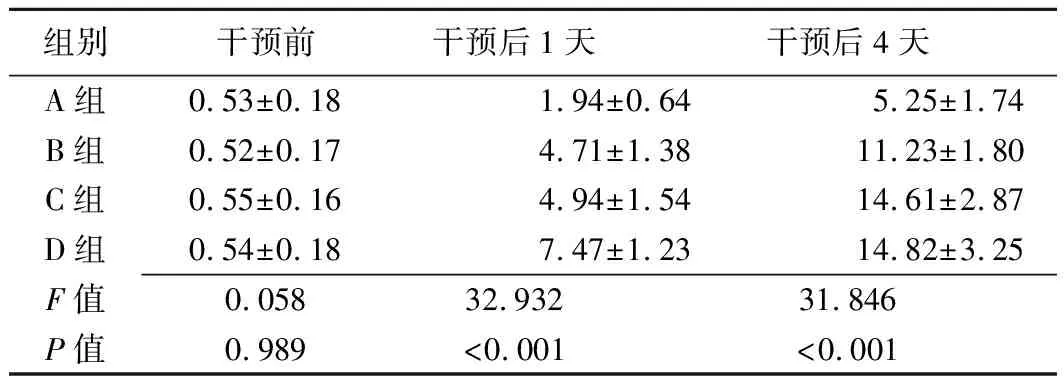
表2 各组Walker-256荷瘤模型大鼠干预前后肿瘤体积比较(cm3,±s)
组别干预前干预后1天干预后4天A组0.53±0.181.94±0.645.25±1.74B组0.52±0.174.71±1.3811.23±1.80C组0.55±0.164.94±1.5414.61±2.87D组0.54±0.187.47±1.2314.82±3.25F值0.05832.93231.846P值0.989<0.001<0.001
超声空化联合经静脉抗血管生成治疗操作相对简单,不仅可借声孔效应从静脉释放大量药物,而且二者均以肿瘤微血管作为治疗靶点,超声空化阻断肿瘤血流联合恩度治疗可能产生协同效应。
本研究结果证实超声空化联合恩度可显著抑制肿瘤生长。本研究采用高峰值负压(4.3 MPa)脉冲式辐照超声激励微泡,空化机械效应强烈,易造成肿瘤微血管毁损。施加干预后1天,A、B、C组PI和AUC均显著下降,且A组最低;干预后4天,A组PI和AUC仍在4组中处于最低水平,提示超声联合恩度治疗能在4天内维持肿瘤循环阻断或低灌注状态,可能是恩度抑制血管新生所致。此时A组肿瘤体积低于其他3组,而B组低于C、D组,且A组肿瘤组织MVD最低,提示超声空化联合恩度具有协同效应,可通过维持肿瘤低灌注状态和阻断新生血管生成而产生更为显著的肿瘤生长抑制作用。
本研究以VEGFA为测定MVD的靶点,初步探讨微泡激励超声空化效应联合恩度抑制肿瘤生长的机制。与D组相比,A、B组MVD明显降低,而C组无明显差异,提示单纯声空化治疗后肿瘤微血管并未得到显著抑制,而微泡超声空化联合恩度表现则出一定的抗肿瘤血管生成的协同作用,推测其可能机制是恩度在超声空化机械毁损肿瘤微血管并阻断肿瘤血流的基础上发挥了抑制肿瘤血管新生的作用。
本实验的主要局限性:未能准确测定外周血及肿瘤局部药物浓度;观察肿瘤仅持续到干预后4天;空化效应联合恩度抑制肿瘤新生血管生成的机制有待进一步探讨。
综上所述,微泡激励超声空化联合恩度可在4天内显著减少Walker-256荷瘤大鼠肿瘤组织内部血流灌注,抑制新生血管生成,从而减缓肿瘤生长,有望为综合治疗肿瘤提供新的思路。

